水草密度对中华小长臂虾养殖池塘水质和生长的影响
刘艳辉,杨炳坤,高春山,刘铁钢,李秀颖,祖岫杰
(吉林省水产科学研究院,长春 130033)
0 引言
中华小长臂虾(Palaemonetes sinensis)属甲壳纲,十足目,长臂虾科,小长臂虾属,为中国唯一有记载的小长臂虾属物种[1]。该虾主要分布于东北、华北直到长江中下游一带[2-4],以北方更为多见[1]。中华小长臂虾是野生的小型经济虾类,自然环境条件下主要栖息于水草茂密的江河浅水区,该虾味道鲜美、营养丰富[5]、深受消费者喜爱。该虾在自然水域中还具有较高的生态价值[6],可作为许多鱼的饵料[7],调节水域的生态环境。近年来,北方渔民采取采捕野生抱卵虾进行池塘繁殖、养殖尝试,取得了很好的养殖效果[8],养殖试验过程中发现,该虾具有适应性强、生长速度快、病害少的特点,适合池塘高密度养殖,是一种经济价值和生态价值较高的虾类,驯化开发价值极大。目前,关于中华小长臂虾的研究报道很少,只见有关形态学[9]、生殖生物学[10]、低温麻醉运输[11]、对盐度的耐受性及盐度对其呼吸的影响[12]、对温度的耐受性及温度对其呼吸的影响[13]、对pH的耐受及呼吸代谢的影响[14]、北方池塘繁育技术等方面的零星报道,尚缺乏关于其基础生物学、养殖生物学、繁殖生物学方面的系统研究,这也极大地限制了中华小长臂虾的进一步开发利用[15]。近年来,由于环境的改变和渔民过度的捕捞,外来物种入侵等原因,造成中华小长臂虾的资源量锐减[16],导致市场供应严重不足,价格不断攀升,目前,该虾在吉林、黑龙江等地平均价格维持在50~60元/kg,封冰后价格可达到80元/kg以上[9]。因此,无论是从保护该虾的自然种群资源,还是开发土著经济虾品种来考虑,中华小长臂虾的人工开发都具有较大价值。本试验在人工养殖条件下,仿天然水域中华小长臂虾的生态环境条件,栽种不同密度水草调节养殖池塘水质,旨在建立一种池塘生态养殖模式,应用于生产实践。
1 材料与方法
1.1 试验材料
试验选9面池塘,面积均为4×666.7 m2,池深2.5 m左右,注水深2.0 m左右,水源为江河水和地下水。试验用虾苗为采捕野生亲虾经过人工繁育所获得,虾苗尾重0.01 g,每666.7 m2池塘放虾苗50万尾。饲料选鲤商品料,粗蛋白含量34.0%。水草选用伊乐藻。试验于2020年5—11月在吉林省舒兰市白房子家庭农场进行。
1.2 试验设计
将9面试验池塘分为A、B、C 3组,每组设3个平行,3组栽种伊乐藻密度分别占池塘面积的10%、30%、50%。3个试验组虾苗放养数量、饲料投喂量、饲养管理等完全相同。虾苗放养后开始监测水温(T)、pH、溶解氧(DO)、氨氮(NH4+-N)、亚硝酸盐氮(NO2-N)、硝酸盐氮(NO3-N)等水质指标,每5天监测一次。
1.3 养殖管理
虾苗入池后每天投喂4次,投喂量以2 h内吃完为宜。试验期间不换水,及时补充蒸发和渗漏部分丢水量。伊乐藻生长旺季,及时刈割,控制各试验组伊乐藻面积不超过试验设计覆盖面积。
1.4 指标监测及方法
1.4.1 水质指标测定 采样时间上午9:00—10:00时,在池塘选5个采样点,采水深0.5~1.0 m,将5个点所采集的水样混合均匀后取1 L。NH4+-N、NO2-N、NO3-N用分光光度法测定(紫外分光光度计Cary 60),水温、pH用维赛YSIprplus水质分析仪现场测定,溶解氧监测(碘量法)水层深度为距离池底0.5m处,各采样点单独监测。
1.4.2 生长性能测定 试验开始和结束分别随机选取不少于50尾中华小长臂虾,测量体长、全长、体质量,并准确统计各池单位面积虾的产量,根据各池单位面积虾的产量和出池时虾的平均体质量计算单位面积虾的出池数量,见公式(1)~(7)。
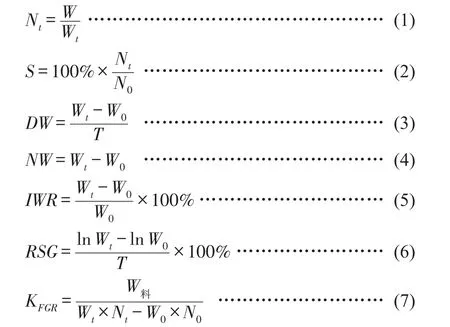
式中,Nt为收获时单位面积虾数量,尾;N0为单位面积放养数量,尾;W为收获时单位面积虾产量,g;W0和Wt分别为放养和收获时虾的平均体质量,g;W料为单位面积投喂饲料总质量,g;S为成活率,%;DW为日增重,mg/d;NW为净增重,g;IWR为增重率,%;SGR为特定生长率,%/d;KFGR为饲料系数。
1.5 数据处理
用Excel对生长数据进行统计分析,数据以“平均数±标准差”表示。
2 结果
2.1 水化指标变化情况
图1可以看出,3个试验组水温从试验开始均呈先升后降的趋势,在25~85天始终为A>B>C,A、C组与B组之间均差异显著(P<0.05),A组与C组之间差异极显著(P<0.01)。第40天均升至最高,而后随着气温的下降,水温逐渐降低。
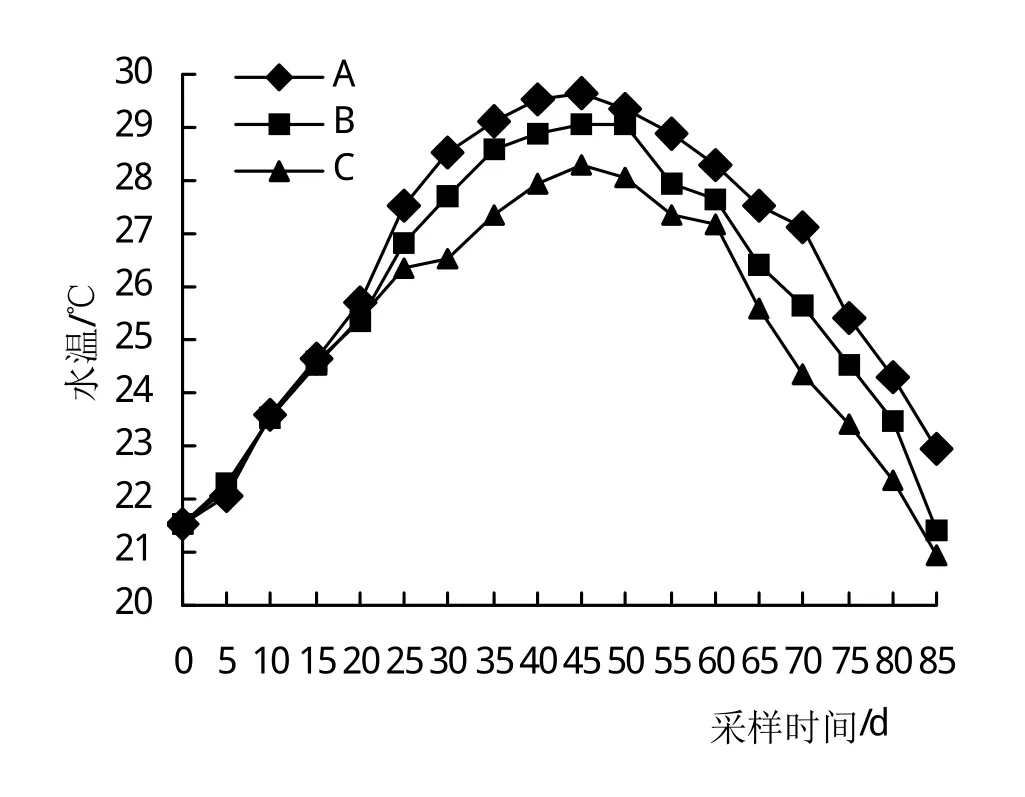
图1 水温变化情况
图2反映了3组溶解氧变化规律,A、B、C 3组变幅分别在4.54~6.25 mg/L、4.56~6.98 mg/L、3.95~7.33 mg/L之间波动。A、B两组变化趋势基本一致,B组始终高于A组,在50~85天差异显著(P<0.05)。C组在25~45天显著高于A、B组(P<0.05),第40天升至最高,在55~85天显著低于A(P<0.05),极显著低于B组(P<0.01)。
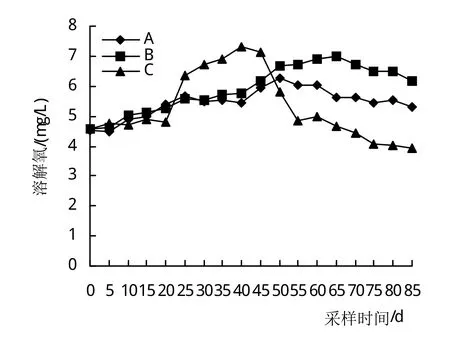
图2 DO变化情况
图3反映了3组pH的变化规律,A、B、C 3组均呈先升后降的态势,最高值分别出现在65天、60天、50天的8.44、8.57、9.36。A、B两组在40~60天差异显著;C组从30天后开始急剧上升,在35~85天与A、B组之间差异显著(P<0.05)。

图3 pH变化情况
图4反映了3组NH4+-N的变化规律,3组NH4+-N波动范围分别为0.64~3.71 mg/L、0.29~3.03 mg/L、0.37~4.56 mg/L。在20~25天,A>B>C,且C组与A、B组差异显著(P<0.05);第40天后,C组急剧上升,C>A>B;在45~85天3组之间均存在极显著差异(P<0.01)。
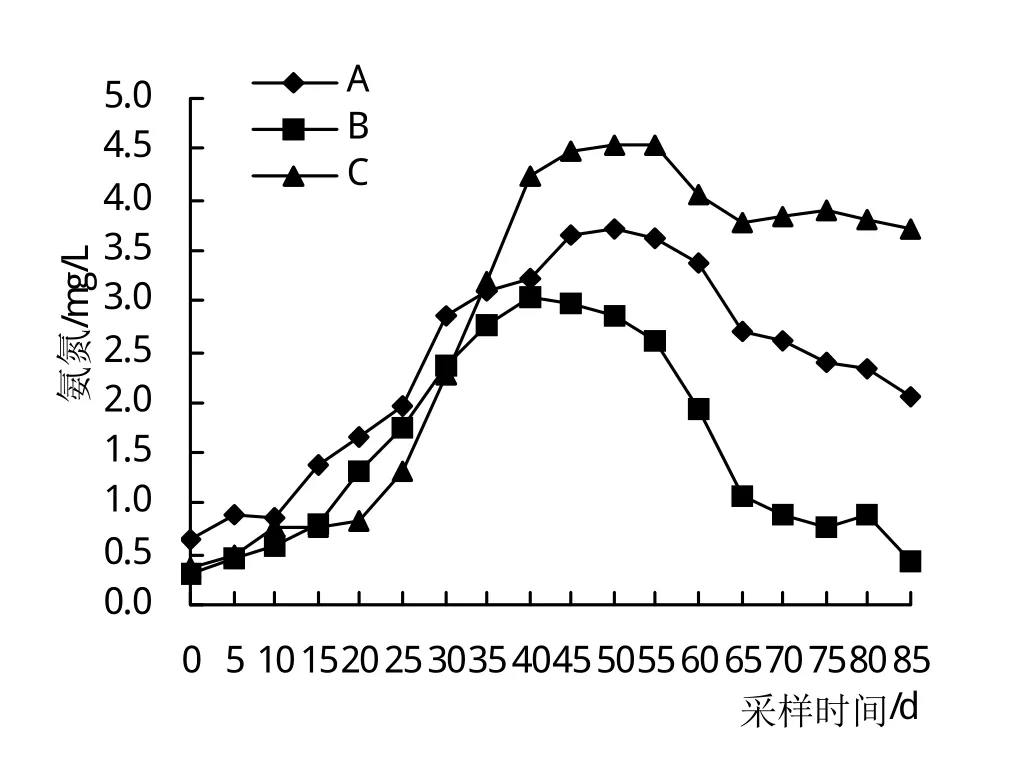
图4 氨氮变化情况
图5反映了3组NO2-N的变化规律,3组NO2-N的波动范围分别为0.37~1.58 mg/L、0.36~1.34 mg/L、0.39~1.64 mg/L。在25~30天,A、B组与C组之间均存在极显著差异(P<0.01);在35~40天,3组之间出现极显著差异(P<0.01);第45天,A组与B、C组之间均存在极显著差异(P<0.01);在50~85天,3组之间均存在极显著差异(P<0.01)。
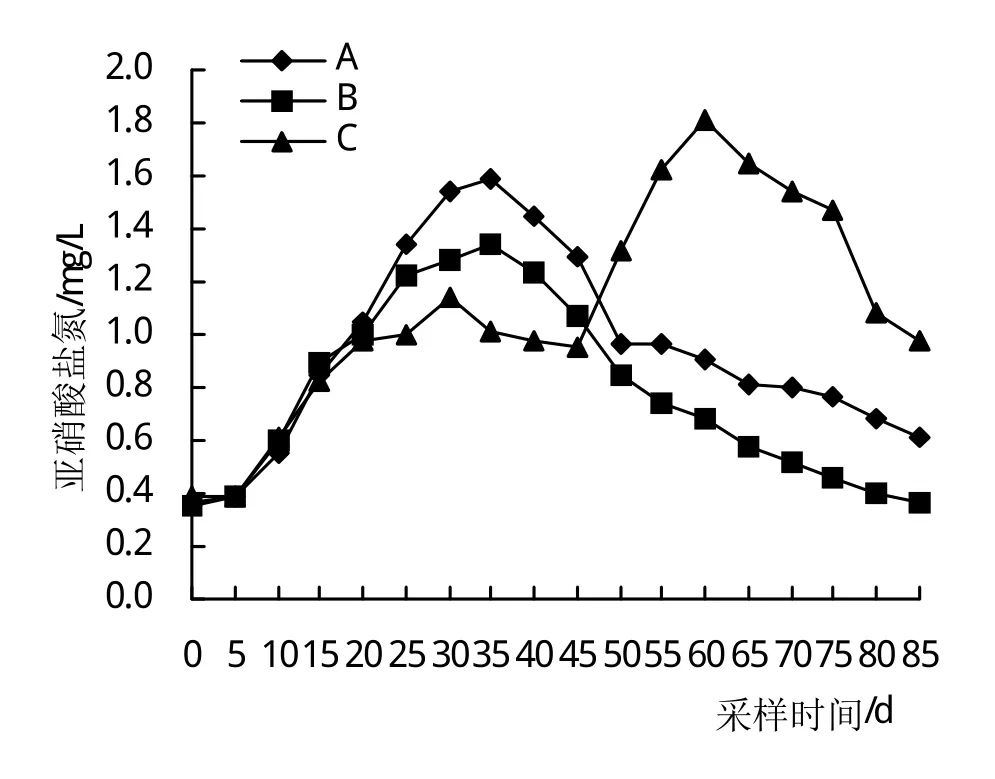
图5 亚硝酸盐氮变化情况
图6反映了3组NO3-N的变化规律,3组NO3-N的波动范围分别为0.76~5.87 mg/L、0.99~4.13 mg/L、0.96~7.23 mg/L。第15天,B、C组差异显著(P<0.05),C、A组差异极显著(P<0.01);在45~50天,A组与B、C组均差异极显著(P<0.01);第55天,B组与A、C组均差异极显著(P<0.01),C、A组之间差异显著(P<0.05);在20~40、65~85天,3组之间相互差异极显著(P<0.01)。
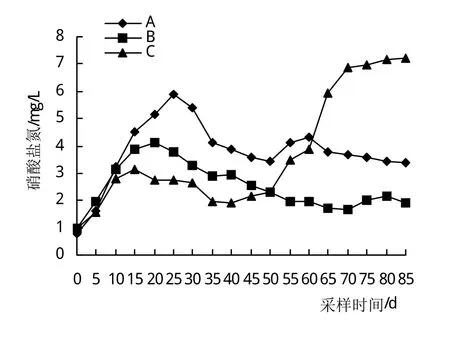
图6 硝酸盐氮变化情况
2.2 生长性能及饲料利用情况
生长性能和饲料利用情况见表1。A、B、C 3组成活率无差异(P>0.05),各项生长指标均为B>A>C,B组与A、C组之间均存在显著性差异(P<0.05)。单位面积产量B>A>C,饲料系数C>A>B,两项指标均B组与C组差异显著(P<0.05)。

表1 生长性能和饲料利用情况
3 讨论
3.1 水草密度对水温、溶氧、pH的影响
水温是影响甲壳动物新陈代谢、生长、发育、繁殖、蜕壳等关键环境因子[4,17-18],虾类是变温水生动物,不同种虾对温度的适宜范围不同,王吉桥等[19]研究南美白对虾最适水温为23~30℃,田相利等[20]研究中国对虾最适水温为29.7℃。邢克智等[21]研究青虾最适水温为(28±0.5)℃。姜宏波等[13]研究中华小长臂虾能耐受高温上限为37℃,30℃时耗氧率最高,25~30℃耗氧率无差异,表明中华小长臂虾在25~30℃时新陈代谢旺盛。本研究A、B、C 3组在25~30℃区段变化时长分别为56、51、41天,C组对中华小长臂虾适温时长窄于A、B组,从温度变化上看,A、B组更适合中华小长臂虾的生长。
DO是养殖水质好坏的重要理化指标,DO不足引起鱼虾浮头,甚至死亡。水生植物光合作用,提高水体DO含量,促进污染物的快速分解或转化[22]。时顺娣[23]研究青虾养殖结果表明,池塘栽种伊乐藻面积30%左右为宜,显著提高养殖水体DO。李定国等[17]研究水草密度对河蟹池塘水质影响结果表明,伊乐藻覆盖35%时DO始终保持6.0 mg/L以上。本研究低温时3组变化无差异,25天后,A组始终低于B组,分别在5.30~6.03 mg/L、6.15~6.98 mg/L之间波动,在25~45天,C组由于水草面积大,DO高于A、B组,最高达到7.33 mg/L,在45天后,水温升高,C组水草密度过高且死亡腐烂,有机耗氧量加大,致使DO急剧下降,在50~85天,DO在3.95~4.83 mg/L波动,本试验条件下B组增氧幅度最高,与上述二位学者研究结果相吻合。
pH是甲壳动物养殖环境中重要因素之一,其值因水生植物数量的变化而变化[14,24],水生植物光合作用使HCO3-转化成CO32-,pH逐渐升高[24]。因此,水草密度越大,pH越高,由图3不难看出,试验前期,水温较低,水草没有达到预期的覆盖面积,3组pH变化差异不大,20天后,随着温度升高,水草生长旺盛,C组pH迅速升高,C组大于9.0时段在50~80天。姜宏波等[14]研究pH对中华小长臂虾安全值为9.51,但超过pH 9时,中华小长臂虾耗氧率增加,排氨率降低。朱爱意[25]和章龙珍等[26]研究认为,pH不适时,水产动物会增大耗氧率和排氨率。C组高pH时段过长,为了适应环境消耗过多能量,造成耗能增大、耗氧率增高[14],虽然中华小长臂虾在该环境下能够生存,但不适于生长。
3.2 水草密度对氨氮、亚硝酸盐、硝酸盐的影响
NH4+-N是甲壳动物高密度养殖过程中最重要的胁迫因子之一[27],高浓度的NH4+-N不仅影响甲壳动物的快速生长,还会造成免疫力下降、代谢机能紊乱、发病率高[14]。水生植物可以吸收、消化水体中的大量营养物质,对氮具有良好的去除效果[28]。虽然不同水生植物去氮效果不同,但总体来说,去氮效果明显[29]。包杰等[30]研究表明,在水温(18±1)℃,NH4+-N对中华小长臂虾安全浓度为27.25 mg/L。随着试验的进行,3个试验组NH4+-N浓度逐渐上升,在10~30天,高密度水草组NH4+-N低于低密度水草组,B组低于A组,由于C组水草密度相对较大,高温季节水草老化腐烂,耗氧率增加,致使C组NH4+-N浓度上升,第50天达最高4.55 mg/L。该值虽然低于包杰等[30]研究的安全浓度27.25 mg/L,但安全浓度范围内的NH4+-N也会对虾体的生理功能造成不良影响[18]。本试验条件下B组降NH4+-N效果最为显著。
NO2-N是集约化养虾环境中重要的污染成分[31],水体中的NO2-N进入虾类血液后,对机体产生毒害作用[32]。李定国等[17]研究表明,水草光合作用释放大量氧气,减少NO2-N的含量,降低对虾的毒性。从图5可以看出,在25~45天NO2-N含量与水草密度呈负相关,第45天后,水温升高,C组水草老化腐烂,有机耗氧量增加,氨氮转化为硝酸盐氮受阻,使NO2-N升高,在45天后C组NO2-N急剧上升,在45~85天,C>A>B,试验期间A、B、C 3组的最高值分别为1.58 mg/L、1.34 mg/L、1.81 mg/L。包杰等[32]研究表明,NO2-N对中华小长臂虾安全浓度为2.32 mg/L,虽然3个试验组NO2-N均低于安全浓度,但在低浓度NO2-N条件下对虾类氧消耗、氨排泄均有显著影响[33]。本试验条件下B组降NO2-N效果最为显著。
NO3-N是含氮有机物氧化分解的最终产物,养殖水体中不达到一定浓度对养殖水产动物是不会产生毒害作用的。彭自然等[33]研究表明,NO3-N大于150 mg/L时,对南美白对虾生长不利。蒋天宝[18]研究表明,NO3-N浓度910 mg/L时对虾生长存活产生不利影响。水草对NO3-N降解是因为NO3-N是水生植物重要的养分,通过根茎吸收,从而达到降解的目的。从图6看,3个试验组NO3-N最高值只有7.22 mg/L,不会对养殖虾造成危害。
3.3 水草密度对生长和饲料利用的影响
虾的生长受多方因素影响,在人工养殖条件下,其可控因素主要是密度、水环境、饲料营养等。本试验在养殖池塘移栽不同密度伊乐藻调控养殖池塘水质,提高生长性能和饲料利用率,是通过水草调节水温、pH、溶解氧、降低氨氮和亚硝酸盐等来实现的。养殖池塘生态平衡、水质稳定是提高生长性能、提高饲料利用率、提高产量的关键因素之一,通过水生植物调控养殖水质来实现这一目的已得到业界的认可[34]。从表1看,出池规格、日增重、净增重、增重率、特定生长率均为B组最高,分别为(0.50±0.031)g、(5.80±17.83)mg、(0.49±0.031)g、(4933.33±305.51)%、(1.99±0.27)%/d,而且B组与A、C组之间均存在显著差异。单位面积产量B组最高,为(152.5±17.83)kg,且与C组之间差异显著。饲料系数B组最低,为1.16±0.14,且与C之间差异显著。B组虽然成活率最低(62.03±9.31)%,但与A、C两组之间无差异。3个试验组养殖效果上出现差异,是由于伊乐藻密度不同,对水质调节能力不同,最后出现的养殖结果不同。研究证明,养殖水体中高浓度NH4+-N、NO2-N会使虾体代谢出现障碍,轻者生长受阻,重者免疫力下降,发生疾病,甚至死亡[35],本试验再一次证明了水生植物对养殖水质的调节作用及对养殖动物生长性能和饲料利用的影响。
4 结论
从试验结果看,A、B、C 3组适宜虾生长的最适水温(25~30℃)时长分别为56、51、41天;B组在55天后DO显著大于A、C组(P<0.05);A、B组pH在正常范围内变动;B组NH4+-N在40~85天最低(0.43~3.03mg/L);B组NO2-N在50~85天最低(0.36~0.85 mg/L),与A、C组之间存在极显著差异(P<0.01);B组NO3-N在55天后最低(1.68~2.14 mg/L),与A、C组之间均存在极显著差异(P<0.01)。各项生长指标均为B组最高,与A、C组存在显著差异(P<0.05)。B组饲料系数最低(1.16±0.14),与C组差异显著(P<0.05)。上述结果表明,中华小长臂虾池塘栽种适宜面积的伊乐藻对养殖水质和生长调控作用明显,能显著提高DO,降低NH4+-N、NO2-N等有害物质,提高生长性能和饲料利用水平,从试验结果综合分析,伊乐藻密度30%组效果最佳。

