巴戟天对慢性应激大鼠肠道微生物代谢多样性的影响
李宇,蔡萧君,王钦,吴圆圆,颉彦鹏,胡杨
黑龙江省中医药科学院,黑龙江 哈尔滨 150036
巴戟天为茜草科植物巴戟天How的干燥根,以寡糖、多糖、环烯醚萜苷、黄酮、氨基酸、蒽醌类及维生素等为主要成分,其中寡糖含量近50%,具有明确的抗抑郁活性。研究表明,巴戟天主要通过提高5-羟色胺(5-HT)、脑源性神经营养因子(BDNF)、谷氨酸受体亚单位-1(GluR1)表达和调节海马神经可塑性发挥抗抑郁作用。国外研究发现,巴戟天抗抑郁作用与调节肠道微生态密切相关,微生物-肠-脑轴在抑郁症发病中起重要作用,但其具体机制尚不明确。Biolog微生物鉴定分析系统可通过观察微孔板中 31种碳源的利用情况和颜色变化,分析微生物对目标代谢途径的影响,构成群落整体代谢特征指纹。基于此,本研究采用Biolog技术,结合《保健食品检验与评价技术规范》中的菌群检测方法与判定标准,选取6种常驻菌属进行选择性培养,分析巴戟天干预后大鼠肠道菌群结构和整体代谢的变化规律,观察巴戟天对慢性应激大鼠肠道微生物的影响,探讨其抗抑郁的作用机制。
1 材料与方法
1.1 动物
SPF级健康雄性SD大鼠,8周龄,40只,体质量(200±20)g,哈尔滨医科大学实验动物部提供,动物许可证号SCXK(黑)2019-0001。饲养于黑龙江省中医药科学院SPF级动物实验室,温度(20±1)℃,相对湿度(50±5)%,每日12 h光照,自由摄食饮水,适应性饲养1周。
1.2 药物及制备
巴戟天免煎颗粒剂,江阴天江药业有限公司,10 g/袋,称取20 g,研钵碾碎,加少量蒸馏水,置于100 ℃恒温水浴锅中加热,充分搅拌至完全溶解,加蒸馏水定容至60 mL,制成原药材浓度为0.33 g/mL的药液,分装后4 ℃密封保存。盐酸氟西汀分散片,批号9492AA,法国礼来,20 mg/片,蒸馏水配制成浓度为0.33 g/mL的药液。
1.3 主要试剂与仪器
类杆菌-胆汁-七叶苷(BBE)琼脂(批号20190327)、伊红美蓝(EMB)琼脂(批号 20190413)、乳酸杆菌选择性(LBS)琼脂(批号 20190223)、莫匹罗星锂盐改良(MRS)培养基(批号20190129)、Pfizer肠球菌选择性(PSE)琼脂(批号20190602)、胰胨-亚硫酸盐-环丝氨酸(TSC)琼脂(批号20190516),青岛海博生物技术有限公司。菌落/显微细胞分析仪(型号MF4),杭州迅数科技有限公司;Biolog微孔板,美国Axygen公司;敞箱,100 cm×100 cm×50 cm,自制;玻璃桶,30 cm×50 cm×5 mm;悬尾仪(型号SA2100),江苏赛昂斯公司。
1.4 分组及造模
40只雄性SD大鼠随机分为正常组、模型组、巴戟天组和氟西汀组,每组 10只。除正常组外,其余各组大鼠采用慢性不可预知温和应激结合孤养制备慢性应激大鼠模型。根据随机数字表法每日定时选择1种刺激方法,包括以下7种:①电击足底1 min;②4 ℃冰水游泳5 min;③悬尾3 min;④夹尾1 min;⑤禁食24 h;⑥禁水24 h;⑦夜间光照12 h。孤养方法为每只大鼠单独1笼,各笼之间用不透光挡板遮挡。共造模6周。
1.5 给药
造模结束后,巴戟天组予巴戟天药液(3.17 g/kg)灌胃,氟西汀组予氟西汀溶液(3.17 mg/kg)灌胃,给药体积 9.606 mL/kg,正常组和模型组予蒸馏水(6.3 mL/kg)灌胃,每日1次,连续给药8周后,进行行为学实验。
1.6 行为学实验
1.6.1 悬尾实验
参考文献[12]方法进行悬尾试验。将大鼠尾巴(距离末端约1 cm)固定在桌面上方50 cm处的金属棒上,持续6 min,大鼠之间用聚苯乙烯泡沫隔板隔开,测定大鼠在5 min内的悬尾挣扎时间。
1.6.2 强迫游泳实验
参考文献[13]方法进行强迫游泳实验。将大鼠放入透明无盖玻璃水桶中,持续6 min,记录大鼠在4 min内的自主游泳时间(大鼠处于直立姿势或仅以微小动作保持头部位于水面上,则被认为“不动”),实验时各玻璃桶间用隔板隔开。
1.6.3 旷场实验
旷场置于暗室,由不透明钢板制成,将大鼠单独放入旷场一角,记录大鼠运动轨迹和行为,分析大鼠在5 min内的移动总距离。
1.7 粪便收集、处理及检测
给药结束后,收集各组大鼠粪便,置于无菌 EP管中,每管分装2~3粒,置于4 ℃冰箱保存。无菌条件下称取粪便样品1 g,加入10 mL生理盐水,涡旋振荡,1 000 r/min离心5 min,除去食物残渣,取上清液,稀释成浓度为10~10g/mL的菌悬液。选取10g/mL菌悬液,用灭菌刮铲将菌液均匀涂抹在 6种选择性培养基上,将培养皿倒置,恒温培养,至长出菌落后计数。
采用 Biolog微孔板检测碳源代谢过程中的吸光度变化,分析肠道微生物对底物碳源的利用能力,碳源分类及编号同文献[14]。取10g/mL菌悬液迅速接种至Biolog微孔板,每孔150 μL,放入37 ℃恒温厌氧培养箱中,利用Biolog微生物鉴定分析系统,分别于接种后24、48、72、96、120、144、168 h进行读数测定,计算每孔颜色平均变化率(AWCD)。AWCD=Σ(C-R)/n,C为碳源孔在波长 590 nm与750 nm吸光度的差值,R为对照孔的吸光度差值,n为碳源数目31。
选取 Biolog微孔板培养 72 h的数据,计算其Shannon指数、Shannon均匀度、Simpson指数和McIntosh指数。
1.8 统计学方法

2 结果
2.1 巴戟天对模型大鼠行为学的影响
与正常组比较,模型组大鼠悬尾挣扎时间、自主游泳时间显著缩短(<0.05),旷场内移动总距离显著减少(<0.05),伴见嗜睡、反应迟钝、反抗减少等表现;与模型组比较,巴戟天组和氟西汀组大鼠悬尾挣扎时间、自主游泳时间显著延长(<0.05),旷场内移动总距离显著增加(<0.05)。结果见表1。

表1 各组大鼠行为学实验比较(±s)
2.2 巴戟天对模型大鼠代谢组学的影响
2.2.1 聚类分析
对各组31种碳源进行聚类,结果见图1。当聚类距离≤5时,正常组和巴戟天组碳源被聚为4类,模型组碳源被聚为6类,氟西汀组碳源被聚为5类。4组中均有 β-甲基-D-葡萄糖苷、D-半乳糖酸-γ-内酯、D-半乳糖醛酸、G-肝糖、D-纤维二糖、D,L-α-甘油聚为一类。正常组中N-乙酰基-D-葡萄胺、葡萄糖-1-磷酸盐、D-葡萄胺酸、D-木糖未聚在该类,模型组中D-甘露醇、L-丝氨酸、D-葡萄胺酸未聚在该类,巴戟天组中吐温80、L-天冬酰胺酸、α-D-乳糖未聚在该类,氟西汀组中吐温80、L-丝氨酸未聚在该类。

图1 各组大鼠肠道微生物代谢聚类分析
2.2.2 巴戟天对模型大鼠肠道 6种常驻菌数量的影响
与正常组比较,模型组大鼠肠道内双歧杆菌、乳酸菌数量显著减少(<0.05),脆弱拟杆菌、肠球菌、肠杆菌和产气荚膜梭菌数量显著增加(<0.05);与模型组比较,巴戟天组大鼠肠道内双歧杆菌、乳酸菌数量显著增加(<0.05),脆弱拟杆菌、肠球菌、肠杆菌和产气荚膜梭菌数量显著减少(<0.05),氟西汀组大鼠肠道内双歧杆菌数量显著增加(<0.05),脆弱拟杆菌、肠球菌、肠杆菌、产气荚膜梭菌数量显著减少(<0.05);与巴戟天组比较,氟西汀组大鼠肠道内脆弱拟杆菌、乳酸菌、产气荚膜梭菌数量显著减少(<0.05),肠杆菌数量显著增加(<0.05)。结果见表2、图2。

图2 6种培养基菌落形态比较

表2 各组大鼠肠道6种常驻菌数量比较(±s)
2.2.3 巴戟天对模型大鼠肠道微生物每孔颜色平均变化率的影响
AWCD常用于评价微生物对单一碳源的利用能力和代谢总体活性,可在一定程度上反映微生物群落的数量和结构特征。厌氧培养48 h内,各组大鼠肠道微生物 AWCD均逐渐增加,组间差异不明显,表明肠道微生物的总体代谢活性随培养时间延长而逐渐增加。48 h后,组间开始出现显著差异,正常组大鼠肠道微生物 AWCD上升速度最快且持续时间最长,72 h后趋于平稳,其AWCD最大。巴戟天组大鼠肠道微生物AWCD上升速度较平缓,72 h后趋于平稳。氟西汀组、模型组大鼠肠道微生物 AWCD上升持续时间最短,在48 h后就开始趋于缓和。对各组大鼠肠道微生物培养72 h的AWCD进行比较,结果为正常组>巴戟天组>氟西汀组>模型组。结果见图3。

图3 各组大鼠肠道微生物AWCD比较(±s)
2.2.4 巴戟天对模型大鼠肠道微生物代谢多样性的影响
与正常组比较,模型组大鼠肠道微生物Shannon指数、Shannon均匀度、Simpson指数和McIntosh指数均显著降低(<0.01);与模型组比较,巴戟天组大鼠肠道微生物 Shannon指数、Shannon均匀度、Simpson指数和McIntosh指数显著升高(<0.01),氟西汀组大鼠肠道微生物Shannon指数、McIntosh指数显著升高(<0.01),而Shannon均匀度、Simpson指数差异无统计学意义(>0.05);与巴戟天组比较,氟西汀组大鼠肠道微生物 Shannon均匀度、Simpson指数显著降低(<0.01),而Shannon指数、McIntosh指数差异无统计学意义(>0.05)。结果见表3。

表3 各组大鼠肠道微生物多样性指数比较(±s)
2.2.5 主成分分析
Biolog分析结果表明,大鼠肠道微生物对微孔板中大多数碳源都具有代谢能力,但不同组别对不同碳源的代谢有明显差异。主成分分析结果显示,正常组、模型组、巴戟天组、氟西汀组碳源中,成分1方差贡献率分别为84.68%、68.60%、69.69%和84.70%。见图4。
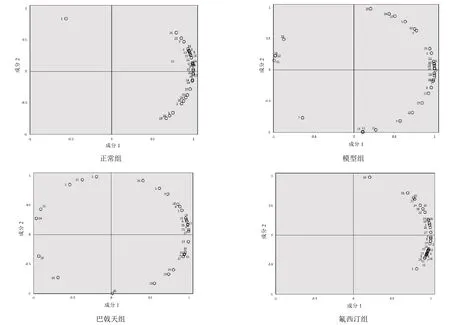
图4 各组大鼠肠道微生物代谢主成分分析
分析4组大鼠肠道微生物对31种碳源的代谢能力,正常组成分1在D-甘露醇、D,L-α-甘油、G-肝糖、L-苏氨酸、衣康酸、D-纤维二糖、L-丝氨酸、腐胺及L-精氨酸等碳源上有较高的载荷,表明在正常组中这些碳源对成分1贡献率较大。模型组成分1在D-半乳糖酸-γ-内酯、α-丁酮酸、L-苏氨酸、2-羟基苯甲酸、吐温80、I-赤藻糖醇、D-纤维二糖、衣康酸、腐胺及L-苯基丙氨酸等碳源上有较高载荷。巴戟天组成分1在D-半乳糖醛酸、L-天冬酰胺酸、α-丁酮酸、L-苏氨酸、D-木糖、N-乙酰基-D-葡萄胺、D-纤维二糖、D,L-α-甘油及L-精氨酸等碳源上有较高的载荷。氟西汀组成分1在α-环式糊精、L-丝氨酸、β-甲基-D-葡萄糖苷、D-半乳糖醛酸、L-苏氨酸、吐温40等碳源上有较高载荷。正常组和巴戟天组成分 1在糖类、氨基酸类和羧酸类碳源上都有较高载荷,模型组增加了酚酸类和胺类碳源,氟西汀组增加了聚合物类碳源。
正常组成分2在4-羟基苯甲酸、D-苹果酸等碳源上有较高载荷,表明在正常组中这些碳源对成分2贡献率较大。模型组成分2在葡萄糖-1-磷酸盐、D-甘露醇、甘氨酰-L-谷氨酸及D,L-α-甘油等碳源上有较高载荷。巴戟天组成分2在苯乙基胺、吐温40及衣康酸等碳源上有较高载荷。氟西汀组成分2在4-羟基苯甲酸等碳源上有较高载荷。D,L-α-甘油等糖类碳源在正常组和巴戟天组中对成分1贡献率较大,在模型组和巴戟天组中对成分2贡献率较大。D-半乳糖醛酸等糖类碳源在巴戟天组和氟西汀组中对成分 1贡献率较大,在正常组和模型组中对成分1和成分2贡献率都不大。衣康酸等羧酸类碳源在正常组和模型组中对成分1贡献率较大,在巴戟天组中对成分2贡献率较大。L-精氨酸等氨基酸类碳源在正常组和巴戟天组中对成分1贡献率较大,在模型组和氟西汀组中对成分1和成分2贡献率都不大。
3 讨论
肠道菌群是相对稳定的定植微生物群落,在大脑与肠道之间的双向信号传导中发挥重要作用,可通过微生物-肠-脑轴改变大脑的认知和情感过程。研究表明,拟杆菌是抑郁症患者肠道中的主要富集菌种,是抑制性神经递质γ-氨基丁酸(GABA)的主要产生细菌,可通过谷氨酸-谷氨酰胺-GABA循环调控微生物-肠-脑轴而引发抑郁样行为。肠球菌能促进结肠上皮细胞中肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6的表达,通过神经炎症途径导致抑郁。产气荚膜梭菌α毒素可以激活酪氨酸激活酶A的双重途径,诱导A549细胞中促炎因子IL-8的释放,通过免疫炎症引起抑郁相关行为的发生。双歧杆菌能生成大量色氨酸、烟酸酯和叶酸,而色氨酸为单胺类神经递质5-HT的主要来源,5-HT和叶酸水平与抑郁症严重程度呈负相关。同时,双歧杆菌还可促进抗炎因子IL-5和IL-10的生成,显著改善抑郁相关行为。大肠杆菌可通过提高海马区 TNF-α、IL-1β表达抑制海马神经再生,还可引起下丘脑-垂体-肾上腺轴亢进、血清皮质酮含量升高,诱发抑郁症。乳酸菌可提高纹状体 5-HT、多巴胺水平,通过迷走神经抑制中枢GABA受体mRNA表达,抑制TNF-α介导的IL-8表达,从而改善抑郁症状。Huo等研究显示,抑郁症患者粪便菌群移植可引起大鼠的抑郁样行为。Aizawa等随机对照临床试验表明,服用益生菌胶囊(嗜酸乳杆菌、干酪乳杆菌和双歧杆菌)能明显改善抑郁症患者症状。因此,明晰抑郁模型大鼠肠道微生物特征及演变规律是掌握巴戟天抗抑郁机制的关键,对延缓抑郁症进展具有重要意义。
本研究采用慢性不可预知温和应激结合孤养制备抑郁大鼠模型,行为学实验结果表明,巴戟天可改善大鼠抑郁行为,且与氟西汀无显著差异。Biolog微孔板中的31种碳源分为糖类、氨基酸类、聚合物类、羧酸类、胺类和其他化合物6类,但造模和药物干预使大鼠肠道菌群发生明显变化,传统化学分类无法切实反映微生物菌群对不同碳源的利用情况,因此,需对 31种碳源进行重新分类。聚类分析显示,模型大鼠碳源利用比较分散,经巴戟天或氟西汀治疗后,碳源利用相对较集中,且巴戟天组碳源利用情况更接近正常组,可见巴戟天疗效更显著。采用稀释平板菌落计数法统计大鼠6种常驻菌数量发现,巴戟天可调节模型大鼠肠道中条件致病菌脆弱拟杆菌、肠球菌、肠杆菌数量趋于正常水平,促进有益菌乳酸菌、双歧杆菌增殖,使其迅速成为优势菌种,并抑制有害菌产气荚膜梭菌增殖,最终恢复肠道微生态平衡。氟西汀对模型大鼠肠道中脆弱拟杆菌、肠杆菌和产气荚膜梭菌具有明显抑制作用,对双歧杆菌和肠球菌的调节作用与巴戟天相当,而对慢性应激引起的乳酸菌数量下降无显著调节作用。
AWCD表示大鼠肠道微生物对不同碳源的利用能力和整体代谢活性。Shannon指数用于评价肠道微生物菌群丰富度,数值越大表明该微生物群落功能多样性越高,反之越低。Shannon均匀度是在菌群丰富度基础上衡量微生物个体分布的均匀度。Simpson指数和 McIntosh指数都表示多样性测度,表征某些常见菌种优势度和均匀度。Biolog数据分析表明,慢性应激使大鼠肠道微生物碳源代谢能力和总体活性发生显著变化,培养72 h后趋于平稳,正常组大鼠肠道微生物 AWCD最大,巴戟天能调节模型大鼠肠道微生物 AWCD趋于正常,且调控作用明显优于氟西汀。巴戟天可上调模型大鼠 Shannon指数、Shannon均匀度、Simpson指数和McIntosh指数,以上结果提示,巴戟天有助于大鼠肠道微生物整体丰富度和均匀度、常见菌种优势度和均匀度的恢复,而氟西汀着重于调节Shannon指数和McIntosh指数,有助于大鼠肠道微生物整体丰富度和常见菌种均匀度的恢复,可见巴戟天和氟西汀对大鼠肠道微生物总体均匀度和有益菌种优势度的调节作用不同。主成分分析显示,造模后大鼠肠道微生物总体代谢平衡被破坏,氟西汀能使模型大鼠肠道微生物对聚合物类碳源的利用增加,可能与其经肝脏代谢和影响胃肠道功能有关;巴戟天可恢复微生物代谢平衡,可能与巴戟天有效成分溶出和对模型大鼠肠道微生物的调节作用相关。巴戟天组 N-乙酰基-D-葡萄胺、D-纤维二糖、D,L-α-甘油等糖类碳源和L-天冬酰胺酸、L-苏氨酸、L-精氨酸等氨基酸类碳源具有较高贡献率。其中,L-精氨酸为动物体蛋白合成的必需氨基酸,经一氧化氮合酶氧化生成一氧化氮(NO),而NO作为中枢神经递质参与介导抑郁症等多种疾病的生理病理进程,巴戟天可能通过干预 L-精氨酸-NO-环鸟苷单磷酸信号通路发挥抗抑郁作用。
综上所述,巴戟天对模型大鼠肠道菌群结构和代谢多样性的调节作用与其抗抑郁作用具有相关性,其对糖代谢和氨基酸代谢具有显著调节作用。本研究结果可为巴戟天的临床应用和深入研究微生物-肠-脑轴机制奠定实验基础。巴戟天对慢性应激大鼠肠道微生物代谢的调控是通过哪些酶和代谢途径发挥作用,有待采用高通量基因测序、代谢组学等方法进一步研究。

