塞来昔布对类风湿关节炎大鼠肿瘤坏死因子-α信号通路及滑膜细胞的影响
王俊苹 杜健磊 李 慧
(1 驻马店市中心医院药学部,驻马店 463000;2 河南大学附属医院风湿免疫科,开封 475000)
类风湿关节炎(rheumatoid arthritis,RA)属于自身免疫系统疾病,如不进行手术或者有效治疗可导致关节病变,影响行动能力[1]。据不完全统计,全球每年RA 患者新增人数超过1 百万,且男女比率失调,40~50 岁女性较多,这可能与更年期钙流失有关[2]。有研究发现,RA 疾病的产生会导致一些心脑血管及肺疾病产生,影响患者生命质量[3]。成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)对RA 机体关节组织具有多种活性作用,在RA 病变过程中常表现为异常活化增殖,诱导关节肿胀及炎症反应。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可通过激活多种信号诱导其他细胞因子参与RA 炎症反应中。近几年,临床针对TNF-α 的抑制药物不断更新,并逐渐应用于RA 疾病的治疗中,取得较好的效果[4]。塞来昔布是一种COX-2 类抑制剂,抑制作用较强,并对患者肠胃代谢功能无明显毒副作用[5],但对RA 患者病变位置的滑膜细胞及TNF-α 信号的影响目前研究较少。因此,本研究建立RA 大鼠模型,观察塞来昔布对其滑膜细胞及TNF-α 水平的影响。
1 材料和方法
1.1 动物与分组
购自郑州大学实验动物研究中心的36 只SPF级SD 雄性大鼠,体质量200~250 g,适应周围环境后,随机数字法分为3 组,分别为正常大鼠(正常对照组),建立RA 模型(RA 组)及建立RA 模型后灌胃塞来昔布(实验组),每组12 只。
1.2 主要试剂盒仪器
塞来昔布胶囊(辉瑞制药,国药准字:J20110099);TNF-α、β-actin 抗体(诚研生物);H-E染色、TUNEL 试剂盒(上海胜隆)。
1.3 RA 大鼠模型建立
RA 组和实验组大鼠的足爪、背部及尾根处均注射稳定性Ⅱ型胶原与完全弗氏佐剂共0.35 mL。首次诱导时间为7 d,接着对大鼠的足部进行皮下加强注射一次,每次的剂量为0.15 mL。对照组大鼠在相同部位注射同体积的0.9%氯化钠溶液。RA组和实验组建立模型[6]。
1.4 给药及组织提取
建模成功7 d后,实验组大鼠灌胃4 mg·kg-1·d-1塞来昔布,其余2 组灌胃同体积的生理盐水,连续灌胃30 d。灌胃结束检测关节炎指数后安乐死大鼠,分离膝关节组织,低温保存,用于后续实验。
1.5 观察各组大鼠关节炎指数(MAI)
采用MAI评分法,建模7 d后作为第1天,每4 d检测3 组大鼠MAI 评分程度(表1)。

表1 MAI 评分
1.6 H-E 染色观察病理
麻醉处死大鼠(1%戊巴比妥钠),提取膝关节组织自来水冲洗污血,放入液氮保存。10%甲醛溶液固定组织过夜,自来水冲洗,浸泡于14%的EDTA 溶液中脱钙,逐级脱水后石蜡包埋后4 μm 切片后备用。组织切片放入37℃复温15 min,二苯甲脱蜡后经乙醇进行逐级入水,苏木精染色10 min,1%盐酸处理,伊红复染,封片后观察组织形态。
1.7 TUNEL 检测
取3 组大鼠膝关节滑膜组织进行浸蜡包埋制做石蜡切片,厚度为2 μm,切5 张切片,按TUNEL试剂盒说明书将切片进行染色,每张切片选择不重复的5 个方位进行观察,滑膜细胞凋亡计算:凋亡细胞/总细胞×100%。
1.8 免疫印迹检测TNF-α 蛋白
膝关节组织经1%裂解液处理,采用BCA 检测蛋白,加入样品后,进行SDS-PAGE 电泳,转移至PVDF 膜,封闭1.5 h,后加入一抗TNFα(1∶1 000),内参为GAPDH(1∶2 000),过夜加入辣根过氧化酶标记的二抗(1∶2 000),摇匀,采用TBST 冲洗膜,最后ECL 化学发光显色,实验重复3 次取平均值。
1.9 免疫组织化学检测TNF-α 阳性表达
膝关节组织采用甲醛固定,石蜡包埋,切片水化后,37.5 ℃静置0.5 h,加入1% EDTA 液,山羊血清封闭。加入一抗TNF-α 抗体(1∶500),4 ℃孵育24 h 漂洗后加入二抗(1∶2 000)0.5 h后,复染,封片。选择不交叉的10 个视野,以淡黄色至棕褐色为阳性,计算阳性数。阳性细胞数记分标准:0 分:无染色或细胞染色程度<10%;1 分:10%~50%细胞呈现轻度或中度染色;2 分:10%~50%细胞强度染色;3 分:>50%细胞呈强度染色;0 分为阴性;1~3 分为阳性。
1.10 统计学处理
采用SPSS 22.0 软件对数据进行分析,各组MAI、病理改变、滑膜细胞凋亡及TNF-α 蛋白及阳性表达的差异性采用t检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 3 组大鼠关节炎症指数比较
建模后,对大鼠关节炎症指数进行评价,在13 d 时评分升高后降低,从急性炎症期转到慢性期;在23 d、30 d 时与RA 组相比,实验组关节炎症指数显著降低(P<0.05),且RA 组、实验组关节炎症指数显著高于对照组(P<0.05)(图1)。
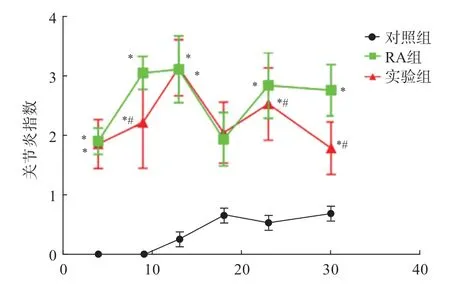
图1 3 组大鼠关节炎症指数比较
2.2 塞来昔布对大鼠病理改变的影响
对照组膝关节滑膜组织滑膜细胞呈单层生长,未出现增生,关节腔内无渗出,未见明显炎症。RA 组滑膜组织出现坏死,炎症严重,明显滑膜增生,软骨损伤。实验组经塞来昔布灌胃处理后,滑膜肿大减少,只见少量炎症细胞浸润(图2)。
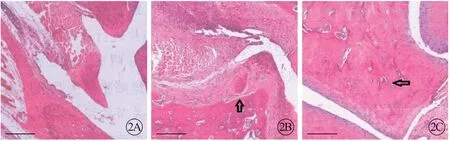
图2 塞来昔布对3组大鼠病理组织的影响,×200。A:对照组;B:RA组;C:实验组,箭头所指为病理表现.
2.3 塞来昔布对滑膜细胞凋亡的影响
对照组滑膜细胞凋亡率6.65%高于RA 组1.73%(P<0.05);实验组滑膜细胞凋亡率为14.65%,高于RA 组,说明对RA 大鼠灌胃塞来昔布会增加滑膜细胞凋亡,改善病情(图3)。
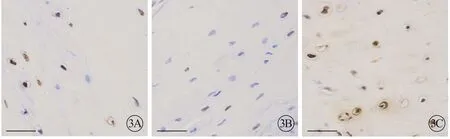
图3 大鼠滑膜细胞凋亡图,×200。A:对照组;B:RA组;C:实验组.
2.4 塞来昔布对大鼠滑膜组织中TNF-α蛋白表达的影响
对照组滑膜组织中TNF-α 蛋白表达量少于RA组(P<0.05),实验组滑膜组织中TNF-α 蛋白表达量少于RA 组,说明塞来昔布能够减低RA 大鼠滑膜组织中TNF-α 水平(图4)。
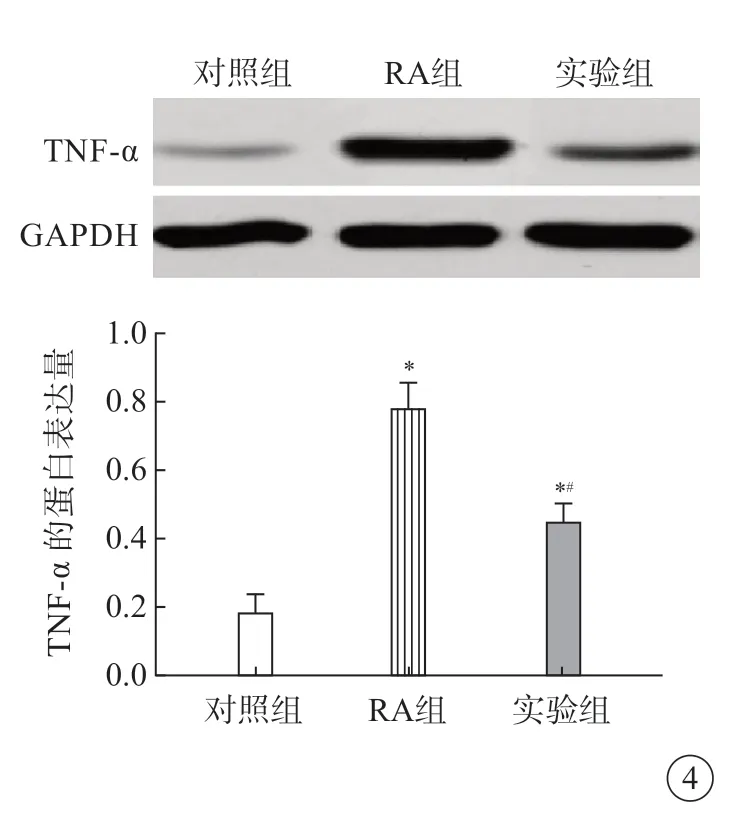
图4 大鼠滑膜组织中TNF-α的蛋白表达量。*P<0.05 vs 对照组;#P<0.05 vs RA组.
TNF-α 在滑膜组织中呈现棕黄色表达,RA组大鼠滑膜组织中TNF-α 阳性表达高于对照组(P<0.05),实验组大鼠滑膜组织中TNF-α 阳性表达低于RA 组(P<0.05),说明塞来昔布能够降低TNF-α 阳性表达(图5、6)。
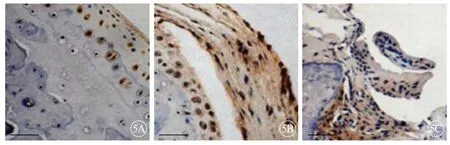
图5 大鼠滑膜组织中TNF-α 阳性表达,×200。A:对照组;B:RA 组;C:实验组.
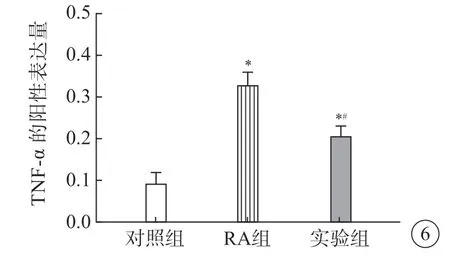
图6 3 组大鼠滑膜组织中TNF-α 阳性表达的比较。*P<0.05 vs 对照组;#P<0.05 vs RA 组.
3 讨论
RA 是以滑膜炎为主的系统性慢性疾病,中年女性为易发人群,我国发病率为0.35%左右。多数研究表示,RA 发病机制尚不明确,但与基因、环境等因素改变有关,患者出现破坏性关节炎症等[7]。大量研究显示,滑膜细胞在维持关节平衡方面具有关键作用。RA 患者机体滑膜细胞较为活跃,能够分泌多种炎症因子,损伤软骨,恶化病情[8]。TNF-α 是促炎症细胞因子,有研究表明,TNF-α 在RA 疾病发生及发展中发挥关键作用[9]。本研究通过建立RA 大鼠模型观察塞来昔布对RA 大鼠滑膜细胞及TNF-α 信号通路的影 响。
塞来昔布是医学界首次发现的COX-2 抑制剂,COX-2 主要在滑膜细胞细胞质及细胞膜中表达,在机体炎症升高时可促进前蛋白转化酶(proprotein convertases,PCs)水平升高[10]。塞来昔布对COX-2抑制程度是COX-1 的300 倍以上。大量动物RA 实验研究表明,经塞来昔布灌胃能够缓解大鼠足爪水肿炎症程度,将PCs 恢复至正常水平[11]。本研究结果表示,塞来昔布灌胃30 d 能够有效缓解实验组大鼠的关节炎症指数。COX-2 高表达能够快速转化为前列腺素2,可释放细胞炎症因子,发生炎症效应,加快血管水肿。塞来昔布能够抑制COX-2 活性,减少COX-2 转化成炎症因子,发挥消炎止痛的作用[12]。
RA 病理特征主要表现为滑膜细胞增多及炎症细胞浸润,诱导滑膜增厚,导致软骨组织损伤,关节病变[13]。滑膜细胞在RA 病变中表现为异常活化状态,是诱导关节损伤的主要效应细胞[14]。本研究通过对RA 大鼠灌胃塞来昔布,滑膜细胞出现大量凋亡,并减少了滑膜组织中滑膜细胞肿大。塞来昔布能够间接对前列腺素2 及血栓素活性进行抑制,减少滑膜细胞进行信号转导及炎症表达,进一步控制滑膜细胞炎症浸润,缓解RA 患者病情发生发展[15]。Kraus 等[16]研究表明,抑制COX-2 可促进滑膜细胞死亡及破裂,这与本研究结果相似。
在RA 滑膜中TNF-α 表达活跃,可通过NF-κB信号激活IL-1β 等炎症因子,活化的炎症因子也能刺激NF-κB 信号,相互作用,形成了RA 炎症反应机制。TNF-α 可以形成一种自身免疫炎症反应,加重关节损伤[18]。塞来昔布能够降低疼痛因子PCs 水平,RA 患者PCs 水平上升可激活TNF-α,而塞来昔布的作用机理是通过抑制TNF-α 水平表达,改善RA 患者肿胀疼痛[19]。而塞来昔布作为一种COX-2特异性抑制剂,能够抑制IL-1β 和TNF-α 水平,改善透明软骨特征性Ⅱ型胶原的生长合成,避免使其结构性蛋白变质对软骨细胞造成巨大的破坏[20]。塞来昔布抑制TNF-α 的机制目前仍不明确,笔者认为,主要机制可能在于塞来昔布选择性抑制COX-2的活性,而COX-2 及TNF-α 之间可相互作用,促进炎症的发生。塞来昔布抑制TNF-α 的促炎作用降低RA 的炎性反应。杨安忠等[21]研究表明,对RA患者给予塞来昔布治疗后可降低体内炎症水平,本研究与之研究结果相似。
综上所述,塞来昔布能改善RA 大鼠关节炎症指数,促进滑膜细胞坏死,降低TNF-α 表达,改善病情。

