术前神经导航联合术中神经电生理监测对脑干肿瘤患者神经功能的影响
朱子煜
黑龙江省佳木斯市中心医院神经外科 154002
脑干肿瘤是一种病灶起源于脑干组织的中枢神经系统肿瘤。脑干解剖结构和功能复杂,其中包含维持人体生命中枢的神经核和丰富的传导神经纤维,其特殊的生长位置,增加了外科切除手术治疗难度。临床实践表明[1-2],脑干肿瘤外科治疗常见严重并发症为周围重要神经核和神经传导束损伤。因此,评估术前肿瘤位置及其与周边结构关系,是保障外科手术治疗效果的关键。术前神经导航可有效评估肿瘤可切除性和手术入路的选择[3]。术中神经电生理监测实时监测重要神经核功能,反馈神经组织损伤程度,可有效保护神经,避免损伤。为研究术前神经导航和术中神经电生理监测联合干预脑干肿瘤的效果,分析对神经功能的影响,本文选择2018年3月—2021年3月我科收治的68例患者的临床资料展开研究。
1 资料与方法
1.1 临床资料 选择2018年3月—2021年3月我科收治的68例脑干肿瘤患者,采用随机双色球法分为两组,每组34例。对照组:男19例,女15例;平均年龄(36.46±1.27)岁;肿瘤体积68~90cm3,平均肿瘤体积(87.46±6.27)cm3;术前平均KPS评分(63.53±2.47)分;肿瘤部位:延髓23例,脑桥6例,中脑5例。研究组:男20例,女14例;平均年龄(36.51±1.30)岁;肿瘤体积66~91cm3,平均肿瘤体积(87.52±6.19)cm3;术前平均KPS评分(64.02±2.25)分;肿瘤部位:延髓21例,脑桥7例,中脑6例。两组一般资料对比差异不明显(P>0.05),具有可比性。
1.2 选择标准 纳入标准:经头部CT和MRI等证实为脑干肿瘤且累及皮质脊髓束;行脑干肿瘤切除术者;符合手术指征者;有头痛、偏瘫、麻痹、耳鸣等临床症状者;术前四肢Lovett肌力分级>3级;年龄在18岁以上;KPS评分60分以上;知情本项研究并签署意向书者。排除标准:合并肝、肾等器官恶性肿瘤者;合并其他原发性神经系统疾病者;合并免疫系统疾病者;入组前3个月接受免疫抑制剂治疗者;预计生存期不足3个月者;心、肺等重要脏器功能严重障碍者。
1.3 治疗方法 入院后,对两组患者进行常规手术前检查,排除手术禁忌证。研究组给予术前神经导航和术中神经电生理监测。术前患者行MRI检查,并将MRI和弥散张量成像(DTI)等影像资料数据导入神经导航计划工作站,通过分析颅脑三维图像,明确肿瘤位置和大小,制定手术入路计划。给予患者麻醉后,采用Mayfield头架固定头部,后安装Brainlab参考球架,双重注册后,整合导航信息于手术显微镜。采取正中入路、颞下入路、枕下乙状窦后入路、远外侧入路等入路方式。在应用神经导航技术过程中,肿瘤切除时和术中打开骨瓣时给予患者神经电生理监测,电流由低电流逐渐升至高电流,控制5~10mA范围内,具体以引发患者肢体动作为依据。肿瘤切除时给予大脑皮层下电刺激,并及时给予脑棉片保护和激素冲击。术中打开骨瓣时,停止麻醉药物的吸入,以降低因吸入麻醉药物产生的电生理监测干扰。电生理监测主要指标为体感诱发电位(SEP)、脑干听觉诱发电位(BAEP)、运动诱发电位(MEP)和肌电图(EMG)。对照组仅给予上述术中神经电生理监测。
1.4 观察指标
1.4.1 肿瘤切除程度[4]:完全切除、次全切除、大部分切除、部分切除,对应的肿瘤切除率分别为100%、85%~99%、70%~84%、<70%。肿瘤切除率=(术前肿瘤体积-术后肿瘤体积)/术前肿瘤体积×100%。
1.4.2 神经功能[5]:采用美国国立卫生研究院卒中量表(NIHSS)评估患者手术前后神经功能,该量表总分42分,分值与神经功能成反比。
1.4.3 日常生活能力:采用日常生活能力量表(ADL)评价患者手术前后日常生活能力,该量表由两部分组成:一是躯体生活自理量表,共6项;二是工具性日常生活能力量表,共8项,总分值14~56分,分值与日常生活能力成反比。
1.4.4 炎性因子:采集患者手术前后空腹上肢静脉血,离心处理后取血清,利用全自动生化分析仪(型号:BK-600,博科)以酶联免疫吸附法测定肿瘤坏死因子-α(TNF-α)、中枢神经系统特异性生物蛋白(S100B)和白介素-6(IL-6),试剂盒采购于赫澎(上海)生物科技有限公司。利用以酶联免疫吸附法测定。
1.4.5 术后并发症:肺部感染、脑积水、偏瘫、术后出血、脑干水肿。
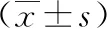
2 结果
2.1 肿瘤切除程度 相比于对照组,研究组肿瘤完全切除率显著升高,差异具有统计学意义(P<0.05)。见表1。
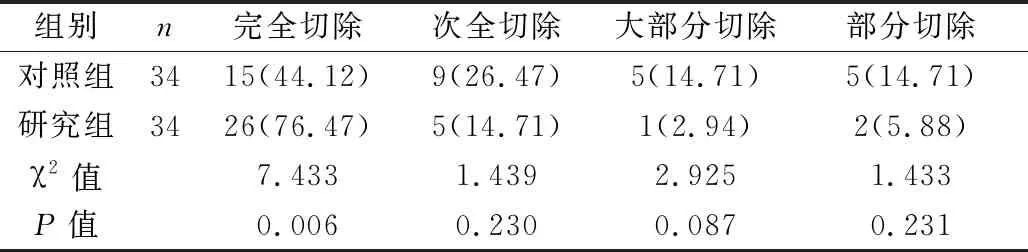
表1 两组肿瘤切除程度比较[n(%)]
2.2 神经功能和日常生活能力 和术前相比,两组术后NIHSS评分均下降,且研究组低于对照组;和术前相比,两组术后ADL评分均升高,且研究组高于对照组,两组对比差异具有统计学意义(P<0.05)。见表2。
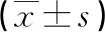
表2 两组神经功能和日常生活能力比较
2.3 炎性因子 和术前相比,两组术后的TNF-α、S100B和IL-6水平均下降,且研究组均低于对照组,组间对比差异有统计学意义(P<0.05)。见表3。
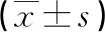
表3 两组炎性因子比较
2.4 并发症 相比于研究组(5.88%),对照组并发症总发生率(26.47%)明显升高,两组比较差异有统计学意义(χ2=5.314,P=0.021<0.05)。见表4。
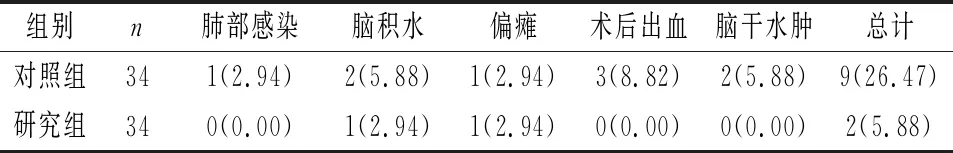
表4 两组并发症比较[n(%)]
3 讨论
从解剖结构和功能方面分析,脑干肿瘤所在的脑干结构复杂,神经核和传导神经纤维分布其中,增加了脑干肿瘤外科治疗风险。术中神经电生理监测可实时反映脑神经及其核团、锥体束等功能。神经导航技术用于神经系统疾病外科治疗术前评估,该技术对疾病诊断意义重大,且在术前评估肿瘤大小、肿瘤与周围神经关系及安全手术入路方案的制定中具有重要价值[6]。
临近脑干区域的术中手术操作,易造成肿瘤偏位,诱发电位,从而引起神经损伤。脑干肿瘤手术区域位于神经功能区,术中操作对神经功能区的损伤程度直接影响了患者神经功能和日常生活能力[7]。本文中,相比于对照组,研究组患者肿瘤完全切除率和ADL评分更高,术后NIHSS评分更低。即术前神经导航和术中神经电生理监测联合干预能有效提高病灶切除效果,提高手术精确度。术中神经电生理监测涉及脑电图、诱发电位、肌电图等多个环节。结合术前神经导航,可直观展示脑干肿瘤周围脑组织,动态观测和实时导航,能更好保护周围生命中枢组织。
机体病变后,S100B水平异常升高,具有杀伤细胞的反作用。肿瘤病理学相关研究显示[8],S100B水平异常与脑肿瘤病情发生、发展具有密切关系。TNF-α参与某些自身免疫病病理损伤过程。IL-6参与机体感染,TNF-α通过介导IL-6等炎性传递,完成对肿瘤细胞的抑制作用。本文中,术后研究组患者TNF-α、S100B和IL-6水平均下降,且均低于对照组,提示术前神经导航和术中神经电生理监测联合干预有利于降低脑干肿瘤患者炎性反应,整体治疗效果提升,因而患者术后并发症也相应减少。与以往研究结果具有一致性。
综上所述,脑干肿瘤患者给予术前神经导航和术中神经电生理监测联合干预后,肿瘤切除程度改善,神经功能和日常生活能力提高,炎性因子水平降低,安全性高。

