3种清风藤属植物低极性部位GC-MS分析及抗炎活性
崔仁杰 胡丹 邓璐璐 李江 穆淑珍


中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2022)04-0446-06
DOI 10.6039/j.issn.1001-0408.2022.04.11
摘 要 目的 探究鄂西清风藤、灰背清风藤和小花清风藤低极性部位成分特点及其抗炎活性。方法 运用气相色谱-质谱技术对鄂西清风藤、灰背清风藤和小花清风藤干燥茎叶石油醚萃取液中经石油醚洗脱所得的低极性部位进行成分分析,采用NIST 17和Wiley 275数据库对色谱峰进行检索,人工比对鉴定各化合物的结构,并采用峰面积归一化法计算各成分的相对百分含量。以吲哚美辛为阳性对照,以一氧化氮(NO)生成抑制率为指标,比较上述3种清风藤属植物低极性部位对脂多糖诱导人类风湿性关节炎成纤维样滑膜细胞RA-FLS、小鼠单核巨噬细胞RAW264.7生成NO的影响,并计算半数抑制浓度(IC50)。结果 从鄂西清风藤、灰背清风藤和小花清风藤低极性部位中分别确认了70、40、33种成分,均包含长链脂肪烃、长链醇/醛/酯、单萜等成分,但三者共有成分仅有正十二烷、正二十二烷等5种。鄂西清风藤中萜类成分丰富(40.89%),灰背清风藤中三萜成分的相对百分含量较高(30.29%),小花清风藤中长链脂肪烃成分的相对百分含量较高(87.70%)。上述3种清风藤属植物低极性部位对RA-FLS细胞NO生成的IC50分别为2.22、1.69、4.15 μg/mL,对RAW264.7细胞NO生成的IC50分别为1.23、4.02、3.05 μg/mL,均低于吲哚美辛(12.97、10.66 μg/mL)。结论 上述3种清风藤属植物低极性部位均含有长链脂肪烃、单萜、长链醇/醛/酯等成分,且三者均具有一定的抗炎活性。
关键词 清风藤属;鄂西清风藤;灰背清风藤;小花清风藤;低极性部位;气相色谱-质谱技术;成分分析;抗炎活性
GC-MS analysis and anti-inflammatory activity of low polarity parts from 3 species of Sabia genus
CUI Renjie1,2,HU Dan3,DENG Lulu2,3,LI Jiang2,3,MU Shuzhen2,3(1. College of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China; 2. Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550014, China; 3. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550014, China)
ABSTRACT OBJECTIVE To investigate the component characteristics and anti-inflammatory activities of the low polarity parts from Sabia campanulata, S. discolor and S. parviflora. METHODS Gas chromatography-mass spectrometry was used to analyze the components of low polarity parts eluted by petroleum ether from petroleum ether extract of dried stems and leaves of S. campanulata, S. discolor and S. parviflora. The chromatographic peaks were retrieved by both NIST 17 and Wiley 275 database, and their structures of each compound were compared and identified manually. The relative percentage content of each component was calculated by peak area normalization method. With indomethacin as positive control and the inhibition rate of nitric oxide (NO) production as the index, the effects of the low polarity parts of the above three species of Sabia genus on the production of NO in lipopolysaccharide-induced human rheumatoid arthritis fibroblast-like synoviocytes (RA-FLS) and mouse mononuclear macrophage RAW264.7 were compared; the half inhibitory concentration (IC50) was calculated. RESULTS Totally 70, 40 and 33 chemical components were identified respectively from the low polarity parts of S. campanulata, S. discolor and S. parviflora, including long-chain fatty hydrocarbons, long-chain alcohol/aldehyde/ester, monoterpenes; but there were only 5 common components in the three species, such as dodecane and docosane, etc. S. campanulata contained abundant terpenoids (40.89%); the relative percentage content of triterpenoids was high in S. discolor (30.29%); the relative percentage content of long-chain fatty hydrocarbons was high in S. parviflora (87.70%). The values of IC50 of the low polarity parts of the above three species of Sabia genus to the production of NO in RA-FLS cells were 2.22, 1.69 and 4.15 μg/mL, respectively. The values of IC50 of them to the production of NO in RAW264.7 cells were 1.23, 4.02 and 3.05 μg/mL respectively, and all of them were lower than indomethacin (12.97, 10.66 μg/mL). CONCLUSIONS The components of the low polarity parts from the above three species of Sabia genus are mainly long-chain fatty hydrocarbons, monoterpenes and long-chain alcohol/aldehyde/ester, and all of them have certain anti-inflammatory activities.
KEYWORDS Sabia genus; Sabia campanulata; Sabia discolor; Sabia parviflora; low polarity part; Gas chromato- graphy-mass spectrometry; component analysis; anti-inflam- matory activity
清风藤科(Sabiaceae)清风藤属(Sabia)植物,全世界约有63种,在我国主要分布于西南部,西北和东部地区亦有少量分布,包括鄂西清风藤Sabia campanulata Wall. ex Roxb. subsp. ritchieae(Rehd. et Wils.)Y. F. Wu、灰背清风藤S. discolor Dunn、小花清风藤S. parviflora Wall. ex Roxb.、清风藤S. japonica Maxim.等25种。清风藤属植物易与防己科中药青风藤混淆[1],而前者绝大多数植物也均有一定的药用价值[2],但有关化学成分和生物活性的研究有限。其中,小花清风藤是一种布依族药,具有清热利湿、利胆、止血等功效,主治黄疸湿热症、外伤出血[3],已报道的化学成分主要为阿朴菲类生物碱、五环三萜、黄酮醇和木脂素等[4]。研究表明,小花清风藤提取物可改善类风湿性关节炎模型大鼠足跖的溶骨、肿胀症状,减轻其滑膜组织炎症细胞浸润和血管翳增生[5],作用机制可能与下调基质金属蛋白酶9和肿瘤坏死因子α等炎症因子的表达有关[6]。而鄂西清风藤和灰背清风藤尚无系统的化学成分及药理作用研究,有进一步开发的潜力。
植物提取物中的低极性成分多集中在石油醚萃取部位,主要结构类型多为长链脂肪烃、单萜、倍半萜等,种类众多且结构差异小。低极性成分在清风藤属植物中大量存在,但尚未被研究与利用。笔者在研究鄂西清风藤、灰背清风藤、小花清风藤化学成分的过程中发现,三者低极性部位的化学成分组成各不相同。基于此,本研究采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术,分析比较了鄂西清风藤、灰背清风藤、小花清风藤石油醚低极性部位的成分特点,并评价了三者对脂多糖诱导的人类风湿性关节炎成纤维样滑膜细胞RA-FLS和小鼠单核巨噬细胞RAW264.7炎症模型中一氧化氮(nitric oxide,NO)生成的影响,以期为清风藤属植物资源的综合利用提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括HP6890/5975C型GC-MS仪(美国Agilent公司)、EPOCH型多功能酶标仪(美国Bio-Tek公司)、3111型二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司)、CX23型生物显微镜(日本Olympus公司)、HFsafe-1200LC型生物安全柜[力新仪器(上海)有限公司]、300 mm真空干燥器(重庆欣维尔玻璃有限公司)等。
1.2 主要药品与试剂
鄂西清风藤于2019年5月采自湖北省恩施市芭蕉乡,由云南中医药大学张君副教授鉴定为清风藤科清风藤属植物鄂西清风藤S. campanulata Wall. ex Roxb. subsp. ritchieae(Rehd. et Wils.)Y. F. Wu的干燥茎叶;灰背清风藤于2018年12月采自广西省荔浦市新坪镇猪头山,小花清风藤于2019年7月采自贵州省黔西南州安龙县,由贵州中医药大学孙庆文教授鉴定分别为清风藤科清风藤属植物灰背清风藤S. discolor Dunn的干燥茎叶和小花清风藤S. parviflora Wall. ex Roxb.的干燥茎叶。以上药材标本均存放于贵州省中国科学院天然产物化学重点实验室。
吲哚美辛对照品(批号1000258-201905,纯度≥99.9%)购自中国食品药品检定研究院;脂多糖购自上海碧云天生物技术有限公司;NO检测试剂盒(批号20210114)购自南京建成生物工程研究所;胎牛血清(批号BC20201204)和DMEM培养基(批号10113624)均购自美国Gibco公司;细胞培养皿、96孔细胞培养板、细胞培养瓶均购自美国Corning公司;GF254硅胶板(规格50 mm×100 mm,批号20200713)和柱层析硅胶(200~300目,批号2055)均购自青岛海洋化工有限公司;正己烷(分析纯)和二甲基亚砜(分析纯)均购自国药集团化学试剂有限公司;乙醇(分析纯)和石油醚(沸程60~90 ℃,分析纯)均购自天津富宇精细化工有限公司;其余试剂均为分析纯或实验室常用规格,水为纯化水。
1.3 细胞
人类风湿性关节炎成纤维样滑膜细胞RA-FLS、小鼠单核巨噬细胞RAW264.7均购自上海博垒生物科技有限公司。
2 方法
2.1 供试品溶液的制备
取鄂西清风藤、灰背清风藤、小花清风藤样品,粉碎后,分別用10倍量(L/kg)的80%乙醇回流提取3次,每次3 h,合并提取液,减压浓缩至无醇味后加水混悬,用等体积石油醚萃取3次,合并石油醚萃取液并浓缩至浸膏状。采用常压硅胶柱色谱对石油醚萃取部位进行分离,以石油醚-二氯甲烷(100 ∶ 0、99 ∶ 1、95 ∶ 5、90 ∶ 10、80 ∶ 20、50 ∶ 50、0 ∶ 100,V/V)进行梯度洗脱,合并其中首段由石油醚洗脱的部分并浓缩,于真空干燥器中干燥,得低极性部位样品。称取上述低极性部位样品10 mg,以正己烷溶解并用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.2 GC-MS分析
2.2.1 鄂西清风藤的检测条件 (1)GC条件:色谱柱为HP-5MS弹性石英毛细管柱(60 m×0.25 mm,0.25 μm);初始温度为40 ℃并保持2 min,以3.5 ℃/min升温至180 ℃,再以10 ℃/min升温至310 ℃并保持15 min;运行时间为70 min;汽化室温度为250 ℃;载气为高纯氦气(99.999%),流速为1.0 mL/min;柱前压为15.96 psi;溶剂延迟时间为6 min;分流比为50 ∶ 1;进样量为0.2 μL。(2)MS条件:离子源为电子轰击源,离子源温度为230 ℃;四极杆温度为150 ℃;电离能量为70 eV;发射电流为34.6 μA;倍增器电压为1 847 V;接口温度为280 ℃;质量扫描范围为29~500 amu。
2.2.2 灰背清风藤和小花清风藤的检测条件 (1)GC条件:色谱柱为HP-5MS弹性石英毛细管柱(60 m×0.25 mm,0.25 μm);初始温度为40 ℃并保持2 min,以3.5 ℃/min升温至180 ℃,再以8 ℃/min升温至308 ℃并保持20 min;运行时间为78 min;汽化室温度为250 ℃;载气为高纯氦气(99.999%),流速为1.0 mL/min;柱前压为16.03 psi;溶剂延迟时间为6 min;分流比为9.97 ∶ 1;进样量为0.2 μL。(2)MS条件:离子源为电子轰击源,离子源温度为230 ℃;四极杆温度为150 ℃;电离能量为70 eV;发射电流为34.6 μA;倍增器电压为1 941 V;接口温度为280 ℃;质量扫描范围为29~500 amu。
2.2.3 数据分析 分别精密吸取“2.1”项下鄂西清风藤、灰背清风藤、小花清风藤低极性部位供试品溶液,按“2.2.1”“2.2.2”项下检测条件进样分析,得总离子流图。根据所得总离子流图,用NIST 17和Wiley 275数据库对色谱峰进行检索,人工比对鉴定各化合物的结构,并采用峰面积归一化法计算各成分的相对百分含量。
2.3 抗炎活性测定
参考文献[7]的方法,利用脂多糖诱导RA-FLS细胞和RAW264.7细胞建立炎症模型,以NO生成抑制率评价鄂西清风藤、灰背清风藤、小花清风藤低极性部位的抗炎活性。将细胞接种于含10%胎牛血清的DMEM培养基中,置于37 ℃、5%二氧化碳细胞培养箱中培养。分别取处于对数生长期的上述两种细胞,按2×104个/孔接种于96孔板中,于细胞培养箱中培养12 h,弃去上清液,将细胞分为模型组、鄂西清风藤组、灰背清风藤组、小花清风藤组和吲哚美辛组(阳性对照)。模型组加入二甲基亚砜,药物组加入含相应药物的二甲基亚砜溶液,每孔100 μL,上述药物的质量浓度均分别为0.1、0.3、1、3、10、30 μg/mL(按低极性部位质量计),每组设置3个复孔。继续培养2 h后,按10 μL/孔加入100 μg/mL的脂多糖(溶剂为含10%胎牛血清的DMEM培养基);继续培养8 h后,弃去上清液,按NO检测试剂盒说明书进行操作,使用多功能酶标仪于540 nm波长下检测各孔的光密度(optical density,OD)值,按下式计算NO生成抑制率:NO生成抑制率(%)=(模型组OD值-药物组OD值)/模型组OD值×100%。数据以x±s表示,并通过Grphpad Prism 5.0软件计算各药物组的半数抑制浓度(median inhibitory concentration,IC50)。
3 結果
3.1 3种清风藤属植物低极性部位成分GC-MS分析结果
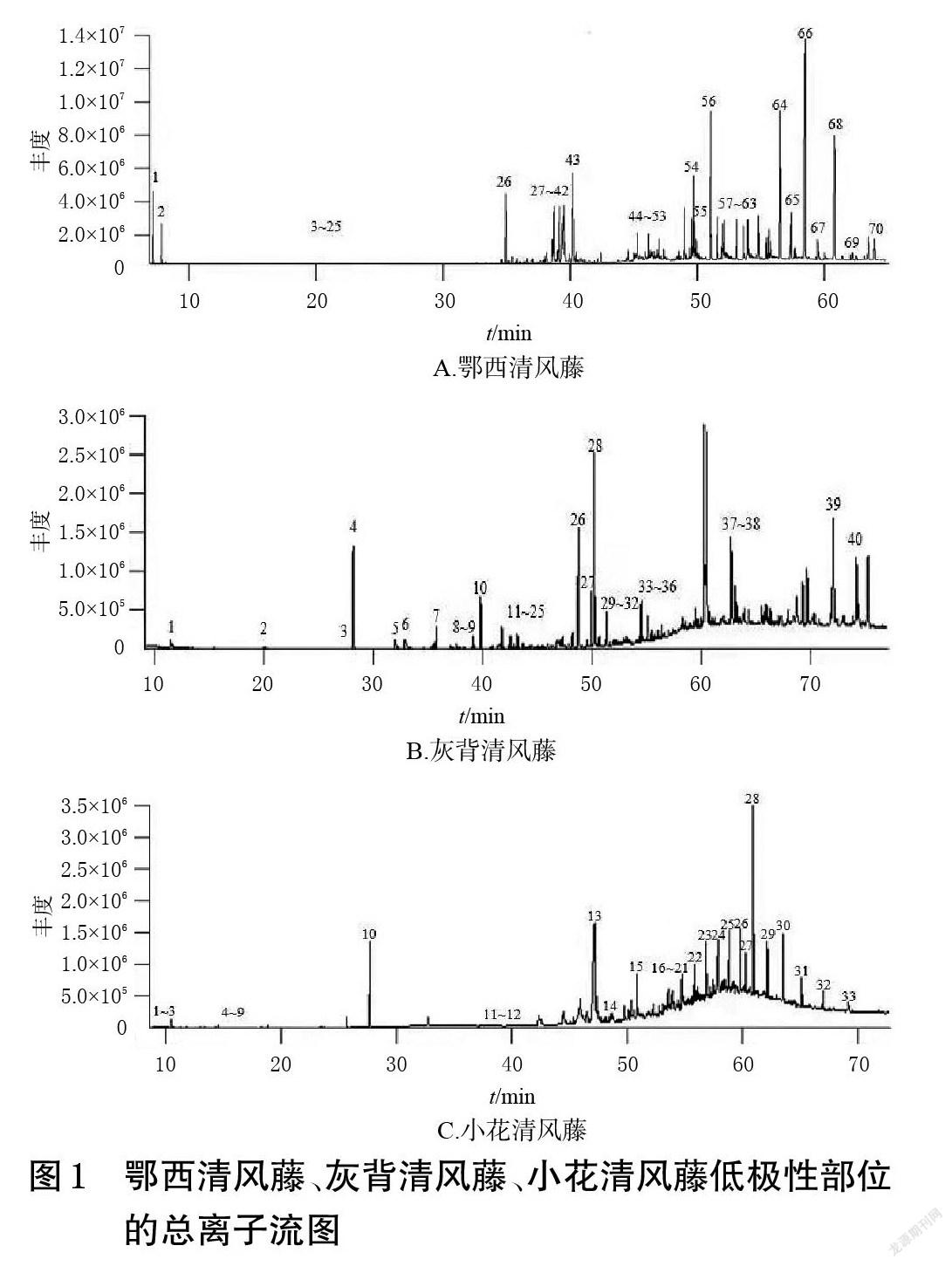
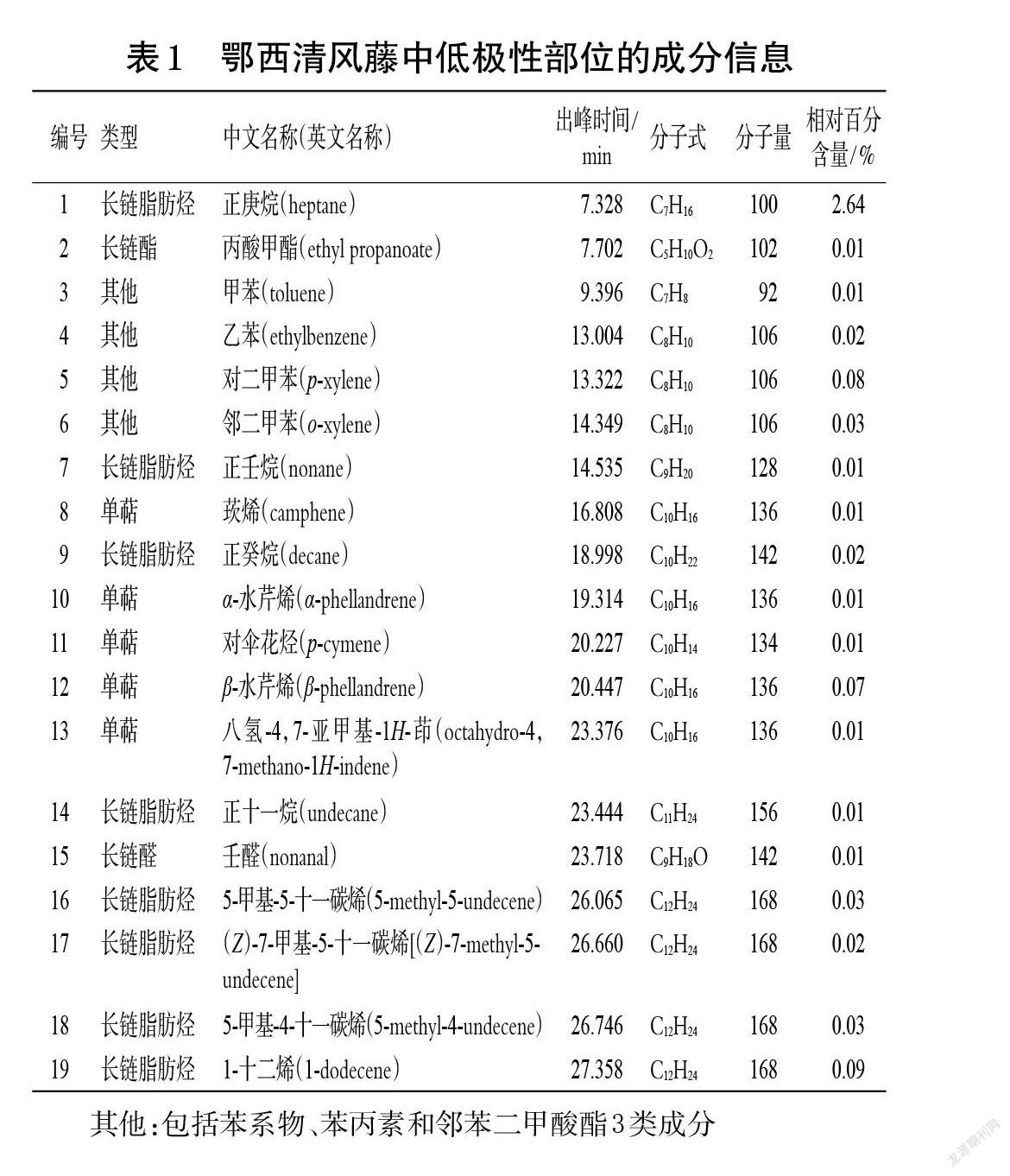
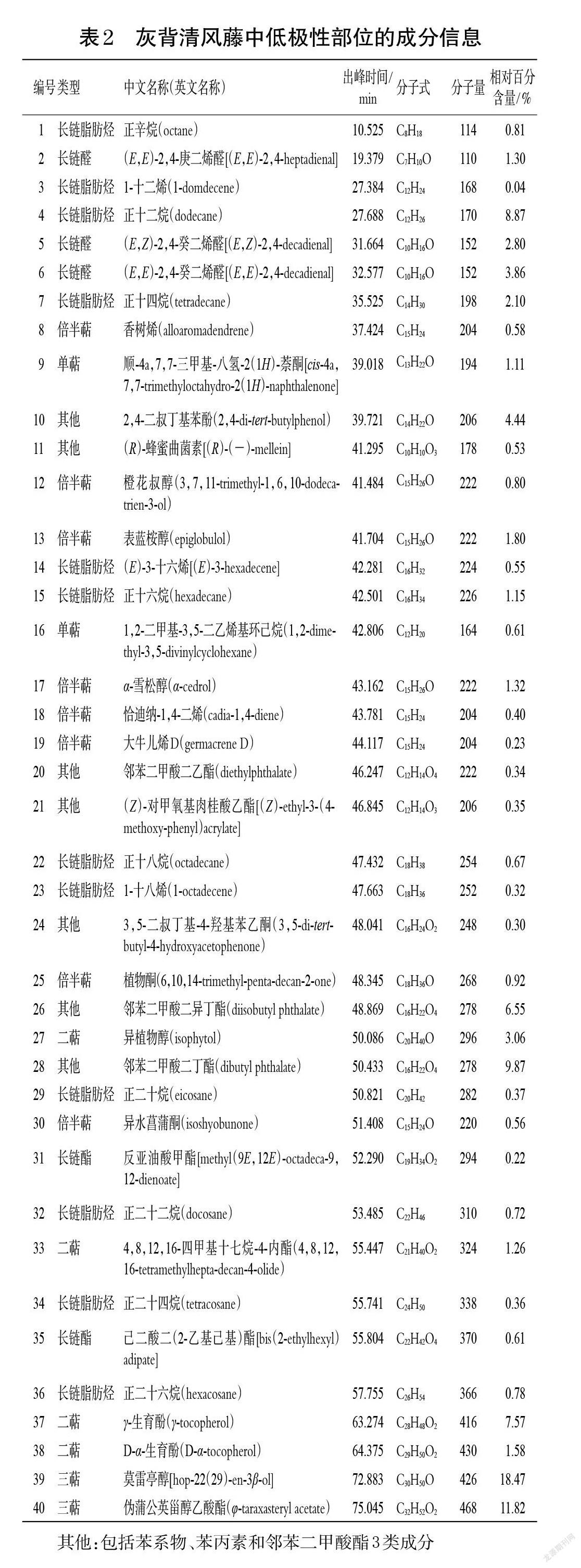
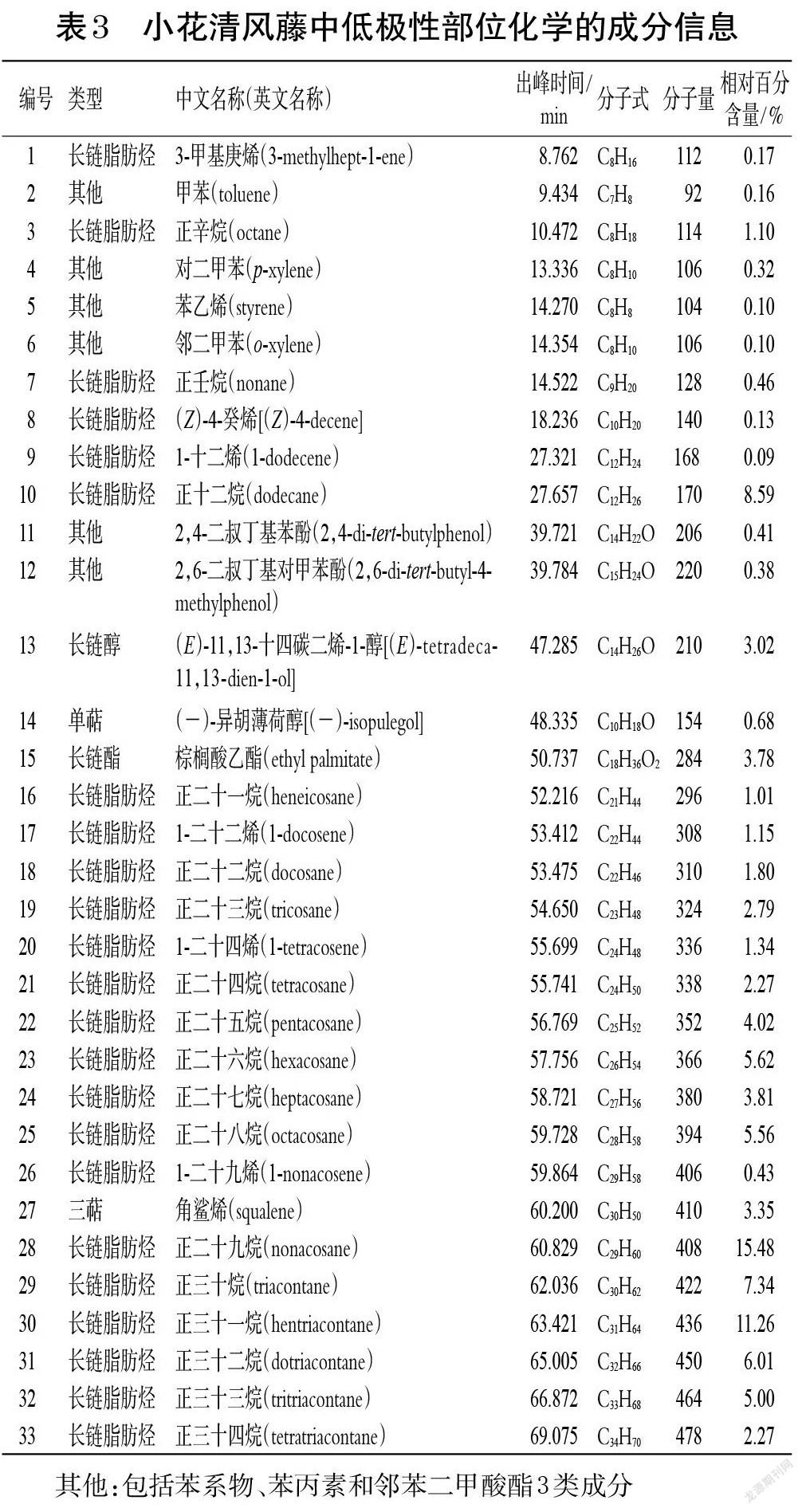
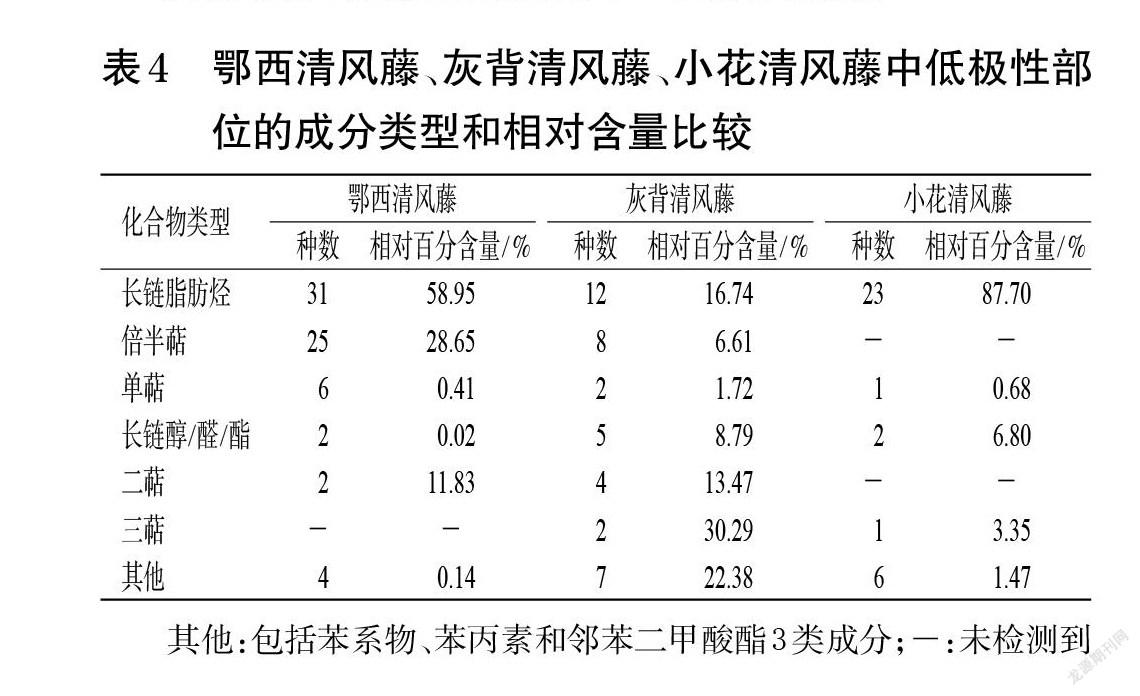
鄂西清风藤、灰背清风藤、小花清风藤低极性部位的总离子流图见图1。经NIST 17和Wiley 275数据库检索,并分析比对其中相似度≥80%的结构,分别确定了鄂西清风藤低极性部位中的70种成分、灰背清风藤中的40种成分和小花清风藤中的33种成分,结果见表1~表3。按出峰顺序编号并按化合物类型统计各类成分的相对百分含量,结果见表4。
其他:包括苯系物、苯丙素和邻苯二甲酸酯3类成分
其他:包括苯系物、苯丙素和邻苯二甲酸酯3类成分
其他:包括苯系物、苯丙素和邻苯二甲酸酯3类成分;-:未检测到
GC-MS分析结果显示,鄂西清风藤、灰背清风藤、小花清风藤低极性部位均含有长链脂肪烃、长链醇/醛/酯、单萜等成分。小花清风藤与鄂西清风藤共有成分相对较多,有19种;鄂西清风藤和灰背清风藤的共有成分有9种;小花清风藤和灰背清风藤的共有成分有7种;这些共有成分中除了香树烯外,其余均为长链脂肪烃或苯系物。而三者均共有的成分较少,仅有5种,分别为1-十二烯、正十二烷、正二十二烷、正二十四烷和正二十六烷。在含量分布上,鄂西清风藤低极性部位中有58.95%的成分属于长链脂肪烃,小花清风藤低极性部位中有87.70%的成分属于长链脂肪烃,而灰背清风藤低极性部位中的长链脂肪烃成分仅占16.74%,且均为偶碳数脂肪烃。此外,鄂西清风藤低极性部位还含有33种萜类成分,相对百分含量为40.89%;灰背清风藤低极性部位的成分最为多样,主要包括长链脂肪烃、二萜、三萜及其他(如苯丙素、邻苯二甲酸酯等)成分,其中三萜成分的相对百分含量较高(30.29%)。
3.2 3种清风藤属植物低极性部位的抗炎活性
鄂西清风藤、灰背清风藤、小花清风藤低极性部位对RA-FLS细胞和RAW264.7细胞的NO生成抑制率均高于相同质量浓度的吲哚美辛。对于RA-FLS细胞,鄂西清风藤、灰背清风藤、小花清风藤低极性部位对NO生成的IC50分别为2.22、1.69、4.15 μg/mL,均远低于吲哚美辛的12.97 μg/mL,其中灰背清风藤低极性部位的抑制作用最强。对于RAW264.7细胞,鄂西清风藤、灰背清风藤、小花清风藤低极性部位对NO生成的IC50分别为1.23、4.02、3.05 μg/mL,仍均低于阳性对照吲哚美辛的10.66 μg/mL,其中鄂西清风藤低极性部位的抑制作用最强。结果见表5。
4 讨论
本研究运用GC-MS技术分析比较了鄂西清风藤、灰背清风藤和小花清风藤3种清风藤属植物低极性部位成分并评价了其抗炎活性。结果显示,分别从上述3种清风藤属植物低极性部位中分析确定了70、40、33种成分,均包含长链脂肪烃、长链醇/醛/酯、单萜等成分,但这3种清风藤属植物低极性部位中的共有成分较少;此外,鄂西清风藤中有多种长链脂肪烃和倍半萜成分,灰背清风藤中三萜成分的含量较高,小花清风藤中长链脂肪烃成分的含量较高。
本研究从小花清风藤低极性部位中发现了角鲨烯,其是三萜成分的前体[8],这也间接提示了该属植物中五环三萜成分的潜在生源途径。从鄂西清风藤低极性部位中检出了微量甲苯和乙苯等苯系物,其可能来源于石油醚和正己烷溶剂中所含的杂质而非来源于植物[9],但尚需进一步确认。从灰背清风藤低极性部位中检出了D-α-生育酚和γ-生育酚,其是维生素E的两种类型,相对百分含量为9.15%,提示灰背清风藤可能有一定的营养价值,在食品保健品方面具有开发潜力。
吲哚美辛是一种临床常用的抗炎药物[10],本研究以其作为阳性对照,比较鄂西清风藤、灰背清风藤和小花清风藤3种清风藤属植物低极性部位的体外抗炎活性。结果显示,上述3种清风藤属植物低极性部位均能较好地抑制脂多糖诱导的RA-FLS细胞和RAW264.7细胞生成炎症介质NO,且IC50均低于吲哚美辛。对于RA-FLS细胞,抗炎活性强弱排序为灰背清风藤>鄂西清风藤>小花清风藤;对于RAW264.7细胞,抗炎活性强弱排序为鄂西清风藤>小花清风藤>灰背清风藤。
有研究显示,鄂西清风藤中的单萜、倍半萜、二萜成分具有抗炎作用[11-15]。小花清风藤中的脂肪酸成分棕榈酸乙酯能减少脂多糖介导的内毒素血症模型大鼠血浆中炎症因子肿瘤坏死因子α和白细胞介素6的释放[16]。灰背清风藤中的D-α-生育酚和γ-生育酚可能是其主要的抗炎成分[17];此外,灰背清风藤中的五环三萜成分莫雷亭醇也被证实具有较好的抗炎活性[18]。由此可见,鄂西清风藤、灰背清风藤、小花清风藤低极性部位的抗炎活性均可能是由多种成分协同而成。
综上所述,本研究初步分析了鄂西清风藤、灰背清风藤、小花清风藤低极性部位成分,主要为长链脂肪烃、长链醇/醛/酯、单萜、倍半萜等成分;且3种植物的低极性部位均具有抗炎活性,为清风藤属植物的深入研究提供了科学依据。
参考文献
[ 1 ] 杨华,熊兴耀,仇萍.中药青风藤种质资源研究进展[J].生物技术世界,2015,12(9):255-256.
[ 2 ] 李朝斗.贵州产清风藤科入药植物[J].中药通报,1987,12(8):5-6.
[ 3 ] 贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].贵阳:贵州科技出版社,2003:57.
[ 4 ] 李曼姝,柯银铅,张紫琴,等.小花清风藤茎叶化学成分及其保肝活性研究[J].中草药,2021,52(23):7096-7104.
[ 5 ] 许欢,潘书涵,王永萍,等.小花清风藤醇提液对RA大鼠相关蛋白的影响[J].中药药理与临床,2018,34(6):87-92.
[ 6 ] 王茂林,王永萍,杨奕樱,等.小花清风藤对类风湿关节炎大鼠TNF-α和MMP-9表达的影响[J].湖南中医杂志,2018,34(3):154-157.
[ 7 ] 杨晓露,刘朵,卞卡,等.甘草总黄酮及其成分体外抗炎活性及机制研究[J].中国中药杂志,2013,38(1):99-104.
[ 8 ] 謝琴鼎,陈瑶,唐亚琴,等.植物三萜代谢途径中角鲨烯合成酶研究进展[J].分子植物育种,2018,16(9):2997- 3005.
[ 9 ] 向亚林,余细红,赵晓峰,等.白千层精油的化学成分与抑菌活性研究[J].热带作物学报,2019,40(2):388-395.
[10] 余玲,康倩,刘葭,等.雷公藤红素与吲哚美辛对脂多糖诱导的RAW264.7细胞的协同抗炎作用研究[J].中南药学,2020,18(11):1807-1813.
[11] 张树臣,叶金梅.对-伞花烃祛痰作用的研究[J].中国药学杂志,1979,14(4):152-154.
[12] 姜玮,刘静波,卢静,等.杜香挥发油研究概述[J].食品科学,2010,31(13):337-341.
[13] TAMBE Y,TSUJIUCHI H,HONDA G,et al. Gastric cytoprotection of the non-steroidal anti-inflammatory sesquiterpene,beta-caryophyllene[J]. Planta Med,1996,62(5):469-470.
[14] CHO J Y,CHANG H J,LEE S K,et al. Amelioration of dextran sulfate sodium-induced colitis in mice by oral administration of beta-caryophyllene,a sesquiterpene[J]. Life Sci,2007,80(10):932-939.
[15] TUNGCHAROEN P,WATTANAPIROMSAKUL C,TANSAKUL P,et al. Anti-inflammatory effect of isopimarane diterpenoids from Kaempferia galanga[J]. Phytother Res,2020,34(3):612-623.
[16] SAEED N M,EL-DEMERDASH E,ABDEL-RAHMAN H M,et al. Anti-inflammatory activity of methyl palmitate and ethyl palmitate in different experimental rat mo- dels[J]. Toxicol Appl Pharmacol,2012,264(1):84-93.
[17] 程兆明,王苏芹,庄禄昌,等.维生素E对骨性关节炎氧自由基水平的影响及意义[J].中国实用医刊,2018,45(1):17-19.
[18] PÉREZ-GONZÁLEZ M Z,GUTIÉRREZ-REBOLLEDO G A,YÉPEZ-MULIA L,et al. Antiprotozoal,antimycobacterial,and anti-inflammatory evaluation of Cnidoscolus chayamansa(Mc Vaugh)extract and the isolated compounds[J]. Biomed Pharmacother,2017,89:89-97.
(收稿日期:2021-10-09 修回日期:2021-12-26)
(编辑:邹丽娟)

