结肠内镜黏膜下剥离术后致缺血性结肠炎一例
张 露,张晓琦,叶小峰
1. 南京中医药大学附属常州市中医医院脾胃病科(江苏常州 213001)
2. 南京大学医学院附属鼓楼医院消化内科(南京 210008)
结肠内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)的常见并发症包括出血、穿孔、狭窄、电凝综合征等,而并发缺血性结肠炎(ischemic colitis,IC)的情况则较为少见,如若误诊误治将对患者的预后产生严重影响[1]。本文报道了1例结肠ESD术后并发IC的病例,详情如下。
1 临床资料
患者,女,75岁,因大便稀溏半月于2021年3月8日入住南京中医药大学附属常州市中医医院脾胃病科,日排便1~2次,便前腹痛,以脐周明显,便后缓解,同时伴胃脘部嘈杂不舒。入院前曾查肠镜,提示横结肠有大小约3.0 cm×2.5 cm的平坦型病变(图1-A),活检病理示横结肠增生性息肉。患者既往体健,无高血压、冠心病、糖尿病、心房颤动等慢性病史和长期服药史,心肺功能正常。入院当天查体:剑突下及脐周轻压痛,无反跳痛,肠鸣音正常;血常规:白细胞计数6.75×109/L,中性粒细胞百分比61.6%;D-二聚体0.18 mg/L。入院当晚给予聚乙二醇进行肠道准备,第二天行超声肠镜探查,判断病灶尚未侵及黏膜下层,有ESD指征。入院第2天行ESD(图1-B、图1-C),内镜下可见横结肠脾曲有一侧向发育肿瘤,表面平坦、充血,大小约3.0 cm×2.5 cm。用Dual刀沿病灶周围标记后,在病灶黏膜下注射靛胭脂和生理盐水,病灶大部分抬举良好,中心抬举欠佳,用Dual刀沿标记处外侧0.5 cm预切开后从肛侧至口侧完整剥除病灶黏膜,在剥离过程中判断病灶中心抬举欠佳可能为炎性粘连,待术后病理明确,创面用热活检钳止血,予钛夹局部夹闭创面,历时60 min。术后予禁食、补液、补钾,以及静滴氨甲环酸注射液1 g(规格:5 mL,0.25 g)等治疗措施。
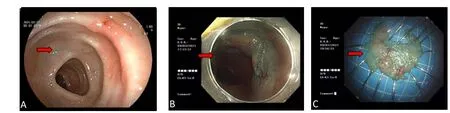
图1 病灶图片Figure 1.Pictures of the lesion
术后约1 h患者出现左中下腹绞痛,呈阵发性,伴里急后重,解黏液血便,每次约20 g,12 h内共解5次。触诊:左中下腹轻压痛,无反跳痛及肌紧张。听诊:肠鸣音由亢进到减弱,音调不高亢。第三次解血便时伴头晕、恶心、呕吐,呕吐物为白色黏液。急查血常规:白细胞计数8.49×109/L、中性粒细胞百分比89.2%、淋巴细胞百分比7.7%。立即予屈他维林联合针刺曲池、尺泽、少海等穴止痛,头孢地嗪钠抗感染,异丙嗪止吐等对症处理,治疗后患者恶心呕吐、左中下腹绞痛明显缓解。期间,心电监护、指脉氧监测提示生命体征平稳,心率64~73 次/min,呼吸18~20 次 /min,血压(121~145)/(68~77)mmHg(1 mmHg=0.133 kPa),无血流动力学改变。
术后13 h行急诊肠镜检查,镜下见:进镜至横结肠脾曲,创面未见明显活动性出血(图2-A)。从降结肠至直乙交界见纵行溃疡,局部黏膜呈地图样改变,病灶间黏膜正常(图2-B)。考虑到患者疼痛难忍、肠道黏膜较脆弱,为避免诱发更多并发症,未行活检。复查血常规:白细胞计数16.79×109/L、中性粒细胞百分比93.4%、淋巴细胞百分比4.5%,复查D-二聚体2.11 mg/L。全腹CT示:结肠脾曲术后改变,周围脂肪间隙模糊,不排除感染可能(图2-C)。肠系膜上下动静脉未见明显异常。结合患者临床表现、肠镜检查、实验室指标,考虑诊断为IC。治疗上,停用氨甲环酸,增加补液,加强抗感染,另加人血白蛋白补充蛋白,促进修复,继续禁食。术后第二天患者解少量黑便,无活动性出血,第三天已解黄色软便,一周后基本恢复,予以出院。
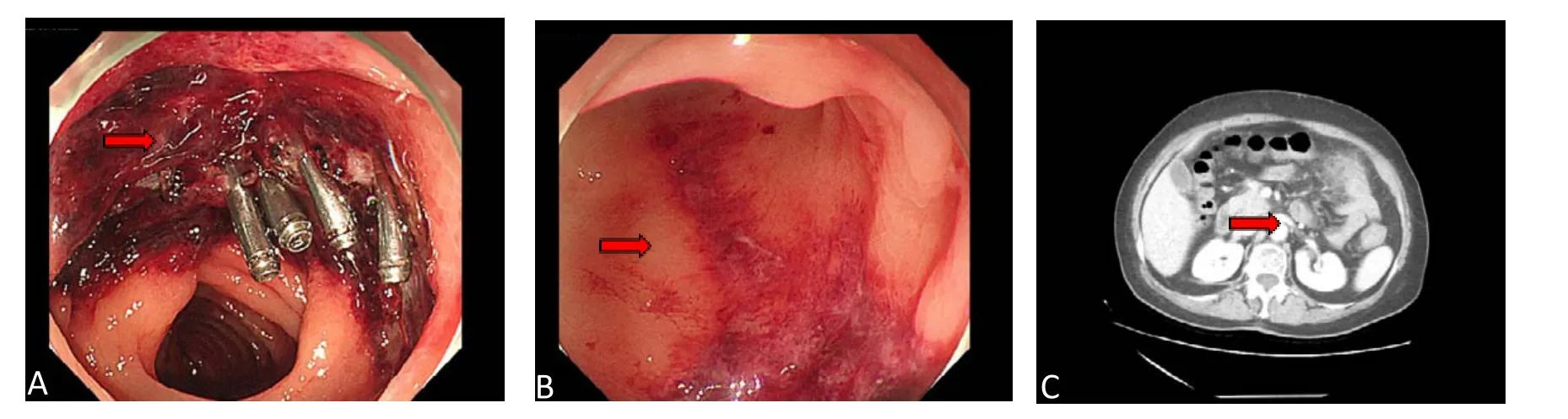
图2 急诊肠镜和CT检查Figure 2. Emergency colonoscopy and CT examination
横结肠ESD术后病理:浅表黏膜腺体示低级别上皮内瘤变,少量区域高级别上皮内瘤变,镜下病变范围共约1.9 cm×0.9 cm,累及6/9条黏膜。肉眼类型:0-IIa。标本侧切缘、基底切缘未见肿瘤累及。周围肠黏膜示慢性炎症。本研究报告病例经患者知情同意。
2 讨论
IC的概念最早由Boley于1963年提出,指血供无法满足结肠代谢需求时发生的结肠黏膜炎症、溃疡甚至出血的临床综合征[2-3]。IC发病率为4.5~44/10万人,女性易发[4]。高龄、动脉粥样硬化、慢性肾脏病、心房颤动、吸烟、肠镜检查以及部分药物(如降压药、利尿剂、非甾体抗炎药、避孕药等)均会增加IC发生风险[5-8]。目前认为IC的病理基础是肠道血流低灌注和血流恢复时的再灌注损伤,与结肠血管的解剖密切相关,好发于血供较差的“分水岭”区域——左半结肠[3,9]。Nikolic等研究显示,IC在直乙交界的发生率为4.8%~25%,在结肠脾曲的发生率为3%~5%[10]。
IC的临床表现因严重程度和病变范围而异,轻症常表现为突发的痉挛性腹痛、腹泻、排便冲动及便血[5]。便血量较小,常与粪便混合,一般无血流动力学的改变[7]。查体无特异性,通常为受累结肠部位的轻微压痛[5]。重症可并发肠坏死、肠梗阻、肠穿孔、腹膜炎、代谢性酸中毒,甚至感染性休克,查体出现明显的压痛和腹膜炎体征[5,8]。
近年来,结肠镜检查逐步取代钡剂灌肠,成为诊断IC的常用方法和金标准。美国胃肠病学院(American College of Gastroenterology,ACG)临床指南建议,对疑似IC患者应在发病48 h内尽早行结肠镜检查以确诊并评估病情的严重程度[11]。内镜下轻症患者常表现为黏膜充血水肿、糜烂、溃疡、条形红斑,病变呈节段性;重症患者结肠袋消失、黏膜发绀甚至坏疽[9,12]。IC在腹部平片上的表现无特异性,当继发肠穿孔时可见膈下游离气体影。腹部CT图像可见肠壁增厚、指印征、腹膜粘连,伴或不伴腹腔积液[5],若缺血性肠壁已再灌注,因黏膜下层水肿表现为低密度征,也可因出血表现为高密度征,若局部缺血是透壁性的,则可形成狭窄,偶尔会出现中毒性巨结肠[13]。实验室检查在早期诊断上缺乏灵敏度和特异度,外周血白细胞计数可增高至(10~30)×109/L,有时伴血沉增快20~100 mm/h[8,14]。Block等研究提示D-二聚体>0.09 μg/mL(1 μg/mL=1 mg/L)时,其诊断IC的灵敏度、特异度分别为60%、82%,且D-二聚体的数值越高,诊断IC的价值越大[15]。豆正莉等研究发现,D-二聚体联合腹部CT诊断IC的灵敏度、特异度分别为97.37%、82.50%,优于单一的腹部CT或D-二聚体诊断[16]。
缺血性肠病包括急性肠系膜缺血(acute mesenteric ischemia,AMI)、慢性肠系膜缺血(chronic mesenteric ischemia,CMI)和 IC,临床容易混淆。IC因早期症状的不明显和非特异性,初诊准确率较低,需与AMI和CMI进行鉴别[17]。此外,IC还需与溃疡性结肠炎、克罗恩病、假膜性小肠结肠炎、感染性结肠炎和结直肠腺癌等疾病相区别,它们的首发症状均可以表现为腹痛、便血。
IC的治疗应考虑急性程度和严重程度,其严重程度取决于肠壁缺血时间的长短、侧支循环、肠腔内寄居的细菌、全身循环状态等因素。在无坏死或穿孔情况下,以对症支持治疗为主,包括肠道休息、补液以及经验性使用广谱抗生素,减少肠道细菌的转移以及败血症的发生[8]。若出现弥漫性腹膜炎、腹腔积液、腹腔游离气体、感染性休克,以维持生命支持治疗为主,及时采取剖腹探查、急诊手术等手段[18]。其预后转归与年龄、伴随疾病、并发症以及是否及时诊疗密切相关,大部分轻症患者缺血情况一旦改善,症状迅速消失,病变恢复快[19]。合并高血压、糖尿病、心房颤动、慢性阻塞性肺病的老年患者,则预后不良[20]。
本例患者ESD术后并发IC,考虑与以下因素有关:①高龄,患者已75岁,既往研究发现90%的IC患者年龄在60岁及以上[5]。②围手术期管理,该患者术前禁食、使用聚乙二醇高渗溶液进行肠道准备及围手术期的补液不足均可能加重肠壁缺血[21-22]。③操作手法,手术部位为横结肠脾曲,操作过程中反复多次进退镜身,横结肠脾曲以下肠管受到反复牵拉以及镜身的长时间压迫,肠管微血管容易损伤并发生缺血,同时为暴露清晰的视野,操作时易过度充气,使得肠腔内呈现持续高压的状态。研究显示,当结肠内压上升至30~40 mmHg时,肠壁易发生可逆性循环损伤,而超过50 mmHg时则可能发生不可逆性循环损伤[23]。④手术时间,手术时间长达1 h,增加了发生肠道痉挛的可能,易引起肠壁缺血缺氧、肠黏膜损伤,而恢复血流后肠黏膜可能遭受再灌注损伤[24]。⑤术后用药,该患者术后给予氨甲环酸预防迟发性出血,而氨甲环酸药品说明中明确提示高龄患者因生理机能的减退,应减少用药量。
IC作为结肠镜诊疗过程中的少见并发症,往往容易因误诊失治而危及患者生命。因此,在结肠镜的诊治过程中应做到以下几点:①做好围手术期的管理,如肠道准备前后要充分补液,或调整肠道准备药物。②规范操作手法,在手术过程中避免过度牵拉,适时抽气,防止肠腔过度扩张。③保证手术质量的同时尽量减少操作时间。④综合考虑术后止血药的使用,内镜下息肉切除术后发生迟发性出血的概率较低,美国消化内镜协会不建议将预防术后迟发性出血纳入常规处理[25]。高龄患者,尤其是合并心脑血管疾病、糖尿病、结缔组织疾病的女性患者,术后止血药的使用与否需综合考虑,警惕IC的发生。本例患者术后氨甲环酸用药剂量尚无可靠参考数据,故不建议作为术后预防迟发性出血的常规用药。⑤及时发现患者肠道黏膜已有的损伤,本例患者行ESD术后1 h左右出现IC症状,需确认是否在退镜时未能及时发现患者肠道黏膜已有的损伤。因此,在内镜检查或诊疗操作结束退镜的过程中应仔细观察肠道黏膜的变化,以及时排除IC的可能。⑥术前询问患者病史和服药史,部分药物的长期使用会增加IC风险[7]。⑦术后常规监测D-二聚体指标,文毅等研究发现,IC患者D-二聚体指标平均值为1.70 mg/L,非IC患者为0.18 mg/L[26]。因此,具备IC高危因素的患者,建议内镜术后常规监测D-二聚体指标。⑧无二氧化碳气体供应前慎行ESD术。研究显示将空气作为注腔气体时容易导致结肠灌注减少[27],而二氧化碳具有扩张血管和直接改善结肠灌注的作用,可最大限度地降低IC发生风险,建议医院无二氧化碳气体供应前慎行ESD术。

