基于miR-208a-3p探究萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响
梅孝臣,王 磊,王 娟,张理想,陆 莹,张 娟,孙万日*
基于miR-208a-3p探究萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响
梅孝臣1,王 磊2,王 娟3,张理想1,陆 莹1,张 娟1,孙万日1*
1.郑州大学附属南阳市中心医院普外科,河南 南阳 473000 2.郑州大学第一附属医院小儿外科,河南 郑州 450000 3.南阳市宛城区第一人民医院普外科,河南 南阳 473000
探讨萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响及其作用机制。用10、20、40 μmol/L萝卜硫素处理人正常肝细胞L02、肝癌HepG2细胞48 h,通过CCK-8法筛选合适的萝卜硫素浓度用于后续实验;将HepG2细胞分为对照组和萝卜硫素(20 μmol/L)组,CCK-8法检测细胞增殖;Transwell测定细胞迁移与侵袭。设置对照组、模拟物(mimic)组及其阴性对照(mimic NC)组、抑制物(inhibitor)组及其阴性对照(inhibitor NC)组、真核翻译起始因子4E(eukaryotic translation initiation factor 4E,EIF4E3)过表达物(pcDNA-EIF4E3)组及其阴性对照(pcDNA)组、EIF4E3小干扰RNA(si-EIF4E3)组及其阴性对照(si-NC)组、pcDNA-EIF4E3+mimic NC组和pcDNA-EIF4E3+mimic组,利用LipofectamineTM2000转染试剂盒对HepG2细胞进行转染,转染48 h后,各组分别加入20 μmol/L萝卜硫素处理24 h,qRT-PCR检测HepG2细胞中表达;CCK-8法检测细胞增殖;Transwell测定细胞迁移与侵袭;双荧光素酶报告基因检测实验验证miR-208a-3p与EIF4E3靶向关系;Western blotting检测细胞中EIF4E3蛋白表达。与对照组比较,萝卜硫素组HepG2细胞在24、48 h的450值、侵袭及迁移细胞数目显著降低(<0.05);HepG2细胞中呈高表达,EIF4E3蛋白呈低表达;靶向负调控EIF4E3的表达;下调或过表达EIF4E3可增强萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用,而过表达或沉默EIF4E3则呈相反趋势;同时过表达和EIF4E3不会影响萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用。萝卜硫素可能通过下调进而上调EIF4E3的表达来抑制HepG2细胞增殖、侵袭及迁移。
肝癌;miR-208a-3p;萝卜硫素;真核翻译起始因子4E;增殖
肝癌是世界范围内的主要癌症,其发病率不断升高,且存活率低于10%[1]。尽管在医学、局部治疗和手术治疗方面取得了进展,但肝癌转移率高且易产生耐药性,导致其治愈率仍然较低[2]。因此,开发有效的治疗药物至关重要。萝卜硫素是一种异硫氰酸酯,广泛存在于西兰花和其他十字花科植物中[3]。研究表明,萝卜硫素可抑制肝癌细胞增殖,促进细胞凋亡,从而发挥抗肿瘤作用[4];萝卜硫素可抑制人肺腺癌A549细胞的侵袭和迁移[5]。而关于萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响鲜有报道。miRNA在肿瘤的发生与发展中发挥着重要的调控作用,下调miR-208-3p表达可抑制肝癌细胞的的增殖和侵袭[6]。生物信息学分析发现真核翻译起始因子4E(eukaryotic translation initiation factor 4E,)为的靶基因,且EIF4E3可调控肿瘤细胞的增殖、迁移与侵袭[7]。而萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响是否与miR-208-3p/EIF4E3轴有关尚不明确。因此本研究以miR-208-3p/EIF4E3轴为切入点,探究萝卜硫素对肝癌细胞增殖、侵袭和迁移的影响,以期为肝癌的临床治疗提供理论依据。
1 材料
1.1 细胞
人肝癌HepG2细胞及人正常肝细胞L02均购自中国科学院上海细胞库。
1.2 药品与试剂
萝卜硫素(质量分数≥98%,批号4478-93-7)购自青岛捷世康生物科技有限公司;阿霉素(质量分数99%,批号23214-92-8)购自武汉华玖医药科技有限公司;模拟物(mimic)及其阴性对照(mimic NC)、抑制物(inhibitor)及其阴性对照(inhibitor NC)、EIF4E3过表达物(pcDNA-EIF4E3)及其阴性对照(pcDNA)、EIF4E3小干扰RNA(si-EIF4E3)及其阴性对照(si-NC)均购自广州基迪奥生物科技有限公司;逆转录试剂盒(批号205111)购自上海玉博生物科技有限公司;ECL发光检测试剂盒(批号36222ES60)购自翌圣生物科技(上海)股份有限公司;BCA蛋白定量试剂盒(批号P0010)、双荧光素酶报告基因检测试剂盒(批号RG027)均购自上海碧云天生物技术有限公司;LipofectamineTM2000转染试剂盒(批号190521)购自美国Invitrogen公司;EIF4E3兔多克隆抗体(批号201103)、甘油醛-3-磷酸脱氢酶(glyceraldehyde- 3-phosphate dehydrogenase,GAPDH)兔多克隆抗体(批号200908)及HRP标记的羊抗兔IgG二抗(批号201007)购自北京索莱宝生物科技有限公司。
1.3 仪器
Elx800型酶标仪购自美国伯乐公司;CX23型光学显微镜购自日本OLYMPUS公司;EPICS-ALTRA型流式细胞仪购自美国Beckman Coulter公司;ImageMaster型凝胶成像分析仪购自美国应用生物系统公司;7700型qRT-PCR仪购自美国Applied Biosystems公司。
2 方法
2.1 细胞培养
HepG2细胞及L02细胞用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2的培养箱培养。
2.2 CCK-8法检测萝卜硫素对L02细胞和HepG2细胞存活率的影响
取处于对数生长期的HepG2细胞及L02细胞,以4×103个/孔接种至96孔板中,设置对照组及萝卜硫素低、中、高剂量(10、20、40 μmol/L)组和阿霉素(2.5 μmol/L)组,待细胞贴壁后,分别加入相应药物进行处理,对照组加入不含药物的DMEM培养基,另设置空白孔(无细胞),处理48 h后,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,采用酶标仪测定450 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(给药-空白)/(对照-空白)
2.3 细胞分组
取处于对数生长期的HepG2细胞,设置对照组(正常培养的HepG2细胞)和萝卜硫素组(20 μmol/L萝卜硫素处理的HepG2细胞),处理48 h后,用于检测萝卜硫素对HepG2细胞增殖、侵袭和迁移的影响。
取处于对数生长期的HepG2细胞,设置对照组、mimic NC组、mimic组、inhibitor NC组、inhibitor组、pcDNA组、pcDNA-EIF4E3组、si-NC组、si-EIF4E3组、pcDNA-EIF4E3+mimic NC组、pcDNA-EIF4E3+mimic组,将LipofectamineTM2000转染试剂与对应的转染物进行转染,转染48 h后,采用qRT-PCR检测mRNA表达,或采用Western blotting检测EIF4E3蛋白表达以验证转染效率。转染成功后,将上述对应各组细胞分别加入20 μmol/L萝卜硫素处理24 h,分别标记为萝卜硫素组、mimic NC+萝卜硫素组、mimic+萝卜硫素组、inhibitor NC+萝卜硫素组、inhibitor+萝卜硫素组、pcDNA+萝卜硫素组、pcDNA-EIF4E3+萝卜硫素组、si-NC+萝卜硫素组、si-EIF4E3+萝卜硫素组、pcDNA-EIF4E3+mimic NC+萝卜硫素组、pcDNA-EIF4E3+mimic+萝卜硫素组用于后续实验。
2.4 CCK-8法检测各组细胞增殖情况
按“2.2”项下方法进行细胞增殖测定,采用酶标仪测定450 nm处的值来评价细胞增殖能力。
2.5 Transwell检测细胞侵袭与迁移情况
2.5.1 侵袭实验 用不含胎牛血清的培养基将各组细胞稀释至6×104个/mL,取200 µL各组细胞接种到包被有Matrigel的Transwell上室,再向Transwell下室加入500 µL含20%胎牛血清的培养基。培养48 h后,取出Transwell小室,弃去孔内培养基,用棉签轻轻擦去上部未迁移的细胞,然后将细胞用甲醇固定30 min,0.1%结晶紫染色20 min,于光学显微镜下随机选取5个视野进行观察并计数。
2.5.2 迁移实验 用不含胎牛血清的培养基将各组细胞稀释至6×104个/mL,取200 µL各组细胞接种到Transwell上室,再向Transwell下室加入500 µL含20%胎牛血清的培养基。培养48 h后,按“2.5.1”项下方法处理。
2.6 qRT-PCR检测HepG2细胞miR-208a-3p mRNA表达
按照试剂盒说明书提取各组细胞总RNA并合成cDNA,进行qRT-PCR分析。以为内参,通过2−∆∆Ct方法计算的相对表达量。引物序列:上游引物5’-ATAAGACGAG- CAAAAAGCTTGT-3’,下游引物5’-GGAACGATA- CAGAGAAGATTAGC-3’;上游引物5’-TGCG- GGTGCTCGCTTCGCAGC-3’,下游引物5’-CCAG- TGCAGGGTCCGAGGT-3’。
2.7 双荧光素酶报告基因实验
分别构建EIF4E3的野生型(WT)和突变型(MUT)3’-UTR区质粒,标记为WT-EIF4E3、MUT-EIF4E3。利用LipofectamineTM2000转染试剂盒将WT-EIF4E3和MUT-EIF4E3分别与mimic NC或mimic共转染于HepG2细胞,转染48 h后,通过双荧光素酶测定系统检测相对荧光素酶活性。
2.8 Western blotting检测HepG2细胞EIF4E3蛋白表达情况
各组细胞加入RIPA裂解液,提取蛋白,采用BCA蛋白定量试剂盒进行定量,蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂奶粉封闭1 h,加入EIF4E3和GAPDH抗体,4 ℃孵育过夜;用TBST洗膜3次后,加入HRP标记的羊抗兔二抗,室温孵育2 h,采用ECL发光检测试剂盒显影,Image软件分析条带灰度值。
2.9 统计分析
使用GraphPad Prism 5软件进行统计分析,数据表示为,检验用于两组间的比较,单因素方差分析用于多组间的比较,两组之间比较采用SNK-检验。
3 结果
3.1 萝卜硫素对L02和HepG2细胞存活率的影响
如表1所示,与对照组相比,萝卜硫素(20、40 μmol/L)组L02及HepG2细胞存活率均显著降低(<0.05),且萝卜硫素浓度为20 μmol/L时,L02细胞存活率为96.33%,HepG2细胞存活率为50%,并高于阿霉素组,因此选用20 μmol/L萝卜硫素用于后续研究。
表1 萝卜硫素对L02和HepG2细胞存活率的影响(, n = 6)
Table 1 Effect of sulforaphane on survival rate of L02 and HepG2 cells (, n = 6)
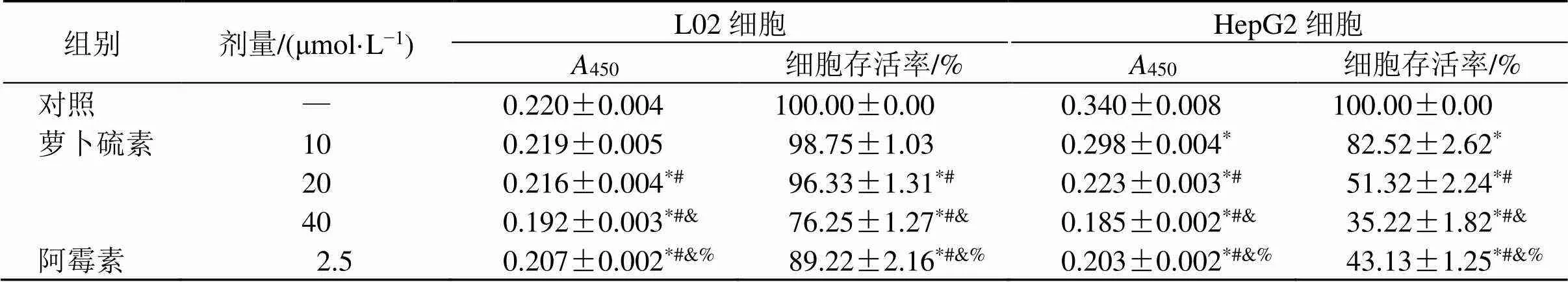
表1 萝卜硫素对L02和HepG2细胞存活率的影响(, n = 6)
组别剂量/(μmol·L−1)L02细胞HepG2细胞 A450细胞存活率/%A450细胞存活率/% 对照—0.220±0.004100.00±0.000.340±0.008100.00±0.00 萝卜硫素100.219±0.00598.75±1.030.298±0.004*82.52±2.62* 200.216±0.004*#96.33±1.31*#0.223±0.003*#51.32±2.24*# 400.192±0.003*#&76.25±1.27*#&0.185±0.002*#&35.22±1.82*#& 阿霉素2.50.207±0.002*#&%89.22±2.16*#&%0.203±0.002*#&%43.13±1.25*#&%
与对照组比较:*<0.05;与萝卜硫素(10 μmol·L−1)组比较:#<0.05;与萝卜硫素(20 μmol·L−1)比较:&<0.05;与萝卜硫素(40 μmol·L−1)组比较:%<0.05
*<0.05control group;#<0.05sulforaphane (10 μmol·L−1) group; compared with SFN-20 group;&<0.05sulforaphane (20 μmol·L−1) group;%<0.05sulforaphane (40 μmol·L−1) group
3.2 萝卜硫素对HepG2细胞增殖、侵袭和迁移的影响
如图1所示,与对照组比较,萝卜硫素组细胞的450值、侵袭及迁移细胞数目显著降低(<0.05)。
3.3 miR-208a-3p在L02、HepG2细胞中的表达情况及其对萝卜硫素处理后的HepG2细胞增殖、侵袭和迁移的影响
如表2所示,与L02细胞比较,HepG2细胞中的表达显著升高(<0.05);与HepG2细胞比较,20 μmol/L萝卜硫素处理后的HepG2细胞中的表达显著降低(<0.05)。
如表3所示,与对照组、mimic NC组比较mimic组HepG2细胞中表达水平显著升高(<0.05);与对照组、inhibitor NC组比较,inhibitor组HepG2细胞中表达水平显著降低(<0.05)。
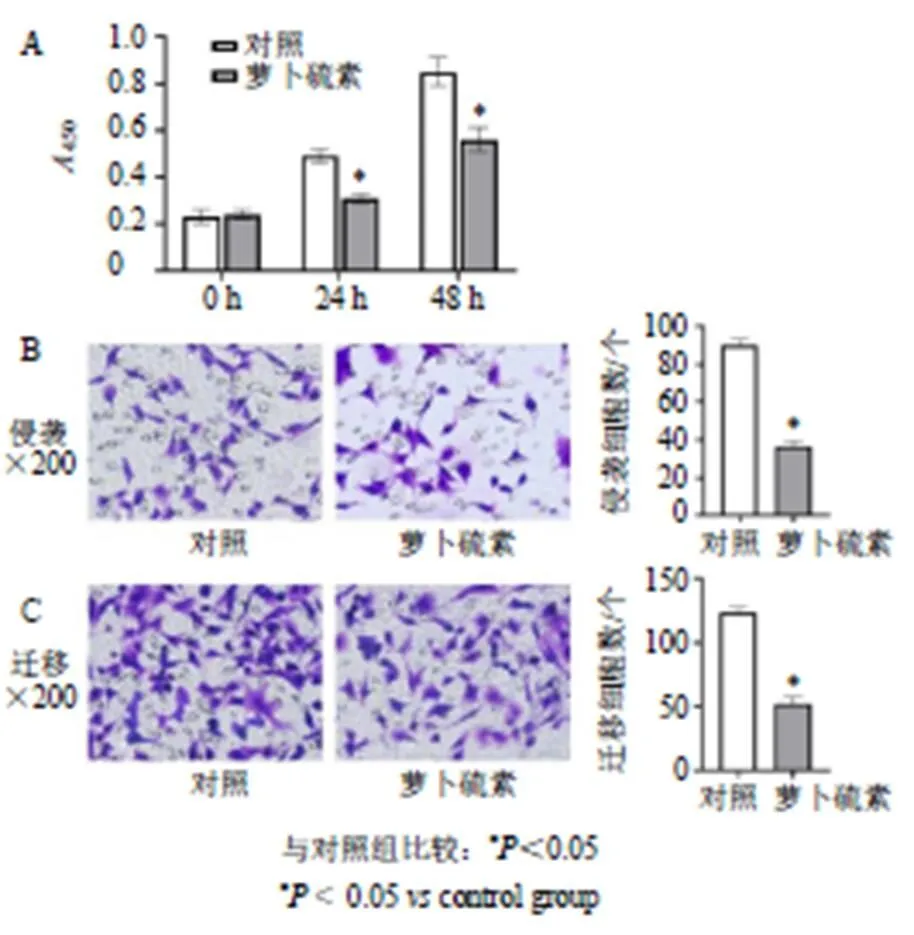
图1 萝卜硫素对HepG2细胞增殖(A)、侵袭(B)和迁移(C) 的影响(, n = 6)
表2 miR-208a-3p在L02、HepG2细胞中的表达情况(, n = 6)
Table 2 Expression of miR-208a-3p in L02 and HepG2 cells (, n = 6)

表2 miR-208a-3p在L02、HepG2细胞中的表达情况(, n = 6)
组别剂量/ (μmol·L−1)miR-208a-3p mRNA相对表达量 L02—1.00±0.00 HepG2—2.85±0.13* 萝卜硫素+HepG2201.35±0.11#
与L02细胞比较:*<0.05;与HepG2细胞比较:#<0.05
*<0.05L02 cells;#<0.05HepG2 cells
表3 miR-208a-3p在各转染组细胞中的表达情况(, n = 6)
Table 3 Expression of miR-208a-3p in cells of each transfection group (, n = 6)

表3 miR-208a-3p在各转染组细胞中的表达情况(, n = 6)
组别miR-208a-3p mRNA相对表达量 对照1.00±0.00 mimic NC1.08±0.07 miR-208a-3p mimic2.12±0.15*# inhibitor NC1.06±0.05 miR-208a-3p inhibitor0.36±0.02*&
与对照组比较:*<0.05;与mimic NC组比较:#<0.05;与inhibitor NC组比较:&<0.05
*<0.05control group;#<0.05mimic NC group;&<0.05inhibitor NC group
如图2所示,与萝卜硫素组、mimic NC+萝卜硫素组比较,mimic+萝卜硫素组HepG2细胞450值、侵袭及迁移细胞数目显著升高(<0.05);与萝卜硫素组、inhibitor NC+萝卜硫素组比较,inhibitor+萝卜硫素组细胞450值、侵袭及迁移细胞数目显著降低(<0.05)。

图2 过表达或抑制miR-208a-3p对萝卜硫素处理的HepG2细胞侵袭 (A、D)及迁移 (B、E)和增殖 (C) 的影响(, n = 6)
3.4 miR-208a-3p靶向调控EIF4E3的表达
Targetscan网站预测发现miR-208a-3p与EIF4E3存在结合位点,见图3。双荧光素酶报告基因实验结果显示,与mimic NC和WT-EIF4E3共转染组比较,mimic和WT-EIF4E3共转染组HepG2细胞的荧光素酶活性显著降低(<0.05);与mimic NC和MUT-EIF4E3共转染组比较,mimic和MUT-EIF4E3共转染组HepG2细胞的荧光素酶活性变化无统计学意义,见表4。
Western blotting结果(图4)显示,与对照组、mimic NC组比较,mimic组HepG2细胞中EIF4E3蛋白表达水平显著降低(<0.05);与对照组、inhibitor NC组比较,inhibitor组HepG2细胞中EIF4E3蛋白表达水平显著升高(<0.05)。

图3 Targetscan网站预测miR-208a-3p与EIF4E3的结合位点
表4 各组荧光素酶活性比较(, n = 6)
Table 4 Comparison of luciferase activity in each group (, n = 6)

表4 各组荧光素酶活性比较(, n = 6)
组别荧光素酶活性 WT-EIF4E3MUT-EIF4E3 mimic NC1.07±0.141.28±0.15 miR-208a-3p mimics0.33±0.02*1.21±0.13
与mimic NC组比较:*<0.05
*<0.05mimic NC group

A-对照组 B-mimic NC组 C-miR-208a-3p mimic组 D-inhibitor NC组 E-miR-208a-3p inhibitor组 与对照组比较:*P<0.05;与mimic NC组比较:#P<0.05;与inhibitor NC组比较:&P<0.05
3.5 萝卜硫素通过调控miR-208a-3p/EIF4E3抑制HepG2细胞的增殖、迁移与侵袭
如图5所示,与L02细胞比较,HepG2细胞中EIF4E3蛋白表达水平显著降低(<0.05);与HepG2细胞比较,萝卜硫素处理后的HepG2细胞中EIF4E3蛋白表达水平显著升高(<0.05)。
如图6所示,与对照组、pcDNA组比较,pcDNA- EIF4E3组HepG2细胞中EIF4E3蛋白表达水平显著升高(<0.05);与对照组、si-NC组比较,si-EIF4E3组HepG2细胞中EIF4E3蛋白表达水平显著降低(<0.05);与pcDNA-EIF4E3组、pcDNA-EIF4E3+mimic NC组比较,pcDNA-EIF4E3+miR-208a-3p mimic组HepG2细胞中EIF4E3蛋白表达水平显著降低(<0.05);与对照组比较,pcDNA-EIF4E3+mimic组HepG2细胞中EIF4E3蛋白表达水平无显著性差异。

A-L02细胞 B-HepG2细胞 C-萝卜硫素+HepG2细胞 与L02细胞比较:*P<0.05;与HepG2细胞比较:#P<0.05

A-对照组 B-pcDNA组 C-pcDNA-EIF4E3组 D-si-NC组 E-si-EIF4E3组 F-pcDNA-EIF4E3+mimic NC组 G-pcDNA-EIF4E3+mimic组 与对照组比较:*<0.05;与pcDNA组比较:#<0.05;与pcDNA-EIF4E3组比较:&<0.05;与si-NC组比较:%<0.05;与pcDNA-EIF4E3+mimic NC组比较:@<0.05
A-control group B-pcDNA group C-pcDNA-EIF4E3 group D-si-NC group E-si-EIF4E3 group F-pcDNA- EIF4E3 + mimic NC group G-pcDNA-EIF4E3 +group*<0.05control gr+oup;#<0.05pcDNA group;&<0.05pcDNA-EIF4E3 group;%<0.05si-NC group;@<0.05pcDNA-EIF4E3 + mimic NC group
图6 各组HepG2细胞中EIF4E3蛋白表达情况(,= 6)
Fig.6 EIF4E3 protein expression in HepG2 cells in each group (, n = 6)
如图7所示,与萝卜硫素组、pcDNA+萝卜硫素组比较,pcDNA-EIF4E3+萝卜硫素组HepG2细胞450值、侵袭及迁移细胞数目显著降低(<0.05);与萝卜硫素组、si-NC+萝卜硫素组比较,si-EIF4E3+萝卜硫素组HepG2细胞450值、侵袭及迁移细胞数目显著升高(<0.05);与pcDNA-EIF4E3+萝卜硫素组、pcDNA-EIF4E3+mimic NC+萝卜硫素组比较,pcDNA-EIF4E3+miR-208a-3p mimic+萝卜硫素组HepG2细胞450值、侵袭及迁移细胞数目显著升高(<0.05);与萝卜硫素组比较,pcDNA-EIF4E3+mimic+萝卜硫素组HepG2细胞450值、侵袭及迁移细胞数目无显著差异。
4 讨论
萝卜硫素是一种在十字花科蔬菜中发现的植物化学物质,可靶向参与癌症发展的多种途径[8]。研究表明,萝卜硫素可通过阻断Notch通路活化,下调Hes1表达,从而抑制结肠癌SW480细胞增殖、迁移和侵袭[9];萝卜硫素与索拉菲尼联用对HepG2细胞具有协同抗肿瘤作用,其机制可能与诱导细胞凋亡有关[10];萝卜硫素可通过抑制磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路活化进而降低胃癌SGC7901细胞增殖、迁移及侵袭能力[11]。本研究结果显示,萝卜硫素可抑制HepG2细胞存活率,呈剂量相关性,且萝卜硫素浓度为20 μmol/L时,细胞存活率接近50%,因此选用20 μmol/L萝卜硫素用于后续研究;本研究还发现,与对照组比较,萝卜硫素组HepG2细胞在24、48 h的450值、侵袭及迁移细胞数目显著降低,提示萝卜硫素可抑制HepG2细胞增殖、侵袭及迁移。
miRNA是长度为22~25 nt的非编码RNA,其在转录后或翻译水平负调控基因表达,可参与许多细胞过程的调节,如细胞增殖、凋亡、迁移和侵袭等[12]。越来越多的证据表明,多种miRNA在肝癌等人类恶性肿瘤中异常表达,miRNA的失调表达与癌症的发病机制密切相关[13]。miR-208a-3p作为miRNA家族的一员,已有研究报道miR-208a-3p在宫颈癌中高表达,抑制miR-208a-3p可抑制宫颈癌细胞的增殖、迁移和侵袭[14];过表达miR-208a-3p能够促进骨肉瘤细胞的增殖和转移能力[15];抑制miR-208-3p可减弱肝癌细胞的增殖和侵袭能力[6];miR-208a-3p通过靶向程序性细胞死亡因子4(programmed cell death 4,PDCD4)在结直肠癌中发挥致癌基因的作用[16]。本研究结果显示,miR-208a-3p在HepG2细胞中高表达,过表达miR-208a-3p可减弱萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用,下调miR-208a-3p可增强萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用,提示miR-208a-3p参与了HepG2细胞增殖、侵袭及迁移过程,萝卜硫素可能通过下调miR-208a-3p表达抑制HepG2细胞增殖、侵袭及迁移。

图7 过表达或抑制EIF4E3对萝卜硫素处理的HepG2细胞侵袭 (A、D)及迁移 (B、E)和增殖 (C) 的影响(, n = 6)
为了进一步探究萝卜硫素通过下调miR-208a-3p表达抑制HepG2细胞增殖、侵袭及迁移的作用机制,本研究通过双荧光素酶报告基因实验证实EIF4E3为miR-208a-3p的靶基因。EIF4E3是真核细胞翻译起始和调控的核心成分,能够选择性地控制肿瘤基因的翻译和表达[17]。研究表明,过表达EIF4E3通过下调周期蛋白B1蛋白表达,抑制细胞周期的G2/M期,从而抑制宫颈癌细胞的增殖及克隆形成能力[18];敲低EIF4E3可显著增强胃癌BGC-823和MGC-803细胞的增殖、迁移和侵袭能力[7]。本研究结果显示,EIF4E3蛋白在HepG2细胞中低表达,miR-208a-3p可靶向负调控EIF4E3,沉默EIF4E3可减弱萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用,过表达EIF4E3可增强SFN对HepG2细胞增殖、侵袭及迁移的抑制作用,同时过表达miR-208a-3p和EIF4E3不会影响萝卜硫素对HepG2细胞增殖、侵袭及迁移的抑制作用,提示萝卜硫素可能通过调控miR-208a-3p/EIF4E3抑制HepG2细胞增殖、侵袭及迁移。
综上所述,萝卜硫素可能通过下调miR-208a-3p进而上调EIF4E3的表达来抑制HepG2细胞增殖、侵袭及迁移。
利益冲突 所有作者均声明不存在利益冲突
[1] Wang H B, Lu Z M, Zhao X X.Tumorigenesis, diagnosis, and therapeutic potential of exosomes in liver cancer [J]., 2019, 12(1): 133.
[2] Nwosu Z C, Piorońska W, Battello N,.Severe metabolic alterations in liver cancer lead to ERK pathway activation and drug resistance [J]., 2020, 54: 102699.
[3] Nandini D B, Rao R S, Deepak B S,.Sulforaphane in broccoli: The green chemoprevention!! Role in cancer prevention and therapy [J]., 2020, 24(2): 405.
[4] Wu G T, Yan Y L, Zhou Y Y,.Sulforaphane: Expected to become a novel antitumor compound [J]., 2020, 28(4): 439-446.
[5] 邵松军, 段玲弟, 张湘燕, 等.萝卜硫素对肺腺癌A549细胞侵袭迁移的抑制作用及其机制 [J].山东医药, 2021, 61(15): 41-44.
[6] 余鹏.抑制ARID2表达并促进肝细胞肝癌(HCC) 增生和侵袭 [D].重庆: 第三军医大学, 2015.
[7] 黄金丽.circPEX6调控miR-501/eIF4E3轴抑制胃癌细胞增殖、迁移和侵袭能力 [D].大连: 大连医科大学, 2020.
[8] Calcabrini C, Maffei F, Turrini E,.Sulforaphane potentiates anticancer effects of doxorubicin and cisplatin and mitigates their toxic effects [J]., 2020, 11: 567.
[9] 刘洋, 孟祥彩, 王益民, 等.萝卜硫素对结肠癌SW480细胞增殖、侵袭及Notch通路的影响 [J].中华普通外科学文献: 电子版, 2020, 14(6): 434-438.
[10] 黄建峰, 魏小栋, 翟东升.萝卜硫素联合索拉菲尼对肝癌HepG2细胞生长抑制和凋亡的影响 [J].天津中医药, 2019, 36(12): 1222-1226.
[11] 杨艳华, 梁丽琴.萝卜硫素对胃癌细胞生物学特征的影响及其机制研究 [J].中国药师, 2019, 22(5): 840-844.
[12] Zhang X, Xu X Y, Ge G H,.miR-498 inhibits the growth and metastasis of liver cancer by targeting ZEB2 [J]., 2019, 41(3): 1638-1648.
[13] Balacescu O, Sur D, Cainap C,.The impact of miRNA in colorectal cancer progression and its liver metastases [J]., 2018, 19(12): 3711.
[14] 李利玲, 王少帅, 汪向红, 等.靶向LZTFL1调控宫颈癌细胞的增殖和侵袭转移及其分子机制 [J].西部医学, 2020, 32(9): 1292-1297.
[15] Fu Y T, Wang Y, Bi K,.microRNA-208a-3p promotes osteosarcoma progression via targeting PTEN [J]., 2020, 20(6): 255.
[16] Wu H L, Xu L L, Chen Y O,.functions as an oncogene in colorectal cancer by targeting[J]., 2019, 39(4): BSR20181598.
[17] 姚运红, 袁炜, 熊敏涵, 等.潜在抑癌基因eIF4E3野生型和突变体质粒的构建 [J].黑龙江医学, 2020, 44(4): 472-474.
[18] 孙丽萍, 姚运红, 庞天云, 等.潜在抑癌基因eIF4E3对宫颈癌细胞分裂增殖的影响 [J].广东医学, 2016, 37(11): 1602-1606.
Effect of sulforaphane on proliferation, invasion and migration of liver cancer cells based on miR-208a-3p
MEI Xiao-chen1, WANG Lei2, WANG Juan3, ZHANG Li-xiang1, LU Ying1, ZHANG Juan1, SUN Wan-ri1
1.Department of General Surgery, Nanyang Central Hospital Affiliated to Zhengzhou University, Nanyang 473000, China2.Department of Pediatric Surgery, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China 3.Department of General Surgery, The First People’s Hospital of Wancheng District, Nanyang 473000, China
To investigate the effect and mechanism of sulforaphane on proliferation, invasion and migration of liver cancer cells.Human normal liver cells L02 and hepatocarcinoma HepG2 cells were treated with 10, 20, 40 μmol/L sulforaphane for 48 h, and the appropriate sulforaphane concentration was screened by CCK-8 method for subsequent experimental studies; HepG2 cells were divided into control group and sulforaphane (20 μmol/L) group, CCK-8 method was used to detect cell proliferation; Transwell was used to measure cell migration and invasion.HepG2 cells were divided into control group,mimic group, mimic group,inhibitor group, inhibitor NC group, pcDNA-eukaryotic translation initiation factor 4E (EIF4E3) group, pcDNA group, si-EIF4E3 group, si-NC group, pcDNA-EIF4E3 + mimic NC group and pcDNA-EIF4E3 +mimic group, HepG2 cells were transfected with LipofectamineTM2000 transfection kit, after 48 h of transfection, each group was treated with 20 μmol/L sulforaphane for 24 h.qRT-PCR was used to detect the expression ofin HepG2 cells; CCK-8 method was used to detect cell proliferation; Transwell method was used to measure cell migration and invasion; Dual luciferase reporter gene detection experiment was used to verify the targeting relationship between miR-208a-3p and EIF4E3; Western blotting was used to detect the EIF4E3 protein expression in cells.Compared with control group,450value, number of invasion and migration cells of HepG2 cells in sulforaphane group were significantly reduced (< 0.05);in HepG2 cells was highly expressed and EIF4E3 protein was low expressed; miR-208a-3p targeted and negatively regulated the expression of EIF4E3; Down-regulation ofor over-expression of EIF4E3 could enhance the inhibitory effects of sulforaphane on HepG2 cell proliferation, invasion and migration, while overexpression ofor silence of EIF4E3 showed the opposite trend; Overexpression ofand EIF4E3 at the same time would not affect the inhibitory effects of sulforaphane on HepG2 cell proliferation, invasion and migration.Sulforaphane may down-regulateto up-regulate the expression of EIF4E3, thereby inhibiting the proliferation, invasion and migration of HepG2 cells.
liver cancer; miR-208a-3p; sulforaphane; eukaryotic translation initiation factor 4E; proliferation
R285.5
A
0253 - 2670(2022)05 - 1450 - 08
10.7501/j.issn.0253-2670.2022.05.020
2021-11-04
梅孝臣(1981—)男,硕士研究生,主治医师,主要从事肝胆外科方面研究。E-mail: mx1981c@163.com Tel: 18538976966
通信作者:孙万日(1971—)男,硕士研究生,主任医师,主要从事肝胆外科方面研究。E-mail: 15890879873@163.com Tel: 15890879873
[责任编辑 李亚楠]