超声造影在甲状腺良性结节微波消融手术中的应用价值
邱晓俊 李宁星 叶盛 汤长江 罗斯立
近年来,甲状腺结节的诊断率明显上升,随着医疗理念的微创化转变,MWA 治疗较外科手术有无以比拟的优势,在甲状腺良性结节治疗中得到迅速普及应用[1]。超声检查作为影像引导技术安全方便,在消融过程的引导及疗效评估方面被广泛使用,但其对消融灶评估并不够精确[2,3]。而CEUS 技术逐渐成为引导甲状腺良性结节MWA 的重要影像学方法。本文通过选取2017 年9 月~2019 年9 月在本院接受MWA 的90 例甲状腺良性结节患者为研究对象,通过CEUS 与常规超声的对比,探讨CEUS 指导MWA 及评估消融范围的优越性,为更多的临床推广应用奠定基础。现报告如下。
1 资料与方法
1.1 一般资料 选取2017 年9 月~2019 年9 月入住本院并接受MWA 的90 例甲状腺良性结节患者为研究对象。其中男19 例,女71 例;年龄19~61 岁,平均年龄(39.36±7.82)岁。根据《甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗专家共识》(2018 版)制定筛选标准[4]。纳入标准:所有甲状腺结节均经2DUS 检查并测量结节大小(前后径、左右径、上下径);所有甲状腺结节术前均经细胞学或组织学穿刺,病理结果提示为良性;术前检查、甲状腺功能检查均正常;患者要求行MWA。排除标准:凝血功能异常;甲状腺功能亢进;伴有严重呼吸循环系统等疾病;影像学或其他检查提示恶性可能;依从性差,不配合。将患者按随机数字表法分为A 组、B 组、C 组,每组30 例。A 组男6 例,女24 例;年龄19~61 岁,平均年龄(42.40±9.20)岁;术前甲状腺结节体积(4.43±0.93)cm3。B 组 男6 例,女24 例;年 龄26~52 岁,平均年龄(40.53±8.86)岁;术前甲状腺结节体积(4.33±0.66)cm3。C 组 男7 例,女23 例;年 龄20~52 岁,平均年龄(38.50±6.68)岁;术前甲状腺结节体积(4.69±1.0)cm3。三组患者性别、年龄、结节体积等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 仪器设备 采用美国LOGIQ E9 6~15 MHz 高频线阵探头。消融仪为南京维京九州医疗公司生产,型号MTC-3C,消融针采用MTC-3CA-Ⅱ4 甲状腺消融针。消融治疗由接受过介入超声专业培训的临床医师与助手配合完成。造影剂采用SonoVue 注射用六氟化硫微泡。
1.2.2 操作方法 术前三组均行2DUS 测量甲状腺结节前后、左右、上下径,用CDFI 观察肿块内部、周边血流及分布情况。术中以2DUS 实时引导消融手术。C 组消融后采用2DUS 及CDFI 评估消融效果;B 组消融后采用CEUS 评估消融效果,检查后对未完全灭活的组织进行再次补充消融;A 组消融前后均行CEUS,术前指导消融手术,术后评估消融效果,检查后对未完全灭活的组织进行再次补充消融。
1.2.2.1 MWA 方法 患者取仰卧位,颈部过伸使颈部充分暴露,常规消毒、铺巾。采用1%利多卡因对皮肤、针道及结节周围进行局部麻醉,生理盐水及利多卡因混合液将甲状腺与颈动脉间隙、甲状腺与气管间隙、甲状腺与食管间隙及甲状腺后间隙(喉返神经走行区) 分离,形成“液体隔离带”,以保护上述重要结构免于热损伤。用尖刀片在穿刺点做一微小切口,在2DUS引导下经皮将微波刀置入结节中,功率调至30 W,进行多点、多面移动式消融,直至结节被热能量生成的强回声完全覆盖。
1.2.2.2 CEUS 方法 术前用5 ml 生理盐水稀释震荡造影剂后抽取 1.5 ml 经肘静脉快速团注,后追加5 ml生理盐水冲洗,造影剂注入同时按下Contrast 键观察甲状腺结节显影范围(A 组);术毕六氟化硫微泡造影剂静脉推注1.5 ml,再团注5 ml 生理盐水,观察甲状腺结节及周围正常组织显影情况(A 组、B 组)。
1.3 观察指标及疗效标准 ①消融后分别行2DUS、CEUS 检查测得A、B 组甲状腺结节消融体积,并进行比较。②比较三组术中出血量。③术后2DUS 及CDFI随访1 年,比较三组原位复发情况,若在原消融区内再次发现与原结节回声相近的结节且结节内见血流信号,则认定为结节复发;若无血流信号,则考虑为术后未完全吸收的坏死结节,评价为结节未复发。结节体积=前后径×左右径×上下径×π/6。消融体积=消融前结节体积-消融后结节体积。
1.4 统计学方法 采用SPSS25.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 三组术中出血量比较 C 组术中出血量少于A 组、B 组,A 组少于B 组,差异具有统计学意义(P<0.05)。见表1。
表1 三组术中出血量比较(,ml)
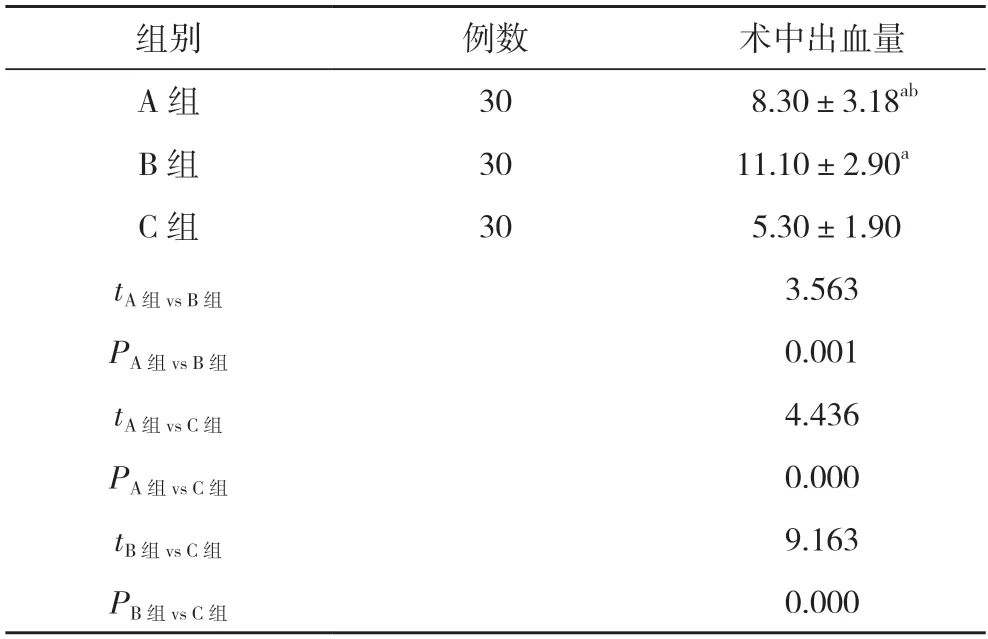
表1 三组术中出血量比较(,ml)
注:与C 组比较,aP<0.05;与B 组比较,bP<0.05
2.2 A 组、B 组消融后2DUS、CEUS 测得消融体积比较 消融后,A 组2DUS 测得消融体积为(5.35±0.58)cm3,CEUS 测得消融体积为(4.34±0.47)cm3;B 组2DUS 测得消融体积为(5.06±0.44) cm3,CEUS 测得消融体积为(4.04±0.32)cm3。A 组、B 组2DUS 测得消融体积均大于本组CEUS 测得消融体积,差异均有统计学意义(P<0.05);A 组2DUS、CEUS 测得消融体积均大于B 组,差异具有统计学意义(P<0.05)。见表2。
表2 A 组、B 组消融后2DUS、CEUS 测得消融体积比较(,cm3)
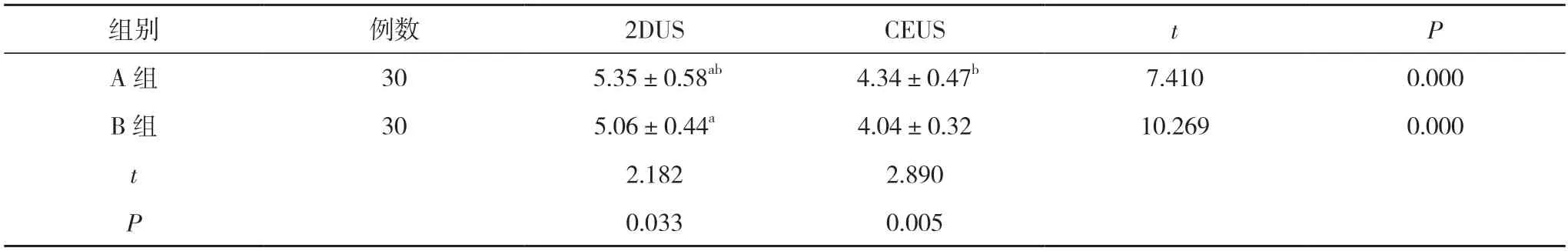
表2 A 组、B 组消融后2DUS、CEUS 测得消融体积比较(,cm3)
注:与本组CEUS 比较,aP<0.05;与B 组比较,bP<0.05
2.3 三组原位复发情况比较 术后随访1 年,A 组、B 组全部无复发,C 组原位复发5 例。A 组、B 组原位复发率均为0,低于C 组的16.67%,差异有统计学意义(P<0.05)。见表3。
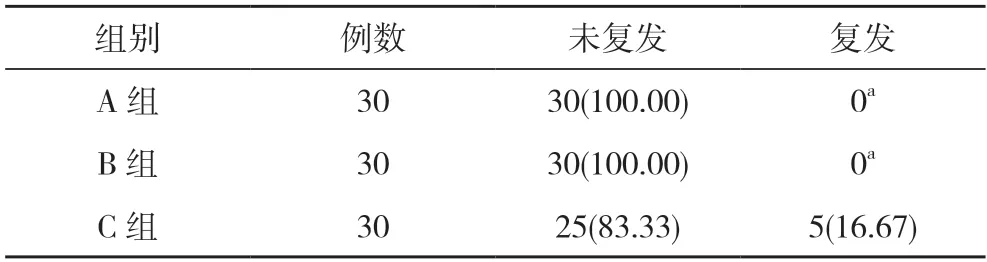
表3 三组原位复发情况比较[n(%)]
3 讨论
近年来随着甲状腺肿瘤发病率增高以及高频超声检查技术的广泛运用,甲状腺良恶性结节的诊断率明显上升,相关手术也相应增加。随着医疗理念的转变,甲状腺结节的微创诊治成为了当今临床医学发展的主流方向。针对有需求的甲状腺良性结节,超声引导下经皮MWA 治疗因其微创、快速、无瘢痕及恢复快等优势,已快速进入普及应用的上升通道[1]。常规超声作为影像引导技术安全方便,但相较于CDFI 对结节微血管显示不足,CEUS 技术能够对组织和结节的血流灌注情况敏感地显示,对术前甲状腺结节良恶性的评估、术前良性结节边界的界定、结节囊实性的鉴别及评估消融范围避免结节残留、复发都有优势[5-8]。
本研究统计显示,C 组术中出血量少于A 组、B 组,A 组少于B 组,差异具有统计学意义(P<0.05)。分析原因为:C 组是由常规超声引导的MWA,术后评估检出结节残留率低,补充消融率较低,反复穿刺操作较少,故术中出血量最少;B 组术后行CEUS 评估结节残留情况,基于CEUS 较常规超声抗气化区的干扰能力较强及对残留结节血流灌注的敏感性优势,术后评估检出结节残留率较高,补充消融率较高,从而引起反复穿刺操作,故术中出血量最多;相较于B 组,A 组于消融前也行了CEUS,对甲状腺结节的边界、囊实性的鉴别、血流灌注情况均有更充分的评估,从而优化了手术流程,减少了结节残留导致补充消融率,故A 组术中出血量少于B 组,而补充消融率高,故术中出血量多于C 组。有研究报道,2DUS 与CEUS 对甲状腺结节MWA 术后坏死体积的评估显示,CEUS 评估术后坏死体积小于2DUS[8,9]。有学者报道,2DUS 虽然可以显示MWA 后消融区的变化,但显示结果较原结节增大,并且边界不清,内部回声强弱不均[10]。本研究显示,A 组、B 组2DUS 测得消融体积均大于本组CEUS测得消融体积,差异均有统计学意义(P<0.05);A 组2DUS、CEUS 测得消融体积均大于B 组,差异具有统计学意义(P<0.05)。与上述研究相符。MWA 会导致组织气化,常规超声受气化干扰,显示的是气化区,而非消融区,而CEUS 对血流灌注敏感,对坏死区及残留结节显示更为准确。且术后CEUS 可以指导残留结节再消融,减少消融残留病灶。CEUS 副作用少、可重复,是甲状腺结节MWA 术后坏死区的有效评估方法[11]。本研究术后随访1 年,A 组、B 组全部无复发,C 组原位复发5 例。A 组、B 组原位复发率均为0,低于C 组的16.67%,差异有统计学意义(P<0.05)。结果与何慧灵等[12]研究相符。
综上所述,CEUS 在甲状腺良性结节MWA 治疗中较常规超声具有优势性指导作用,消融前CEUS 指导手术可减少出血量,术后CEUS 可减少消融残留病灶,降低术后复发率,值得临床推广使用。

