急性早幼粒细胞白血病缓解后继发急性淋巴细胞白血病一例
陈信 黄丽芳 孟凡凯 汪智琼
患者,男,32岁,2016年2月因“血尿5天、口腔溃疡伴牙龈出血2天”就诊于深圳市宝安区人民医院。患者5天前无明显诱因出现血尿,全程尿色皆鲜红,2天后尿色转为暗红。尿中无泡沫,不伴尿痛、腰痛、尿液淋沥不净,大便正常。2天前晨起发现下唇系带附近口腔溃疡,溃疡面出血结痂,伴牙龈出血,为求进一步治疗来我院就诊,门诊以“血尿、牙龈出血”收入院。有氮甲基吡咯烷酮(N-MP)接触史2年,有食用野生动物史,既往无其他病史。体格检查:T 36.5 ℃,P 116次/分,R 20 次/分,Bp 127/80 mmHg。神志清楚,轻度贫血貌,淋巴结无肿大,胸骨无压痛,肝脾肋下未触及。血常规:WBC计数3.0×109g/L(3.5~9.5×109g/L,括号内为正常参考值范围,以下相同),Hb 130 g/L(130~175 g/L),PLT计数38×109/L(125~350×109/L)。骨髓细胞学检查结果:异常早幼粒细胞占94%,胞体大且不规则,伴疣状突起;可见柴捆状Auer’s小体,胞浆丰富,呈内外浆,外浆深蓝色,无颗粒,内浆富含粗大的嗜苯胺蓝颗粒;核椭圆形或扭曲折叠,染色质疏松,核仁不明显;过氧化物酶染色(POX)呈强阳性,考虑急性早幼粒细胞白血病(APL,图1)。骨髓活检结果:异常细胞弥漫性增生,正常造血罕见,考虑急性白血病,倾向APL。流式细胞学检查结果:异常细胞占有核细胞的94%,表达CD9、CD13、CD33、CD38、CD58、CD117、MPO,提示AML。白血病31种融合基因筛查结果:PML/RARA阳性。AML基因突变(包括FLT3、C-KIT、NPM1、CEBPA)检查结果均为阴性。染色体检查结果:46,XY,t(15;17)(q22;q21)[20]。综合实验室检查结果及临床特征确诊为APL中危。予三氧化二砷(ATO)10 mg每日注射1次,全反式维甲酸(ATRA)20 mg每日2次及吡柔比星(THP)40 mg每日2次诱导化疗。同年3月行IA(去甲氧柔红霉15 mg、d1~3,阿糖胞苷Ara-c 100 mg每12 h 1次、d1~7)化疗。5月及6月行TA(THP 40 mg、d1~3、Ara-c 100 mg每12 h 1次、d1~7)化疗,化疗期间共行4次腰穿+鞘内注射。7月进入ATO维持阶段,第1年ATO 10 mg注射,d1~14,2周休4周,每个疗程6周;第2年仍行ATO方案,2周休6周,每个疗程2个月。治疗期间患者未口服其他药物,无临床不适症状,按规定时间复查骨髓细胞学、流式细胞学、PML/RARA微小残留及PML/RARA易位探针检测。2018年6月16日患者再次入院,骨髓细胞学检查结果:原始细胞占10%,胞体大小不等,胞浆量多少不一,部分含空泡,无颗粒,核类圆形,染色质浓淡不均,核仁显隐不一,POX染色呈阴性。流式细胞学检查结果:异常细胞占8%,表达HLA-DR、CD9、CD34、CD19、CD22、CD33、CD38、CD123、cCD79a、TdT,部分表达CD34,考虑异常幼稚B淋巴细胞伴髓系标志表达。同年7月、9月及11月骨髓细胞学原始、幼稚淋巴细胞分别占14%、25%和88.5%(图2),7月、9月及11月流式细胞学检查结果显示异常幼稚B淋巴细胞分别占30%、45%和70%。白血病43种融合基因及Ph-like ALL相关33种融合基因检查结果均为阴性。血液病34种高频突变基因筛查结果:KIT(NM000222):c.251C>T(p.Thr84Met)(杂合,变异频率48.35%)。PML/RARA易位探针检测结果为阴性,染色体核型正常。当时考虑为药物不良反应或检验误差,连续3次骨髓检查,异常幼稚淋巴细胞比例越来越高,最终达到ALL诊断标准,确诊为APL缓解两年后继发ALL。开始予VDCLP化疗,第28天复查骨髓细胞学结果显示完全缓解。2019年1月予以HyperCVAD(A)化疗(CTX 0.5每12 h 1次、d1~3,DXM 40 mg、d1~4,THP 42 mg d4,VCR 2 mg、d4)。2019年2月予HD MTX 5.1g d1 24 h维持化疗。患者与哥哥HLA配型半相合,于同年8月行异基因造血干细胞移植(allo-HSCT),随访至今,情况较好。
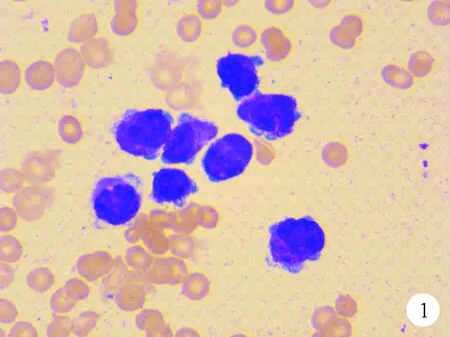
图1 患者2016年2月骨髓细胞学检查结果(瑞氏染色,×100)
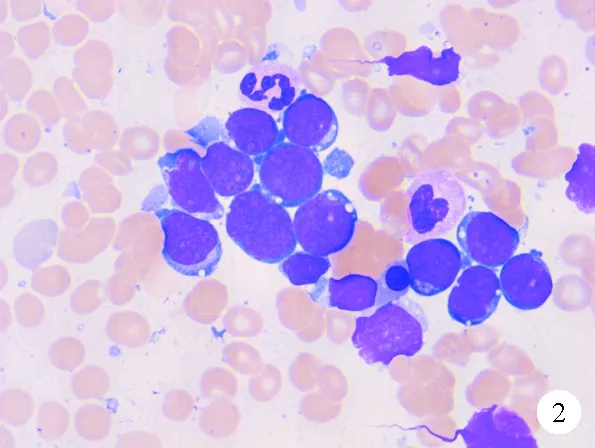
图2 患者2018年11月骨髓细胞学检查结果(瑞氏染色,×100)
讨 论
依据细胞形态学、免疫学、细胞遗传学和分子生物学分型(MICM分型)患者诊断为APL,初诊时骨髓细胞学检查结果主要表现为充满粗大颗粒的异常早幼粒细胞,染色体核型为46,XY,t(15;17)(q22;q21)[20],聚合酶链反应(PCR)和荧光原位杂交技术(FISH)检测融合基因结果皆为阳性,APL诊断可靠。给予ATO+ATRA+THP诱导化疗,IA及TA方案化疗半年缓解后,继用ATO方案维持,获得两年的持续缓解。原发白血病和继发白血病的MICM分型差别明显,肿瘤细胞形态完全不同,胞浆内没有颗粒,POX染色呈阴性,无论细胞遗传学还是分子遗传学和分子生物学方法均未检测到PML/RARA融合基因,确定不是APL复发,通过流式细胞学检查进一步证实为新发的克隆,确诊为APL缓解两年后再发B细胞急性淋巴细胞白血病(B-ALL)。
APL常发于中青年,中位发病年龄44岁,占同期AML的10%~15%,发病率为0.23/100 000[1]。本例患者主要化疗药物为ATO、ATRA联合阿糖胞苷和蒽环类。80年代初发现ATRA能有效诱导早幼粒细胞分化并成熟,标志APL靶向治疗的开始。进一步对ATRA联合化疗进行多项研究,发现联合化疗有互补促进作用,能提高生存率、降低复发率。在APL93试验[2]中,ATRA联合化疗(蒽环类药物联合阿糖胞苷)与ATRA单药治疗后序贯化疗对比,两者的完全缓解(CR)率为96.5%与92.6%。ATO可促使APL细胞分化和凋亡,且患者血液学毒性发生率低,感染率少,抗白血病效果更强更持久。APL0406试验[3]对比了中低危APL的ATRA联合AT0与ATRA联合化疗疗效,两组CR率分别为100%和97%,50个月的无病生存(EFS)率为97.3%和80.0%,2年总生存(OS)率为99.2%和92.6%,复发率为1.9%和13.9%。ATRA联合ATO治疗的方式优于单药使用或联合化疗药物的使用。
国外报道APL继发髓系肿瘤的发生率为0.97%~9.20%;国内APL继发AML仅为个案报道[4],而治疗相关性ALL罕见。关于APL继发白血病的机制尚不清楚,可能与患者经数次联合化疗、免疫功能不全或存在多癌基因等因素相关,但认为主要与化疗相关。李建勇等[5]报道的1例APL继发AML病例中考虑蒽环类药物在继发性AML的发病中发挥重要作用,但未提及阿糖胞苷致白血病作用。刘金霞等[6]曾应用阿糖胞苷未能提高APL的效果,是否诱发第二肿瘤还有待扩大样本进一步探讨。郑正津等[7]报道的1例APL继发ALL的病例中发现蒽环类药物或与继发白血病相关。Eghtedar等[8]认为ATO联合ATRA治疗APL可继发实体瘤,但报道中只列出诱导方案,没有列出巩固和维持治疗方案的药物。本例患者有两年的ATO维持治疗阶段,我们认为ATO与继发ALL可能相关。
本例患者有氮甲基吡咯烷酮(N-MP)接触史,它是一种有机溶剂,广泛用于石化、电子、电工加工、油漆、兽药和农药。动物实验显示其对大鼠有中度刺激与致畸作用,能通过呼吸道、消化道和皮肤进入人体,是对多脏器造成损害的毒物[9],但对人体的毒效应特征、靶器官等均不明确,未见致癌性报道,其是否会引起癌基因过度表达并抑癌基因的变异或缺失,从而导致疾病发生,还有待探讨。患者有食用野生动物史,是否感染特殊病毒、这些病毒在病变某一阶段是否起主导作用仍值得验证。郭良耀[10]曾报道1例APL缓解5年后并发非霍奇金淋巴瘤、淋巴瘤治疗后APL再次复发的病例,髓系肿瘤APL与淋系淋巴瘤或ALL之间是否存在相互作用的机制还需探讨。
APL继发白血病患者的预后差,治疗难度大,因前期化疗或放疗、预后不良基因发生比例高、造血功能降低、器官功能异常、免疫力不全等原因对化疗药物耐受性降低,再次化疗风险性大[11]。关于如何治疗尚无相关指南推荐,而行allo-HSCT被认为最有可能治愈。有研究对allo-HSCT治疗t-MDS/AML进行回顾性分析结果显示,868例患者的5年EFS率为21%,OS率为22%[12]。本例患者及时进行allo-HSCT,得到较好的长期生存。
总之,APL继发ALL罕见,疾病预后差,发病机制还不清楚。坚持MICM综合评估,监测流式细胞免疫表型变化,通过染色体改变可早发现APL继发白血病。若发生,选择allo-HSCT可能获益。

