免疫标记和BRAF V600E突变联合检测在细胞学诊断不确定甲状腺结节中的应用*
王 欢,陈 昶,姜 勇△,姜 可,李金男,苏学英,雷建勇
1.四川大学华西医院 病理科(成都 610041);2.四川大学华西医院 甲状腺外科(成都 610041)
当前,全球范围内甲状腺结节的发病率呈快速增长趋势,患病率为3%~7%[1]。由于85%的甲状腺结节为良性,临床工作重点是鉴别恶性病变,以便手术切除或动态监测。当出现临床指征时,细针穿刺(fine-needle aspiration,FNA)细胞学因其具有很好的灵敏度、特异度,且快捷、安全、创伤小,目前已被列为临床上诊断甲状腺结节最精确的首选方法[2-4]。然而,尽管大多数良、恶性结节都能被正确识别,但15%~30%的甲状腺FNA细胞学诊断结果仍被归类为不确定性病变,即所谓的灰区[5-6]。根据Bethesda甲状腺细胞病理学报告系统[7],不确定的细胞学诊断包括3个特定类别:意义不明的细胞非典型/滤泡性病变(atypia of undetermined significance/follicular lesion of undetermined significance,AUS/FLUS)、滤泡性肿瘤或可疑滤泡性肿瘤(follicular neoplasm/suspicious for a follicular neoplasm,FN/SFN)及可疑恶性肿瘤(suspicious for malignancy,SUSP)。对于细胞学诊断不确定的上述3类结节,不同机构的实际恶性风险差别很大[8-9],这意味着许多细胞学诊断不确定的患者将被安排重复FNA或行诊断性甲状腺切除术等处理,因此对这部分患者,临床决策仍需基于FNA穿刺材料并使用后续辅助技术加以甄别,免疫标记和BRAF V600E突变联合检测可能是理想的候选方法。
检测或排除甲状腺恶性肿瘤(乳头状癌占绝大多数)有价值的免疫标记包括半乳糖凝集素-3(galectin-3,Gal-3)、细胞角蛋白-19(cytokeratin-19,CK-19)和间皮细胞角蛋白-1(hector battifora mesothelial-1,HBME-1)。Gal-3是β-半乳糖苷结合凝集素家族的成员,在高分化甲状腺癌中高度表达。CK-19作为角蛋白家族的一员,对上皮细胞的结构完整性起着重要作用,在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)中持续过表达。HBME-1是针对间皮瘤细胞微绒毛表面抗原的单克隆抗体。上述3种免疫标记在甲状腺病变中鉴别诊断的价值已受到广大学者[6,10-12]的关注,但遗憾的是由于其在良性结节中的表达程度不同,没有一项指标绝对可靠的。同时,基因检测也被广泛应用于甲状腺结节的术前诊断中,其中BRAF V600E突变检测是PTC最常用的检测方法。然而其敏感性报告高低不一,单用可能导致恶性肿瘤的漏诊。
因此,本研究旨在探讨免疫标记Gal-3、CK-19、HBME-1和BRAF V600E突变联合检测对细胞学诊断不确定的甲状腺结节的甄别价值,以选择最佳诊断方案,避免重复FNA或不必要的甲状腺切除术。
1 资料与方法
1.1 临床资料
选取四川大学华西医院2014年12月至2019年3月所有术前细胞学诊断不确定甲状腺结节患者992例为研究对象,其中行Gal-3、CK-19、HBME-1免疫标记和/或BRAF V600E突变辅助检测患者314例为观察组,选择因患者考虑检查费用或甲状腺外科医生综合判断直接行手术治疗等各种因素而未应用辅助技术的患者678例作为对照组,并以术后病理诊断评估单独或联合应用辅助技术的诊断价值。所有甲状腺FNA检查均经甲状腺专家评估,发现可疑超声征象的结节均行FNA检查。FNA均在超声引导下用22号针吸取,现场常规涂片两张,并立即用95%乙醇进行湿固定后行巴氏染色。制作常规涂片后针管内剩余标本用福尔马林冲洗,然后离心(1 500 r/min,离心5 min,离心半径13.5 cm),用绸布包裹沉淀物后按组织学标准流程制作细胞蜡块,并制作HE染色玻片一张。所有玻片均由2名经验丰富的细胞病理学专家根据Bethesda系统[13]进行讨论并分类。
1.2 免疫细胞化学
免疫细胞化学均使用制备的细胞蜡块,Gal-3和HBME-1在罗氏全自动免疫组化仪(型号BenchMark ULTRA,美国)上进行免疫细胞化学染色,CK-19采用En Vision二步法手工染色。CK-19(RCK108;1∶100),Gal-3(9C4;1∶100)均为北京中杉金桥生物科技有限公司产品,HBME-1(1∶100)为福州迈新生物技术开发有限公司产品,严格按照说明书进行免疫细胞化学染色。细胞蜡块中超过50%的细胞胞质呈棕黄色时,该免疫标记被认定为阳性。
1.3 BRAF V600E基因检测
BRAF V600E突变检测均使用制备的细胞蜡块,将标本加入DNA提取试剂盒(FFPE组织样品基因组DNA一步式提取试剂盒),选用厦门恺硕生物公司核酸提取纯化试剂,严格按照操作说明书使用该公司全自动核酸纯化仪HF48提取样本中的人类基因组DNA。经聚合酶链式反应(polymerase chain reaction, PCR)扩增BRAF基因15号外显子的片段(扩增方法为ADx-ARMS方法,扩增试剂选用厦门艾德生物公司的人类BRAF V600E突变检测试剂盒,荧光PCR法),最后根据说明书分析所得结果,并统计出BRAF V600E的突变情况。
1.4 统计学方法
采用SPSS 22.0软件进行统计分析,计算Gal-3、CK-19、HBME-1和BRAF V600E突变的敏感性、特异性、阳性预测值(postive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和诊断准确性。通过计算单个标志物或联合标志物的ROC曲线下面积(area under the curve,AUC)来描述诊断性能。定性资料以例数(%)表示,采用χ2检验或Fisher确切检验比较,相关性分析采用Pearson分析,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 两组术后恶性率比较
观察组Bethesda各类别的恶性率均高于对照组,观察组91.1%的细胞学诊断不确定的结节术后证实为恶性结节,高于对照组(P<0.05)(表1)。
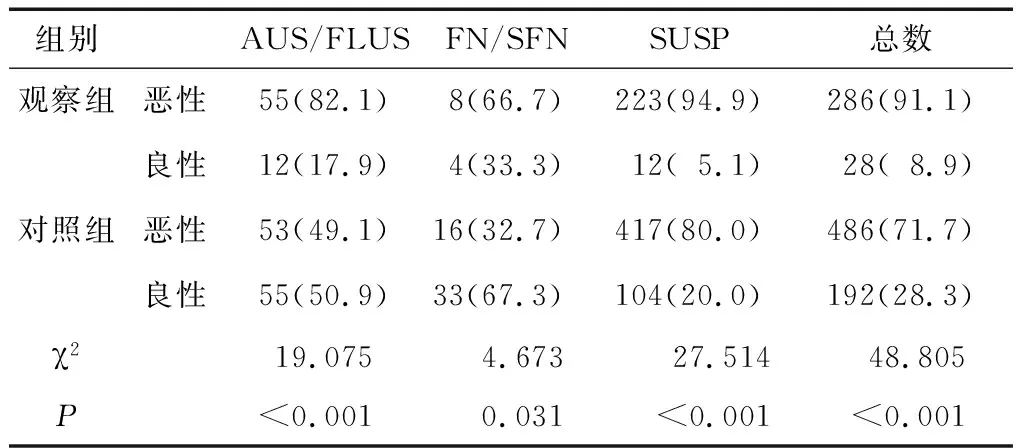
表1 两组术后恶性率比较[(n)%]
2.2 单个或联合标记物的诊断价值
314例观察组病例中有195例(62.1%)进行了Gal-3、CK-19和HBME-1免疫细胞化学检查,301例(95.9%)进行了BRAF V600E突变检测,182个(58.0%)结节同时检测3种免疫标志物和BRAF V600E突变状态(表2)。BRAF V600E的ROC曲线下面积(AUC=0.828)大于任何其他单项标志物,同时BRAF V600E检测具有最好的特异性和PPV(均为100%)。在301个做了BRAF V600E突变检测的结节中,179个(59.5%)BRAF V600E阳性,术后均为恶性结节。CK-19是最敏感、最准确的标记物,对181个恶性结节中的164个(90.6%)结节和14个良性病变中的8个(57.1%)结节进行了正确预测,总体诊断准确率为88.2%。Gal-3的敏感性和特异性约80.0%。免疫细胞化学标记及BRAF V600E突变在FNA细胞学诊断不确定的病例中的表达(图1)。
当辅助生物标记物联合使用时,总体诊断效率和准确性明显提高,所有组合敏感度都高于90.0%。当4种诊断指标联合使用时,敏感度可达96.4%。BRAF V600E突变检测联合Gal-3检测特异性达85.7%。在联合分析中,AUC也明显增加,当BRAFV600E突变检测、CK-19和Gal-3联合使用时,AUC达到最大值(0.925),这样的组合也显示出最高的NPV(53.3%)和诊断准确率(92.9%)。
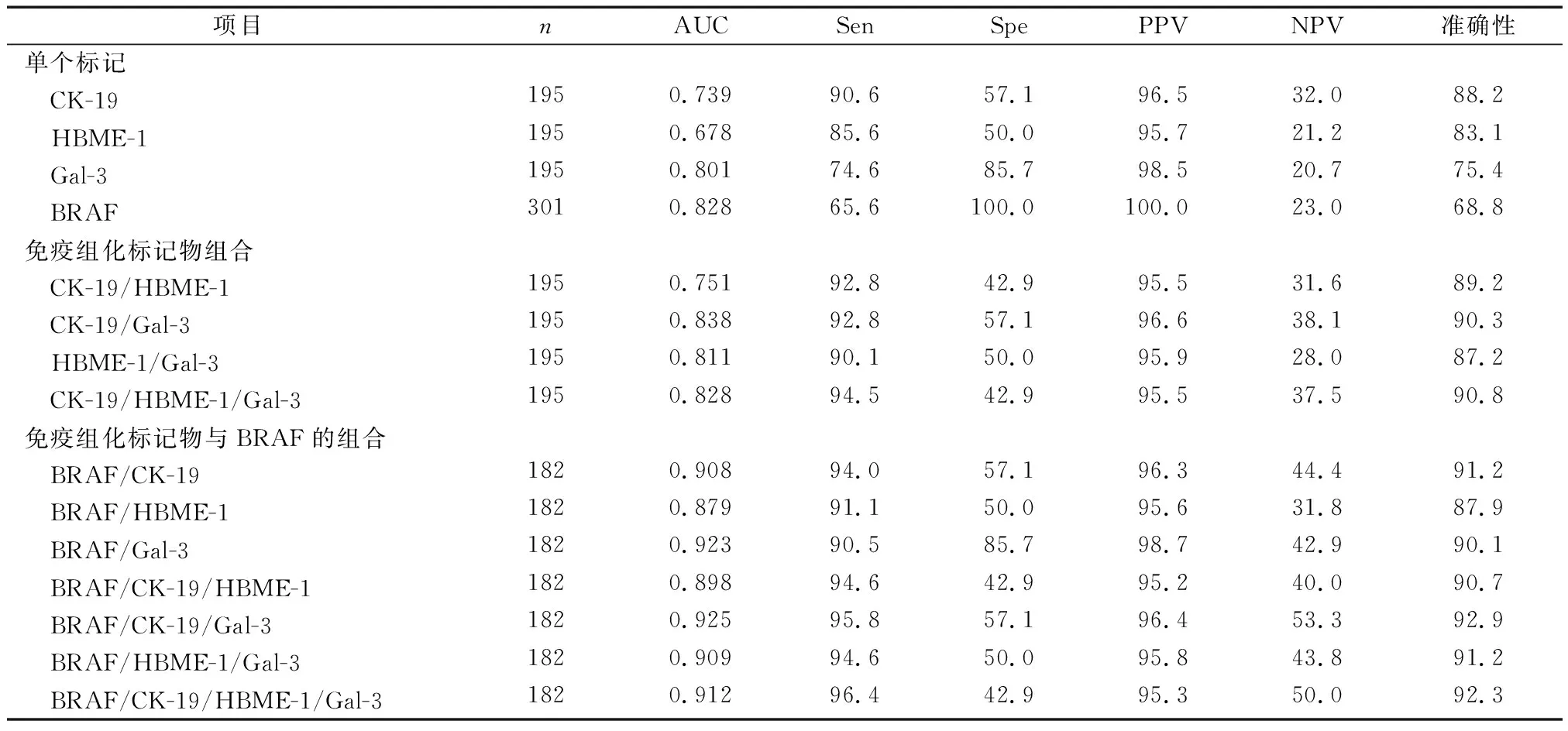
表2 单个或联合标记物在鉴别细胞学诊断不确定结节中的诊断价值(%)
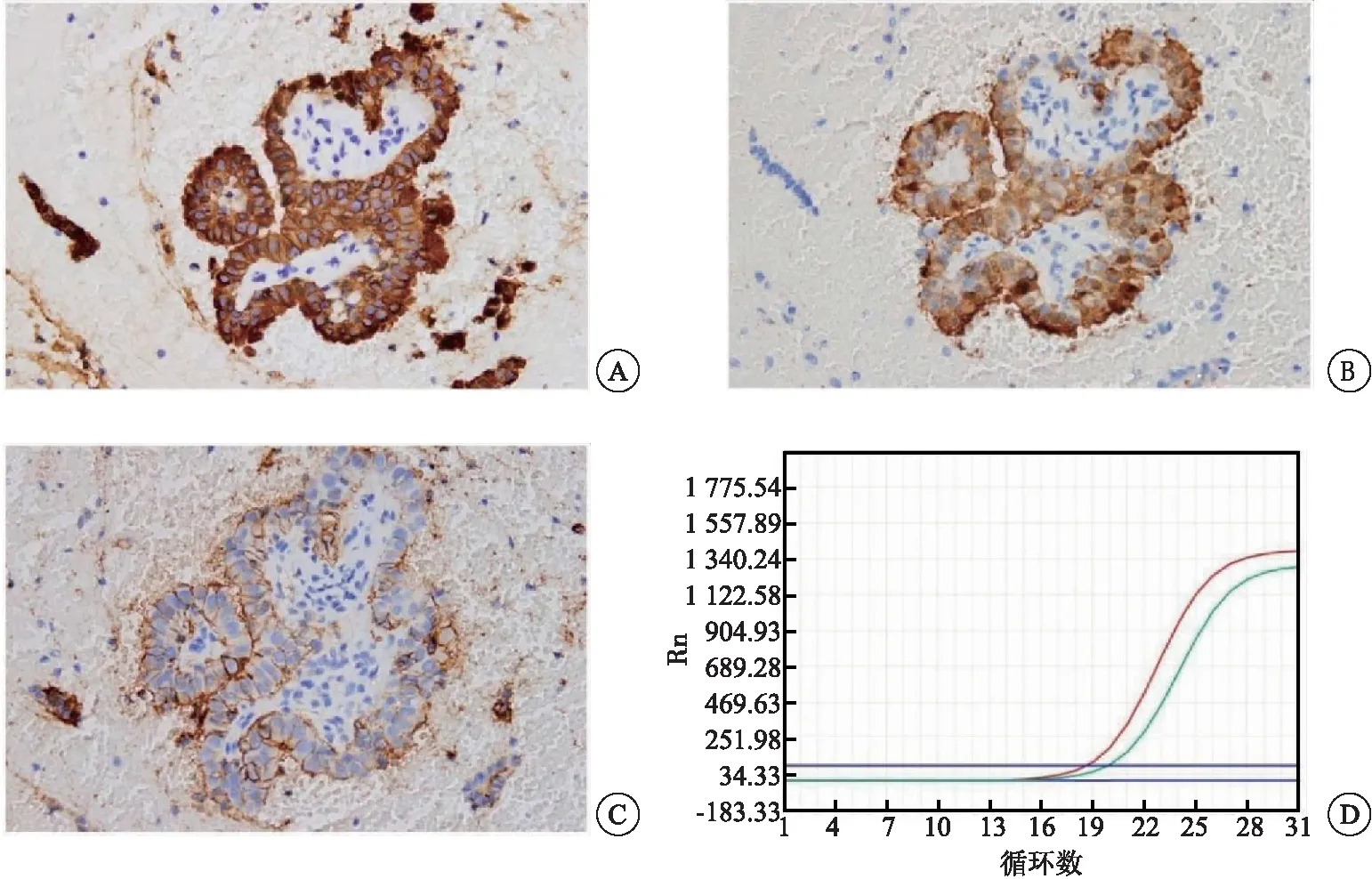
图1 细胞学诊断不确定的病例中免疫细胞化学标记及BRAF V600E突变的阳性表达
2.3 CK-19、Gal-3和BRAF V600E突变联合检测的诊断价值
对182例细胞学诊断不确定的结节进行了BRAF V600E突变检测、CK-19和Gal-3检测,其中58例为AUS/FLUS,7例为FN/SFN,117例为SUSP(图2)。在58例AUS/FLUS结节中,检出BRAF V600E突变35例(60.3%);在另外23个BRAF V600E基因阴性的结节中,CK-19和Gal-3联合检测可正确鉴别14/17个恶性肿瘤和13/16个良性病变。7个FN/SFN结节中只有1个BRAF V600E阳性,另2个结节Gal-3阳性,经病理证实为恶性结节,4个CK-19和Gal-3共同阴性结节中,2个为良性结节。117个SUSP结节中BRAF V600E阳性86个(73.5%),在31例BRAF V600E基因阴性的病例中,CK-19和Gal-3对26例恶性肿瘤和5例良性病变的诊断准确率分别为92.3%(24/26)和60%(3/5)。总体而言,BRAF V600E突变确定了168例恶性肿瘤中的122例(72.6%),在无BRAF V600E突变的46个恶性结节中,CK-19和/或Gal-3阳性确定了39例为恶性肿瘤,敏感性达95.8%。168例恶性肿瘤中漏诊7例,包括甲状腺髓样癌(medullary thyroid carcinoma,MTC)5例,甲状腺滤泡癌(follicular thyroid carcinoma,FTC)1例和PTC 1例。值得注意的是,159例PTC中有158例在术前被正确分类。BRAF V600E突变、CK-19、Gal-3 3项阴性可在14例良性病变中检出8例(57.1%)。
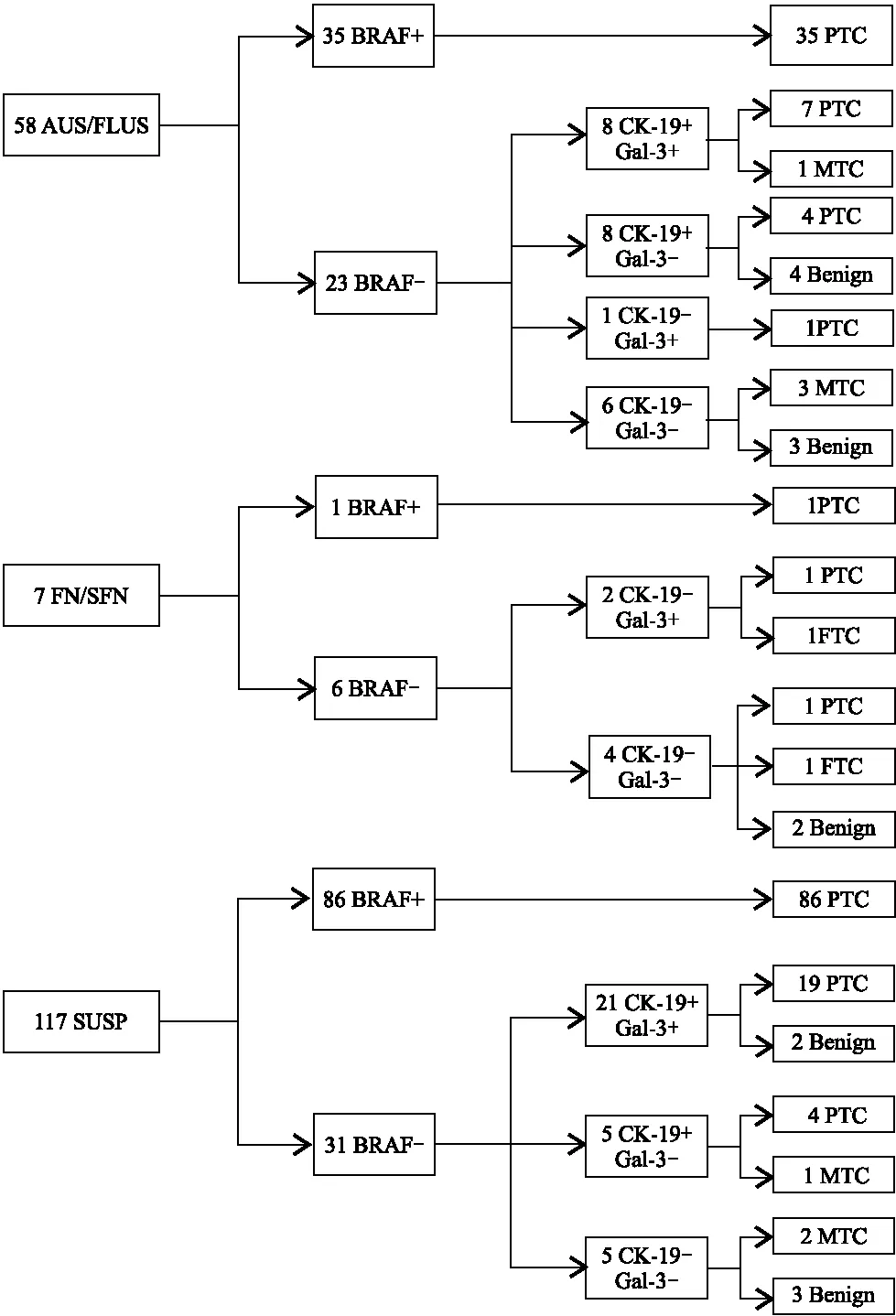
图2 联合分析BRAF V600E突变、CK-19、Gal-3在细胞学诊断不确定甲状腺结节分流中的作用
3 讨论
本研究首次尝试结合Gal-3、CK-19、HBME-1和BRAF V600E突变以前瞻性地鉴别细胞学诊断不确定的甲状腺结节。本研究发现,辅助性生物标记物特别是作为一个组合联用对术前诊断很有价值。BRAF V600E突变、CK-19和Gal-3联合检测在预测恶性肿瘤,特别是PTC方面表现突出。术前95.8%的恶性肿瘤和57.1%的良性病变得到了正确分类。因此,这3个标记物可在临床工作中常规联合使用,以筛选出手术切除的候选者。值得注意的是,观察组的恶性肿瘤发生率明显高于对照组,这意味着BRAF V600E和免疫细胞化学标记物的联合分析在减少不必要的手术方面表现良好。
本研究评估了单独或联合标记物对314例观察组结节的诊断价值。BRAF V600E突变检测具有100%的特异性和PPV,与研究[14-15]结果一致。有研究[16]报道,CK-19是筛查甲状腺癌,尤其是PTC的较敏感的免疫细胞化学标志物之一。Barut等[17]报道,CK-19在甲状腺恶性病变中的弥漫性表达率为76.9%。研究[18]发现,CK-19在92.7%的PTC病例中表达,本研究得到了类似结果,CK-19的敏感性最高(90.6%)。已有研究[6, 19-20]证明,Gal-3是诊断不确定病变的有用标记,Gal-3的AUC值(0.801)大于CK-19和HBME-1。
研究[11]显示,在预测甲状腺恶性病变中,CK-19和Gal-3的敏感性和特异性分别为81%和73%,Gal-3的敏感性和特异性分别为82%和81%;HBME-1的敏感性和特异性分别为77%和83%。一项前瞻性多中心研究[6]显示,Gal-3的总体敏感性为78.0%,特异性为93.0%。有研究[21]表明,CK-19和HBME-1的敏感性与之相当甚至更高,但特异性相对较低,这种差异可能和各研究中不同标志物的阳性标准和染色方法不同有关。此外,诊断试验的性能也会受到该细胞学诊断类别中恶性率的影响。本研究中较高的恶性率(AUS/FLUS、FN/SFN和SUSP分别为61.7%、39.3%和84.7%)导致了相对较低的NPV。
联合使用免疫标记和/或BRAF V600E突变与单独使用标记相比,显示出更高的诊断效能。当BRAF V600E突变、CK-19和Gal-3联合使用时,诊断效果最佳。BRAF V600E突变作为丝氨酸苏氨酸激酶,参与丝裂原活化蛋白激酶途径,是PTC中最常见、最特异的基因改变[22-24]。研究[11,16-18,21]表明,CK-19灵敏度高,因此在预测甲状腺恶性肿瘤方面必不可少。Gal-3显示出平衡的敏感性和特异性,联合应用可以弥补彼此的局限性,最大限度地提高诊断准确率。这种联合应用正确检测出95.8%的恶性结节和57.1%的良性病变,总体诊断准确率为92.9%,特别是159个PTC中有158个被该联合使用正确分类。因此,联合检测BRAF V600E突变、CK-19和Gal-3可能对筛选手术切除的候选患者有很大帮助,可以在很大程度上避免不必要的诊断操作。本研究还发现7例MTC中,5例BRAF V600E、CK-19和Gal-3三重阴性,2例FTC中有1例BRAF V600E、CK-19和Gal-3三重阴性,这些标记物对PTC具有特异性,但对MTC和FTC的诊断价值有限,这与研究[25]报告的结果一致。此外,这是一种特别适合于发展中国家的性价比高的组合。
综上所述,BRAF V600E突变、CK-19和Gal-3对区分术前FNA细胞学诊断不确定的甲状腺结节的良恶性有价值。3项指标联合应用可提高诊断准确率,减少重复穿刺率,可为甲状腺切除术选择合适的对象。但本研究为单中心分析,提出的有前景的组合标志物的诊断性能仍需在更多的前瞻性研究中加以验证。

