抗环瓜氨酸肽抗体阳性人群中炎症因子的表达及意义*
许望东,王禹婷,李文钰,唐怀蓉△
1.西南医科大学 公共卫生学院(泸州 646000);2.四川大学华西医院 人力资源部(成都 610041);3.四川大学华西医院 健康管理中心(成都 610041)
类风湿性关节炎(rheumatoid arthritis,RA)是一种复杂的炎症性疾病,以慢性滑膜炎、软骨破坏和骨侵蚀等关节损伤为特征[1-3]。RA病程较长,世界范围内患病率约为0.3%~1%,女性RA患者明显多于男性[1,4]。65岁以上人群中约2.4%患有RA,且RA患病率随年龄增长而增加[5]。RA患者预后较差,因此早期诊断、早期治疗被认为是改善或控制病情的关键节点。早期诊断RA可有效减少患者的关节破坏,延缓病理进展[5]。抗环瓜氨酸肽(anti-cyclic citrullinated peptide,anti-CCP)是抗瓜氨酸蛋白抗体(anti-citrullinated protein antibodies,ACPAs)家族中最重要的成员[6]。有研究[3,5]表明,anti-CCP抗体阳性对成年RA进行性放射损伤的早期诊断和预后具有重要意义,其灵敏度为65%~80%,特异度为89%~100%。Anti-CCP抗体滴度已被证实是RA患者骨侵蚀和破坏的预测因子之一[7]。Anti-CCP抗体也表达于其他风湿性疾病患者中,研究[8]发现,约10.6%银屑病性关节炎患者和20.9%未分化风湿病患者中也检测到anti-CCP抗体阳性。
白细胞介素-1(interleukin-1,IL-1)家族在介导免疫应答中发挥着重要作用。目前IL-1家族中已发现11种在结构和功能上不同的细胞因子[9],包括7种激动剂(IL-1α、IL-1β、IL-18、IL-33和IL-36α/β/γ)和4种拮抗剂(IL-1Ra、IL-36Ra、IL-37和IL-38)[10]。IL-1家族细胞因子及其受体间的相互作用可以影响先天免疫和适应性免疫[11]。已有研究[12-14]提示,IL-37和IL-38是抗炎细胞因子,具有相似的抗炎功能,在RA患者滑膜中的表达水平升高,且与患者疾病活动度相关。IL-36是新发现的促炎细胞因子,由3个生物学功能相似的分子(IL-36α、IL-36β、IL-36γ)组成。IL-36α、IL-36β和IL-36γ在银屑病患者皮肤中高度表达,与银屑病发生发展密切相关,但IL-36在RA患者中的表达和作用目前还存在争议[10]。虽然IL-36、IL-37和IL-38这3个炎症因子与RA发病有关,但目前尚无关于anti-CCP抗体阳性人群炎症因子(IL-36、IL-37和IL-38)表达情况及这3个炎症因子与临床实验室特征间的相关性研究。本研究旨在进一步了解RA的发生发展,尤其为揭示炎症因子(IL-36、IL-37、IL-38)在临床前RA或anti-CCP抗体阳性人群进展为RA中的作用机制,提供前期研究基础。
1 资料与方法
1.1 临床实验室资料
选取2020年1-10月在四川大学华西医院健康管理中心体检的28例anti-CCP抗体阳性人群为试验组;同时纳入于泸州市江阳区疾病预防控制中心体检的32例anti-CCP抗体阴性人群作为对照组。纳入标准:1)身体健康,精神状态良好,无威胁生命安全的重大疾病;2)体检资料齐全且无误;3)依从性好。排除标准:1)已患有自身免疫性疾病;2)体检资料不全或有误;3)合并有肿瘤、艾滋病或其他严重并发症;4)依从性差。受试者均自愿参加本研究并签署知情同意书,本研究经四川大学华西医院伦理委员会批准。试验组男16例,女12例,年龄(51.29±2.13)岁。对照组男15例,女17例,年龄(50.75±1.75)岁。两组年龄和性别比较,差异无统计学意义(P=0.845,P=0.427),具有可比性。试验组临床实验室资料:白蛋白(46.70±0.50) g/L、球蛋白(28.52±0.83 )g/L、白蛋白/球蛋白(1.68±0.06)、肌酸酐(68.07±2.89)μmoI/L、尿酸305.50(264.75,363.00) μmoI/L、葡萄糖5.04(4.76,5.41) mmol/L、甘油三酯1.31(1.01,2.11) mmol/L、胆固醇4.95(4.13,5.62) mmol/L、高密度脂蛋白(1.37±0.05)mmol/L和低密度脂蛋白2.80(2.58,3.86) mmol/L。
1.2 材料与方法
目前国内外多项研究[10,12-13,15-16]采用酶联免疫吸附试验(ELISA)检测IL-36、IL-37和IL-38在RA、骨关节炎、系统性红斑狼疮等疾病中的表达水平,本研究也选择ELISA检测两组人群血清中IL-36、IL-37和IL-38的表达水平。采血管采集两组血液样本(约5 mL/管),置于水平离心机内离心(5 000 r/min,离心半径20 cm)10 min后,移液枪吸取血清,分装冻存备用。采用武汉华美生物工程有限公司的ELISA试剂盒检测两组血清中IL-36、IL-37和IL-38浓度。检测步骤按照该试剂盒内的操作方案进行:将血清样品提前从-80 ℃冰箱取出,溶解后吸取适量体积血清加入96孔板中,置于37 ℃孵箱中孵育2 h后,再依次向96孔板内加入生物素抗体、辣根过氧化物酶(horse radish peroxidase,HRP)亲和素、四甲基联苯胺(tetramethylbenzidine,TMB)底物和终止液,最后用酶标仪检测样品中IL-36、IL-37和IL-38的浓度。
1.3 统计学方法
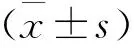
2 结果
2.1 两组血清IL-36、IL-37和IL-38表达水平比较
两组血清IL-36和IL-38表达水平比较,差异有统计学意义(P<0.05);且试验组IL-36、IL-38表达水平均高于对照组(P<0.05)(表1)。
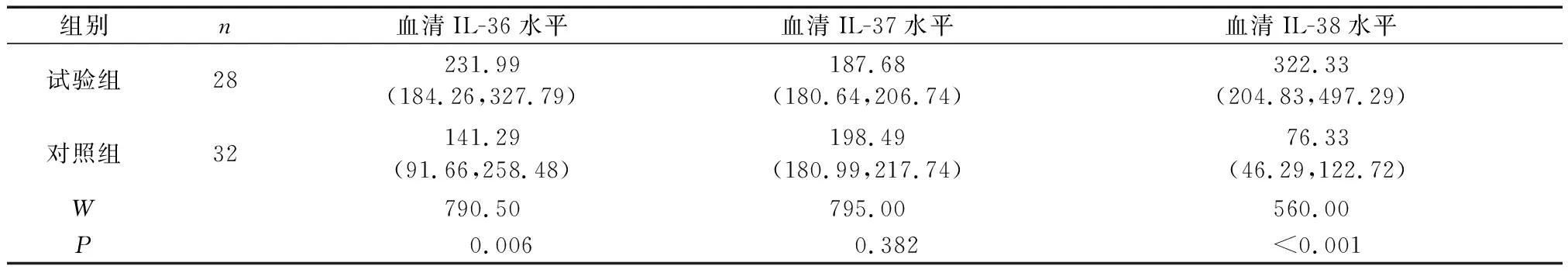
表1 两组血清IL-36、IL-37和IL-38表达水平比较[ng/L,M(P25,P75)]
2.2 试验组IL-36、IL-37和IL-38水平与临床实验室指标间的相关性
试验组血清中IL-38水平与尿酸指标呈正相关(r/rs=0.415,P=0.028);IL-38水平与其他临床实验室指标间的相关性分析,差异无统计学意义(P>0.05)。试验组IL-36和IL-37水平与白蛋白、球蛋白、白蛋白/球蛋白、肌酸酐、尿酸、葡萄糖、甘油三酯、胆固醇、高密度脂蛋白和低密度脂蛋白间相关性分析,差异无统计学意义(P>0.05)(表2)。
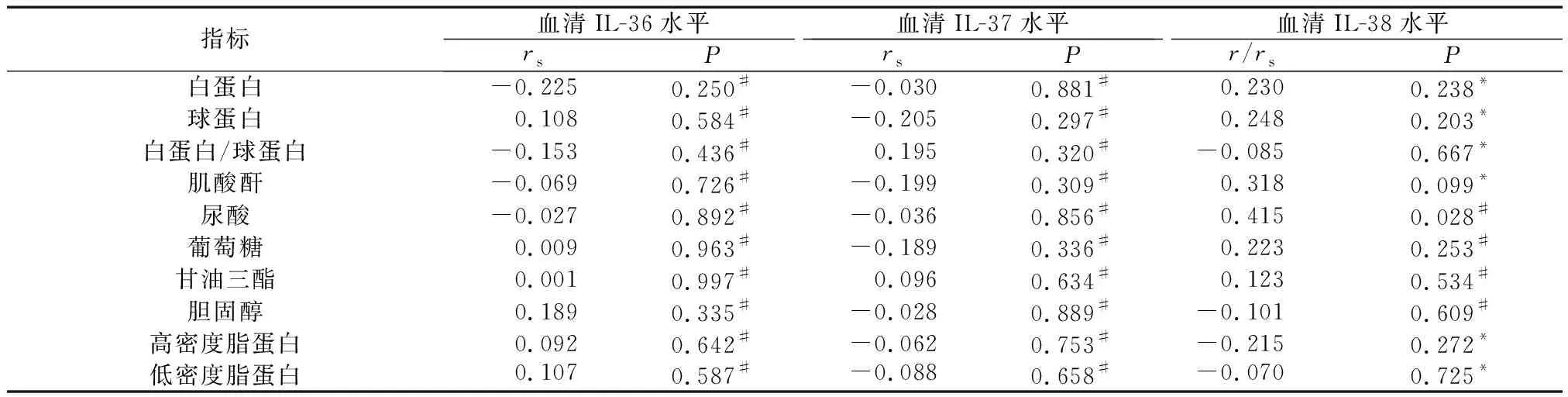
表2 Anti-CCP抗体阳性人群血清中IL-36、IL-37、IL-38水平与各项指标的相关性分析
3 讨论
目前RA的防治目标包括疾病的早期诊断、缓解或降低疾病活动度[17]。RA通过早期治疗可预防关节损伤和改善预后[6],因此该病的早期诊断具有重要意义。Anti-CCP抗体对RA具有高特异性,可用于鉴别其他可能与RA相混淆的侵蚀性和类风湿因子阳性的关节炎[6]。Anti-CCP抗体阳性RA患者的关节破坏进程更快且疾病活动度更高,因此高表达水平的anti-CCP抗体又被认为是RA疾病进展的不良预后因素[17]。有研究[6]发现,anti-CCP抗体可在RA疾病首发症状出现前14年的血清样本中检测到。因此,anti-CCP抗体阳性对于筛查早期和临床前RA具有重要意义。
IL-36在上皮细胞和免疫细胞中可表达[11]。IL-36通过激活树突状细胞增强辅助性T细胞17(Th17)反应。IL-17上调IL-36的表达,形成一个自扩增环[11]。IL-36信号通路通过激活IL-23/IL-17轴而促进Th17的分化[18]。当IL-36信号通路在生理循环中表达异常,如皮肤中高表达,可能与自身免疫性炎症的发生有关[11]。有研究[10]表明,IL-36α在银屑病性关节炎和RA患者的滑膜液中表达水平上调,且高表达的IL-36α可促进成纤维细胞产生IL-6和IL-8。本研究发现,血清中IL-36水平在anti-CCP抗体阳性人群中明显高于anti-CCP抗体阴性人群,提示anti-CCP抗体阳性人群机体内可能存在炎症增加的状况。
IL-37是一种新发现的具有抗炎作用的天然免疫反应抑制剂。IL-37的分子量约为17~25 kD,包括5种剪接变异体(IL-37α-e)[13]。IL-37可在骨髓、巨噬细胞、NK细胞、B细胞等组织和免疫细胞中表达。IL-37在RA和强直性脊柱炎等自身免疫性疾病中表达异常[13-14]。有研究[13]发现,IL-37作用于关节炎小鼠后,小鼠关节炎症状减轻,且IL-37作用于Th17细胞后可导致IL-17、IL-1、IL-6分泌减少,Th17细胞增殖率降低,提示IL-37可能抑制RA的发病。肿瘤坏死因子α(TNF-α)是导致RA发病的重要因素,随着炎症反应和促炎细胞因子TNF-α的增加,IL-37的表达水平也随之增加。RA患者血清中IL-37水平升高,且IL-37水平与促炎细胞因子(IL-17A、TNF-α)、RA疾病活动性指数[C反应蛋白、28关节疾病活动度评分(DAS28)]密切相关[14]。但本研究中未观察到IL-37在anti-CCP抗体阳性人群中异常升高。
IL-38在2001年被鉴定为IL-1家族配体的一员。人IL-38基因位于染色体2q13-14.1。IL-38可在心脏、胎盘、脾脏和胸腺等组织器官中表达。IL-38与IL-1Ra、IL-36Ra的同源性分别为41%和43%。与健康对照组相比,RA患者滑膜和血清中IL-38水平升高[19]。IL-38可与IL-36R结合,抑制3种激动剂配体IL-36α、IL-36β和IL-36γ的信号传导而发挥抗炎作用[12]。IL-38也可与孤儿受体IL-1RAPL1结合,在炎症环境中抑制炎症性细胞因子的产生[19]。例如,脂多糖(LPS)处理后的巨噬细胞及IL-1β刺激的RA滑膜细胞可产生多种炎症细胞因子,但再加入IL-38后,炎症因子分泌减少[19]。尿酸、脂质和同型半胱氨酸等代谢性指标的波动变化与机体自身免疫耐受相关[20]。尿酸是人体嘌呤代谢的终产物。高尿酸血症是一种以血液中尿酸水平异常升高为特征的疾病,提示脂质功能障碍,被认为是肾脏疾病的独立危险因素[20-21]。尿酸对肾脏的损害与肾小管、血管收缩、氧化应激和炎症有关[21]。由于炎症的触发,细胞因子和其他免疫激活途径对脂代谢、尿酸的循环和代谢存在影响[20]。胆固醇和尿酸水平的变化被认为是细胞更新并伴有死亡的标志[20]。此外,尿酸水平也可能作为侵袭性自身免疫性疾病的指标。血清中尿酸水平在自身免疫性疾病中的表达有所不同,通常在RA中表达较低,而系统性红斑狼疮患者体内尿酸水平升高且与严重的临床表现(如肺动脉高压和肾脏受累)有关[20]。本研究发现,血清中IL-38水平在anti-CCP抗体阳性人群中明显高于anti-CCP抗体阴性人群,且anti-CCP抗体阳性人群中的IL-38水平与尿酸含量呈正相关。但anti-CCP抗体阳性人群的尿酸为305.50(264.75,363.00)μmol/L,意味着该人群尿酸并无明显异常(与高尿酸血症的诊断相比较)。
本研究结果发现,炎症因子IL-36和IL-38在anti-CCP抗体阳性人群中表达水平高于anti-CCP抗体阴性的人群,且试验组高于对照组(P<0.05)。IL-37表达在两组间比较,差异无统计学意义(P>0.05)。本研究存在的局限性:1)本研究样本量过小,可能导致难以观察到两组人群中IL-37水平的表达差异,因此需要扩大样本量进一步探讨血清中IL-37水平在anti-CCP抗体阳性人群中的表达。2)入组人群用于分析的临床实验室指标与免疫相关的指标较少,今后的研究需要纳入更多与免疫相关的指标。3)缺乏随访研究相关资料,需要进一步对anti-CCP抗体阳性人群开展随访研究,直至发展为RA。4)缺乏功能性研究,需要在今后的小动物模型等功能性研究中探讨IL-36和IL-38可能通过哪些机制导致anti-CCP抗体阳性,并在动物模型中进一步探讨异常升高的IL-38表达水平是否会导致尿酸异常,通过什么途径导致尿酸异常,以更好揭示上述炎症因子导致anti-CCP抗体阳性及参与RA发生发展的机制。
综上所述,本研究发现,炎症因子IL-36和IL-38在anti-CCP抗体阳性人群中高表达,与部分临床实验室指标相关,提示可能与anti-CCP抗体阳性人群发展为RA有关。

