微小染色体维持蛋白5在斑马鱼脑发育中的作用及机制研究*
吴永梅,黄四洲,苏炳银△
1.成都医学院 组织学与胚胎学教研室(成都 610500);2.发育与再生四川省重点实验室(成都 610500)
微小染色体维持蛋白5(minichromosome maintenance protein 5,MCM5)是微小染色体维持蛋白家族的成员,在真核生物中高度保守[1]。在细胞周期中,mcm2、mcm3、mcm4、mcm5、mcm6和mcm7形成双六聚体并参与启动DNA复制过程[2-3]。mcm5的表达量明显比DNA复制所需数量多,表明mcm5在胚胎发育过程中还参与其他功能[4]。在斑马鱼胚胎的体节发生中期,mcm5表达广泛,在尾巴的整个生长过程中持续表达。到受精后48 h,mcm5表达主要在中脑-后脑边界、大脑苍白球和后脑增殖区。到受精后3 d,mcm5表达进一步细化,包括视网膜睫状边缘区、顶盖增殖区、鳃弓和各内胚层组织[3]。mcm5在脑中高度表达,表明mcm5可能在脑的发育中起关键作用,但其具体的作用区域及作用机制目前尚不清楚。
Hippo信号通路在调控多细胞生物器官大小中发挥着重要作用。Hippo信号通路在果蝇遗传筛选中被发现,HPO、SAV、WTS、MATS、YKI和SD是其主要成员,在哺乳动物中的同源蛋白分别是MST1/2、SAV1、LATS1/2、MOB1、YAP/TAZ和TEAD1-4。当Hippo信号通路处于活化状态时,MST1/2可与SAV1相互结合并形成复合物,该复合物进一步磷酸化形成LATS1/2/MOB1复合物。活化的LATS1/2可磷酸化转录激活因子YAP/TAZ的特定氨基酸残基,导致其活性被抑制,使其滞留在细胞质中被泛素化降解,从而阻碍下游靶基因的表达。当Hippo信号关闭时,YAP的抑制被解除,使其处于激活状态,可进入细胞核内,与转录因子TEAD结合,诱导增殖相关基因的表达[5]。Hippo信号通路可调节果蝇的神经母细胞和脑的大小[6],还可影响神经细胞的分化和增殖[7-9]。因此,本研究旨在探讨mcm5对斑马鱼脑发育的作用是否是通过Hippo信号通路介导。
1 材料与方法
1.1 实验动物
本实验使用野生型(WT)斑马鱼,养殖系统为北京爱森公司净水系统。饲养条件:温度28.5 ℃~29.5 ℃,盐度0.03%~0.04%,pH值7.2~7.6;光照/黑夜时间14 h∶10 h。于20∶00选取性成熟的斑马鱼,1∶1雌雄配对,次日8∶00给予光照,斑马鱼自然产卵,收集受精卵,剔除死胚。
1.2 实验分组
将90枚斑马鱼胚胎分为3组:1)对照组[CONT组,注射无意义的吗啉基寡核苷酸(morpholino,MO)];2)mcm5 MO组(注射mcm5特异的MO);3)mcm5 MO+mcm5 mRNA组(同时注射mcm5特异的MO和mcm5 mRNA),每组30枚,28.5 ℃培养箱中培养,每隔12 h观察胚胎并拍照记录。当胚胎发育到24 h时,加入0.296 mmol/L的1-苯基-2-硫脲(PTU)[10],去除黑色素,取不同时间点胚胎进行实验。
1.3 主要试剂及仪器
1.3.1 主要仪器 FV-1000激光共聚焦显微镜和SZX16体视荧光显微镜购自日本Olympus公司。ChemiDoc XRS+购自英国Bio-Rad公司。
1.3.2 主要试剂mcm5 MO购自美国Gene Tools公司;PTU购自美国Sigma公司;PVDF膜购自美国Millipore公司;GAPDH和mcm5一抗购自英国Abcam公司;羊抗兔IgG二抗购自英国Abcam公司;化学发光试剂购自英国Bio-Rad公司;PH3一抗购自美国GeneTex公司;山羊抗兔的IgG Alexa Fluor 568购自美国Life Technology公司;TRIzol试剂购自美国Invitrogen公司;反转录和qPCR试剂购自南京Vazyme公司。
1.4 方法
1.4.1 斑马鱼胚胎发育观察 当胚胎发育到受精后13、33 h,使用体视荧光显微镜观察斑马鱼胚胎并拍照;当发育到受精后2 d,收集斑马鱼胚胎进行同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)、蛋白质印迹技术、荧光定量PCR(qPCR)等实验。
1.4.2mcm5 MO和mcm5 mRNA显微注射 参考Huang等[11]实验方法,CONT组注射标准阴性对照MO(5′-CCTCTTACCTCATTACAATTTATA-3′ 300 μmol/L),mcm5 MO组注射特异的mcm5 MO(5′-ATAGTTTC GATAAGTGCTGTCGATG-3′,300 μmol/L)。mcm5 mRNA(含有mcm5表达序列的质粒由成都医学院黄四洲教授馈赠)在体外通过试剂盒逆转录得到,可在体内表达MCM5蛋白。
1.4.3 iTRAQ蛋白质组分析 选取发育到受精后2 d CONT组和mcm5 MO组的斑马鱼胚胎送至牟合(上海)生物技术公司,使用iTRAQ技术进行蛋白质组鉴定,实验重复进行3次,数据处理由公司技术人员完成。
1.4.4 蛋白质印迹技术检测 收集3组受精后2 d的斑马鱼胚胎提取总蛋白。蛋白质样品通过SDS-PAGE电泳并转移到PVDF膜,用含0.1% Tween-20和5%牛血清白蛋白的Tris缓冲液封闭后,用GAPDH(1∶5 000)和MCM5(1∶1 000)单克隆抗体在4 ℃下过夜。与辣根过氧化物酶偶联的IgG二抗(1∶2 000)在室温下孵育2 h,通过化学发光法检测蛋白质含量。
1.4.5 免疫荧光染色检测 将3组胚胎放入4%多聚甲醛中,在4 ℃下固定过夜。样品在室温下用含0.1% Tween-20的PBS中洗涤3次,5 min/次,然后用PBS、1.5% Triton-100和4%山羊血清配制的缓冲液在4 ℃下预孵育2 h。一抗使用兔抗PH3(1∶100),二抗使用山羊抗兔的IgG Alexa Fluor 568(1∶2 000)在4 ℃下过夜孵育。免疫荧光样品用80%甘油固定,并在共聚焦显微镜下使用红色二极管激光器(568 nm)进行检查,用相同的参数扫描所有样品。实验重复3次,随机选取每组中的12个样本进行成像,使用共聚焦显微镜成像软件FV1000对阳性细胞进行计数。
1.4.6 qPCR qPCR实验参考文献[12]进行,检测增殖相关基因:cycline、cdk2和cdc25b的表达。TRIzol试剂用于从3组受精后2 d的斑马鱼胚胎头部中提取总RNA。反转录合成cDNA,并使用qPCR SYBR预混液和基因特异性引物进行荧光定量PCR,用作参照基因的是斑马鱼β-actin(表1)。
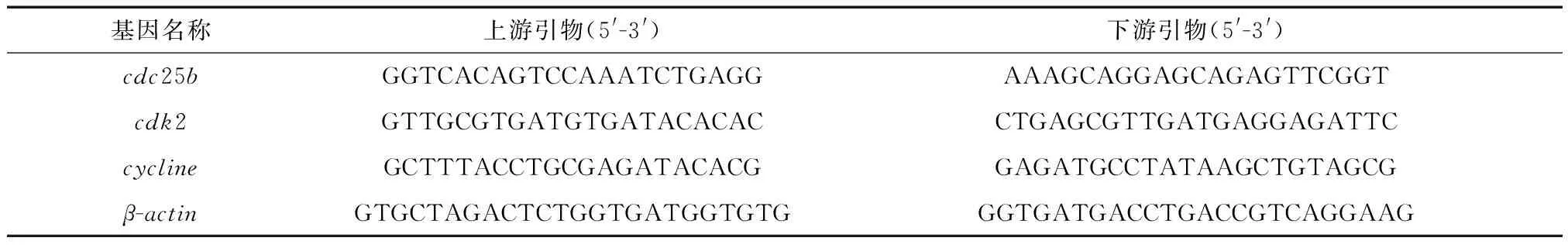
表1 qPCR引物序列
1.5 统计学方法
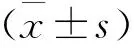
2 结果
2.1 MCM5在3组受精后2 d斑马鱼胚胎中的表达比较
蛋白质印迹技术实验结果显示,mcm5 MO组MCM5蛋白表达量明显降低(图1A);mcm5 mRNA与mcm5 MO共注射后,MCM5蛋白表达量升高(图1B),mcm5 MO能成功敲降mcm5,而mcm5 mRNA能援救该蛋白。

图1 蛋白质印迹技术检测MCM5在受精后2 d斑马鱼胚胎中的表达
2.2 mcm5 MO注射后对斑马鱼头部发育的影响
在胚胎发育早期,CONT组与mcm5 MO组斑马鱼胚胎在外观上无差别;但随着胚胎的发育,斑马鱼整个头部变小。将头部放大观察,与CONT组相比,mcm5 MO组斑马鱼的眼睛、中脑及后脑脑室均明显减小,mcm5 mRNA可回救由mcm5 MO造成的发育缺陷(图2)。

图2 mcm5 MO注射后对斑马鱼头部发育的影响
2.3 iTRAQ检测mcm5表达降低后蛋白质组的变化
使用iTRAQ实验技术一共检测到4 333个蛋白,差异表达的蛋白有277个,其中157个蛋白表达上调,120个蛋白表达下调。通过京都基因与基因组数据库(kyoto encyclopedia of genes and genomes,KEGG)分析发现,差异表达的蛋白主要参与Hippo、Cell-Cycle、PI3K-Akt信号通路,其中参与Hippo信号通路的蛋白数量多且差异大。将Hippo信号通路中变化的蛋白列表,发现所有变化的蛋白皆会导致该信号通路中YAP被滞留在胞质中,影响其下游基因的表达,进一步导致细胞增殖受到影响。同时蛋白质组分析也发现,参与皮层和海马发育的蛋白质表达异常。该蛋白质组结果显示,mcm5敲低后,斑马鱼脑部变小可能是由Hippo信号通路介导的(图3、表2)。
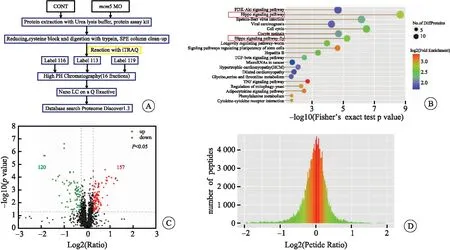
图3 iTRAQ实验结果分析

表2 在iTRAQ数据中mcm5 MO组与CONT组比较差异较大的蛋白质信息
2.4 3组斑马鱼胚胎发育到受精后2 d时脑部细胞的增殖情况
当Hippo信号通路活性被激活时,YAP滞留于胞质中,导致其下游基因表达受到抑制,细胞增殖减少。为验证这一结果,本实验检测了斑马鱼头部细胞的增殖情况。降低mcm5的表达后,当胚胎发育到受精后2 d时,使用PH3抗体检测细胞增殖情况。结果显示,与CONT组相比,mcm5 MO组增殖细胞明显减少,mcm5 mRNA能够援救由mcm5 MO造成的增殖细胞减少(图4)。
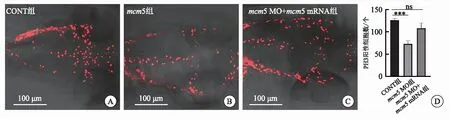
图4 3组斑马鱼胚胎发育到受精后2 d时脑部细胞的增殖情况
2.5 增殖相关基因在3组受精后2 d斑马鱼胚胎中的相对表达量
qPCR实验结果显示,mcm5 MO后,与CONT组相比,cycline、cdk2和cdc25b基因的Ct值均升高,说明基因表达量下降(表3)。qPCR数据采用2-ΔΔCt算法进行基因表达量分析,结果显示,与CONT组相比,mcm5 MO组增殖相关基因表达量下降,差异有统计学意义(P<0.05)(表4)。

表3 3组增殖相关基因qPCR反应的Ct值比较
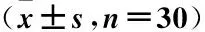
表4 3组增殖相关基因的相对表达量比较
3 讨论
目前,mcm5在细胞周期因子[1]和肿瘤发生[13]中的作用研究较多,而在发育中的作用研究较少。研究[14]发现,敲除mcm5导致98.1%的秀丽隐杆线虫胚胎发育停滞,表明mcm5在胚胎发育中发挥重要作用[14]。与CONT组胚胎比较,mcm5参与体节发生,mcm5 MO组表现出前后轴缩短和眼睛变小[15]。mcm5从21体节期到受精后3 d在斑马鱼胚胎头部中高表达[3]。mcm5功能的丧失使S期延长,导致斑马鱼视网膜细胞增殖减少和细胞凋亡增加[16]。本研究发现,mcm5 MO组斑马鱼头部中脑、后脑脑室、眼睛明显变小,与Ryu等[16]研究结果一致,均表明mcm5参与了脑的发育,进一步阐明了mcm5在胚胎发育中的作用及功能。
目前,关于mcm5缺失导致器官变小的机制尚不清楚。Hippo信号通路的核心成分MST1和MST2在脑内多种细胞中高度表达,包括星形胶质细胞、神经元、少突胶质祖细胞、新形成的少突胶质细胞、髓鞘化少突胶质细胞、小胶质细胞和内皮细胞[17],说明Hippo信号通路在脑中具有重要作用。本研究通过iTRAQ技术,对mcm5敲低后蛋白质组的变化进行检测,发现Hippo信号通路中的蛋白变化差异较大,其中YWHAQB、YWHAQA、YWHAH、YWHABL、YWHAZ、YWHABA、YWHAG1、YWHAE2、YWHAE1、YWHAG2和YWHABB皆表达量增加,且都是14-3-3家族蛋白。而14-3-3家族蛋白在Hippo信号通路中的作用是与YAP结合,将YAP留在细胞质中,使其无法进入细胞核,抑制了YAP的转录活性,导致下游基因无法表达,进而使细胞增殖受到抑制[18]。另外变化的SMAD2和SMAD1蛋白则是与YAP竞争性结合TEAD1来间接抑制YAP的辅转录活性[9]。所以,mcm5敲降后,与Hippo相关的蛋白变化皆是将该信号通路的活性激活。14-3-3是一类丰富的大脑蛋白质,在哺乳动物中有7种同工型,分别是β-β、γ-γ、ζ-zeta、σ-sigma、ε-epsilon、η-eta和τ-tau[19]。14-3-3蛋白通过与其效应蛋白的相互作用参与调节神经元发育、细胞凋亡、细胞增殖以及靶蛋白的亚细胞定位等过程[20-21]。Hippo信号通路可通过调节增殖相关基因的表达[7]从而影响细胞的增殖,参与器官大小的调节[6]。本研究mcm5表达降低后斑马鱼增殖基因表达降低,细胞增殖减少。以上结果均表明,mcm5是Hippo信号通路的上游调节因子,其对脑部发育的作用是通过Hippo信号通路介导。
综上所述,本研究发现,mcm5在斑马鱼头部发育中具有重要作用,并且Hippo信号通路介导mcm5对脑部发育的调节。因此,mcm5基因可作为Hippo信号通路上游的潜在调节因子,提示mcm5在脑发育和脑疾病的发病机制中也具有重要作用,这或可成为未来研究的新热点。

