动物源性食品中氟喹诺酮类兽药残留检测方法研究进展
段宁馨 邹玉婷 古飞燕 刘功良 赵晓娟
摘 要:氟喹诺酮类药物是一类广泛应用于畜牧疾病防治的化学合成抗菌药,若过量使用会对消费者的身体健康构成威胁,因此建立高效的检测方法对监管动物源性食品中氟喹诺酮类药物残留具有重要意义。本文简述氟喹诺酮类兽药的种类及毒性危害,针对动物源性食品中氟喹诺酮类抗生素残留检验方法的研究进展进行详细阐述,以期为动物源性食品中氟喹诺酮类药物残留监控提供参考。
关键词:氟喹诺酮类;兽药残留;食品;质量安全;检测方法
Recent Progress in Analytical Methods for Detection of Fluoroquinolone Residues in Food of Animal Origin
DUAN Ningxin, ZOU Yuting, GU Feiyan, LIU Gongliang, ZHAO Xiaojuan*
(Guangdong Provincial Key Laboratory of Lingnan Specialty Food Science and Technology, College of Light Industry and
Food Science, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China)
Abstract: Fluoroquinolones, a group of synthetic antibiotics, are widely used in the prevention and control of livestock diseases. If overused, fluoroquinolones will pose a threat to peoples’ health. Therefore, it is of great significance to establish an efficient detection method for monitoring fluoroquinolones residues in animal-derived food. In this paper, we introduce readers to the types and toxicity of fluoroquinolones, and present a detailed review of recent progress in the development of detection methods for fluoroquinolones residues in animal-derived food. It is expected that this review can provide a reference for the monitoring of fluoroquinolones residues in animal-derived food.
Keywords: fluoroquinolones; veterinary drug residues; food; quality and safety; detection methods
DOI:10.7506/rlyj1001-8123-20210618-176
中圖分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2022)01-0056-07
引文格式:
段宁馨, 邹玉婷, 古飞燕, 等. 动物源性食品中氟喹诺酮类兽药残留检测方法研究进展[J]. 肉类研究, 2022, 36(1): 56-62. DOI:10.7506/rlyj1001-8123-20210618-176. http://www.rlyj.net.cn
DUAN Ningxin, ZOU Yuting, GU Feiyan, et al. Recent progress in analytical methods for detection of fluoroquinolone residues in food of animal origin[J]. Meat Research, 2022, 36(1): 56-62. DOI:10.7506/rlyj1001-8123-20210618-176. http://www.rlyj.net.cn
氟喹诺酮类药物也称4-喹诺酮类药物、喹诺酮羧酸类药物[1],因其抗菌谱广、抗菌活性强、生物利用度高、耐药发生率低、在组织中广泛分布等特点,被广泛应用于临床实践和畜牧疾病的防治[2-4]。随着饲养食用动物数量的大量增加,兽药滥用及残留超标问题更为突出。为了保护消费者的身体健康,欧盟和美国食品药品监督管理局规定,动物源性食品中氟喹诺酮类药物的残留量为30~1 900 μg/kg[5-6]。我国GB 31650—2019
《食品安全国家标准 食品中兽药最大残留限量》对动物源性食品中的氟喹诺酮设置了最大残留限量,例如,恩诺沙星在牛肉、羊肉中的最大残留限量为100 μg/kg,达氟沙星在牛肉中的最大残留限量为200 μg/kg,沙拉沙星在鸡肉中的最大残留限量为10 μg/kg,氟喹诺酮在家禽产蛋期禁用。在哺乳期动物饲养中使用氟喹诺酮类药物可能会在生乳中留下残留物。氟喹诺酮类药物的广泛使用和误用具有潜在危险,因为它们的残留物可能会持续存在于可食用动物组织中,并可能导致耐药菌株的发展或过敏。因此,对动物源性食品中氟喹诺酮药物残留量进行检测具有重要意义。
1 氟喹诺酮类药物的分类
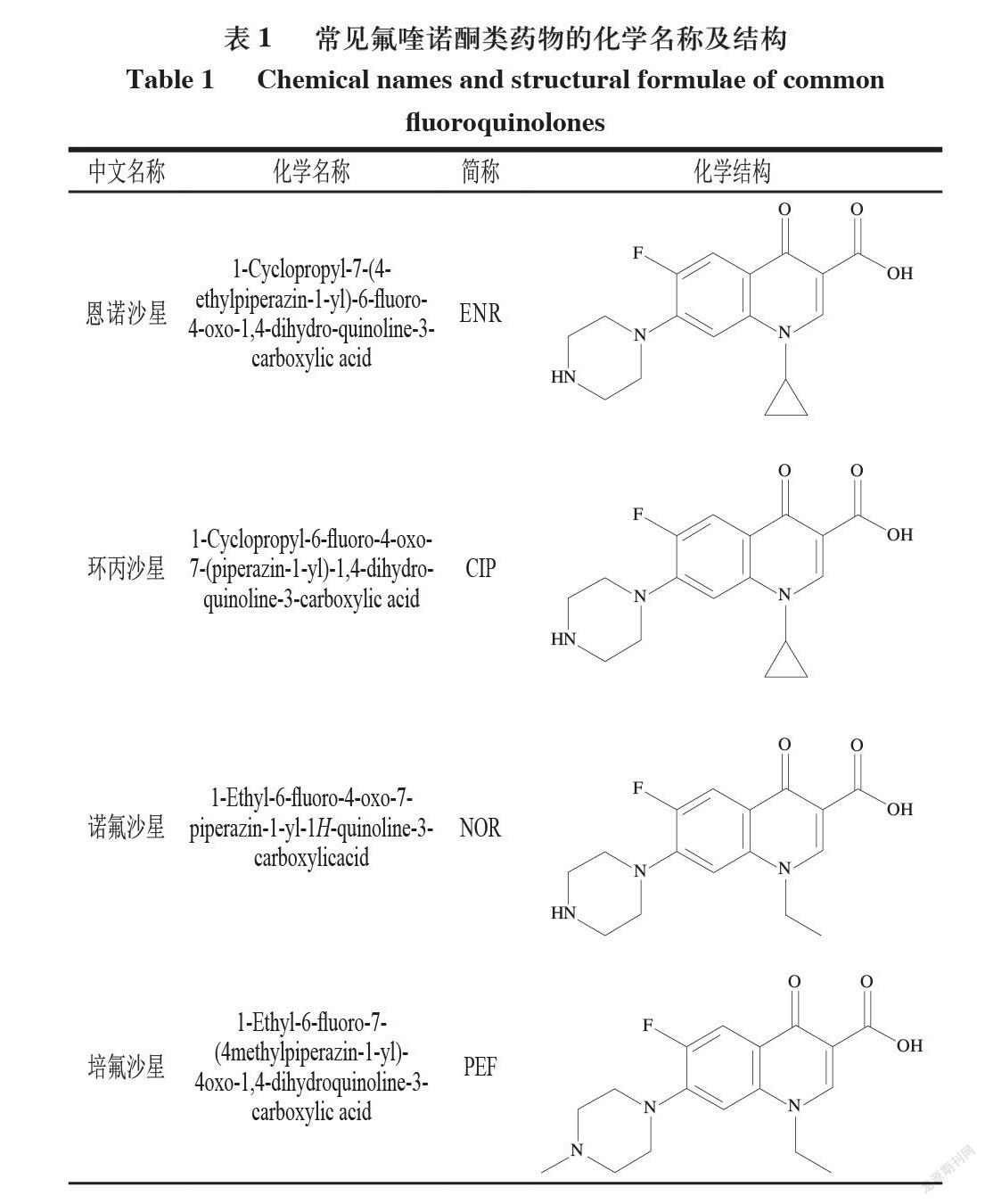
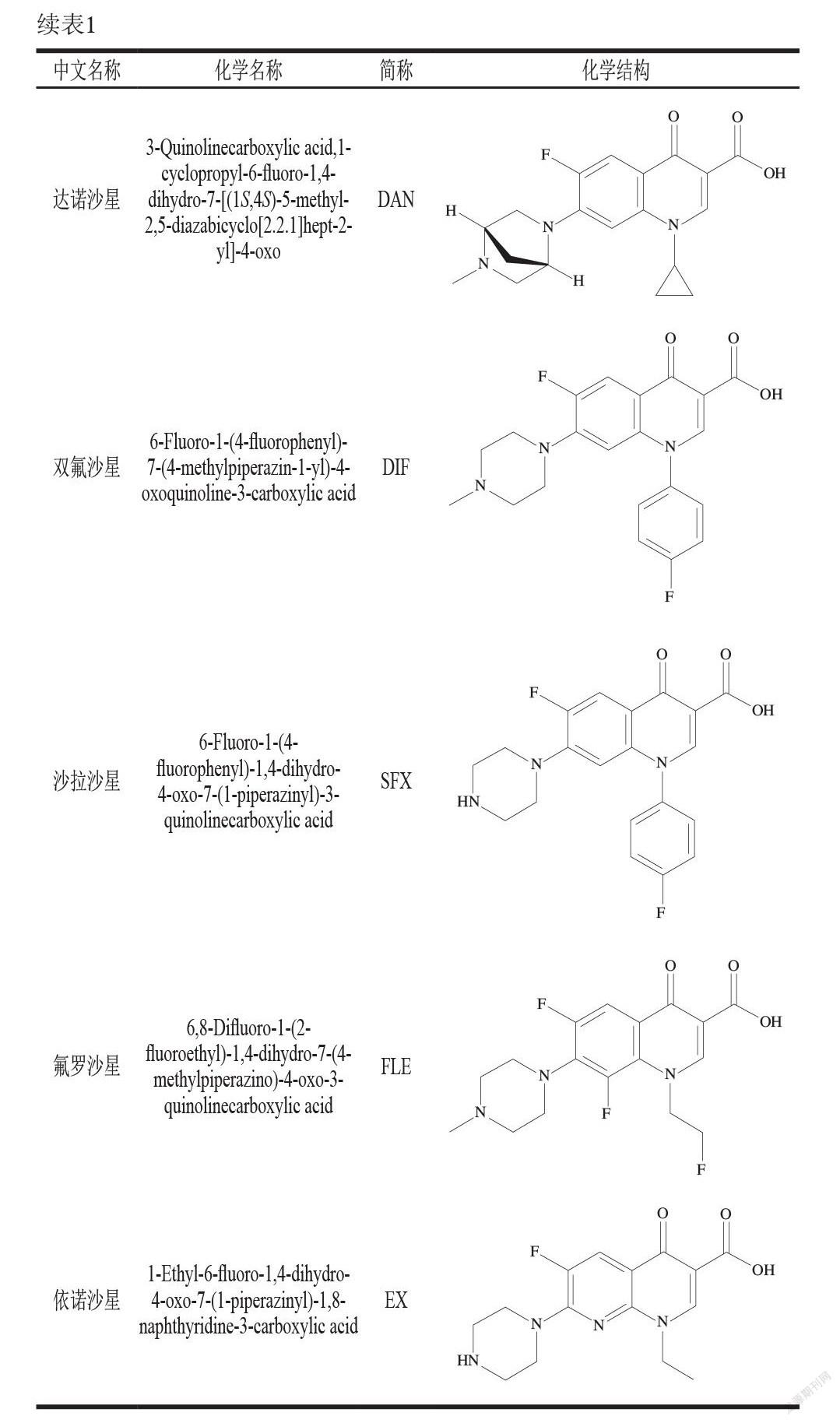
氟喹诺酮类药物是一类化合物,包含大量合成抗菌剂,而且数量还在不断增加。首个被批准用于临床医学的氟喹诺酮类药物是诺氟沙星,第1种被批准用于动物的氟喹诺酮类药物恩诺沙星于20世纪80年代末获得批准,一般是由含氟苯环合成含氟喹啉类化合物后与哌嗪缩合而得。在结构上,所有的氟喹诺酮类药物都在基本喹诺酮核的第6位含有1 个氟原子[7]。氟喹诺酮类药物可分为4 代:第1代包括原喹诺酮类化合物,如萘啶酸、恶啉酸、哌啶酸和西诺沙星;第2代包括环丙沙星、恩诺沙星、马波沙星、达诺沙星、双氟沙星、诺氟沙星和依诺沙星;第3代在保持第2代特性的同时,对中枢神经系统的毒性也较低,包括奥比沙星、左氧氟沙星、司帕沙星和格帕沙星;第4代包括曲瓦沙星、加替沙星、莫西沙星、吉西沙星和西他沙星[8]。目前常见的氟喹诺酮类药物的化学名称及结构如表1所示。
2 氟喹诺酮类药物的毒性危害
氟喹诺酮类药物是一类高效抗生素,广泛用于人类和兽医学,用于治疗呼吸道疾病和肠道细菌感染。氟喹诺酮类药物通过抑制DNA旋转酶对革兰氏阳性菌和革兰氏阴性菌均表现出抑制作用,其最大的特点是抗菌活性强,广泛用于畜禽疾病的预防和治疗。科学规范的使用可有效增加药物的脂溶性,提升药物的杀菌效果,同时不会对畜禽产品食用者的健康产生危害。但有些饲养人员为了自身利益,将氟喹诺酮长期超标应用于畜禽饲养中,这会增加食源性抗生素耐药病原菌的风险,并导致微生物耐药性明显增长,畜禽疾病的治疗效果会受到影响,而且可能会导致兽药残留物持续存在于可食用动物组织中。氟喹诺酮的毒性很大程度上取决于剂量和动物种类。大量动物实验表明,临床治疗量会引起幼龄动物的软组织、骨骼和关节感染,尤其是幼龄动物的关节病和眼部毒性(包括视网膜变性和某些氟喹诺酮的包膜下白内障)[9-10]。长期食用氟喹诺酮含量超标的畜禽肉会对人体造成不良反应,如引起排尿、造血功能紊乱,也可能引发光敏和过敏反应等[11-12],对人体中枢系统引发的神经毒性及对人体的呼吸系统均会产生不良影响。
3 氟喹诺酮类药物的提取净化方法
3.1 固相萃取
固相萃取法是分析物被转移到固相,在取样过程中被保留,然后将固相从样品中分离出来,并通过使用液体或流体进行洗脱或通过热解吸进入气相来回收分析物。固相萃取是一种广泛应用的样品制备技术,用于分离选定的分析物[13]。梁思慧等[14]用静电纺丝法制备聚丙乙烯纳米纤维膜,然后修饰聚多巴胺,建立一种新型的固相萃取前处理方法,该方法的基质净化能力显著升高,再结合超高效液相色谱-串联质谱检测淡水鱼中四环素和氟喹诺酮残留,检出限为0.3~1.5 μg/kg,定量限为1.5~5.0 μg/kg,样品的加标回收率为94.37%~102.82%。Bagheri等[15]采用二维金属有机框架作为一种有效的吸附剂,从牛乳样品提取氟喹诺酮类药物。结果表明,二维金属有机框架对氧氟沙星、环丙沙星和诺氟沙星具有良好的提取能力,同时发现醋酸溶液对氟喹诺酮的洗脱吸附效果较好,最后采用高效液相色谱-串联质谱对提取的目标物进行检测分析。金属有机框架具有孔隙率高、比表面积大和结构可调等特性,提升了固相萃取法的萃取能力和提取效率。
3.2 固-液萃取
固-液萃取法利用萃取剂使固体物料中的可溶性物质溶解于其中,多次萃取后达到分离、提取的目的。Johnston等[16]使用乙腈从均质组织中提取分析物,利用聚合物反相和陰离子交换柱对提取液进行处理,然后通过反相高效液相色谱-串联质谱法同时分析鳟鱼、对虾和鲍鱼中的8 种喹诺酮类和氟喹诺酮类药物,结果表明,所有分析物均获得了良好的回收率,定量限为5 μg/kg(环丙沙星为10 μg/kg),检测限为1~3 μg/kg。相比液-液萃取法,固-液萃取法可以有效将分析物与干扰组分分离,简化样品预处理过程,提高分析物的回收率。
3.3 分散液-液微萃取
分散液-液微萃取法是一种采用三元溶剂体系的新型高效预浓缩技术[17],已被应用于不同基质中多种有机化合物和无机化合物的测定,其优点是操作简单、提取时间短、成本低。分散液-液微萃取法是一种改进的溶剂萃取方法,与其他方法相比,受体相比大大降低。Moema等[18]
建立分散液-液微萃取方法,用于从鸡肝样品中提取6 种氟喹诺酮类药物,使用液相色谱-二极管阵列检测器对分散液-液微萃取提取物进行分析。结果表明,在最佳条件下,加标回收率为83%~102%,检出限为5.3~
18.5 μg/kg。Tsai等[19]开发了一种发光方法,筛选猪肝中恩诺沙星及其代谢物环丙沙星的残留物,目标分析物在乙腈-1.5%三氟乙酸-氯化钠中提取,通过分散液-液微萃取净化,最后利用时间分辨分光光度计通过铽敏化发光进行检测。此方法的优点在于仅使用少量氯化溶剂即可完成净化和富集。
3.4 免疫亲和层析
免疫亲和层析是一种有效的抗体分离方法,它利用抗体或抗体片段作为配体,保持其结合能力,将其固定在固体支持基质上。最近几年,免疫亲和层析的高选择性也使其成为开发各种特定分析方法的手段。Yang Yamei等[20]介绍了一种新型混合床免疫柱方法,以磺胺甲恶唑为半抗原制备一种新的针对磺胺类药物的宽谱特异性单克隆抗体,该单克隆抗体与6 种磺胺类药物交叉反应活性为31%~112%;进一步偶联免疫亲和柱层析,同时分离猪和鸡肌肉组织中的13 种喹诺酮类和6 种磺胺类抗生素,最后采用液相色谱-串联质谱法进行检测。结果表明,动物肌肉中19 种抗生素的定量限为0.5~3.0 μg/kg,加标回收率为72.6%~107.6%。此混合床免疫层析法与仅使用一种抗体的传统免疫亲和层析相比,显示出共提取和共清除2 组分析物的能力[21],而且耗时短且成本低。
3.5 分散固相萃取
分散固相萃取法,又称为QuEChERS(quick, easy, cheap, effective, rugged, safe),是2003年提出的一种快速、简单、廉价、有效、安全的萃取方法[22],可以在短时间内有效分离多种复杂化合物。目前,分散固相萃取法已被用于动物源性食品中违禁药物等多种药物残留分析。Lombardo-Agüí等[23]利用QuEChERS-超高效液相色谱-串联质谱法测定欧盟规定的8 种兽用喹诺酮类药物,分别对蜂蜜、蜂王浆和蜂胶等蜂产品进行评估,结果表明,化合物的分离仅在3 min内完成,对于同一批6 个样品,整个测定过程(包括样品处理)不超过40 min。
王志昱等[24]建立可以同时准确检测鸡胗和鸡肝中11 种喹诺酮类和4 种四环素类抗生素的分析方法,采用QuEChERS法进行样品前处理,经冰乙酸-乙腈-水溶液(1∶84∶15,V/V)提取,Discovery®DSC-18吸附剂净化,使用高效液相色谱-质谱联用仪进行检测,选用甲醇-0.1%甲酸体系作为流动相对目标物进行梯度洗脱,多反应监测模式检测。该前处理技术节省时间、重现性高、价格低廉。Hu Kai等[25]通过席夫碱缩合反应,将氨基修饰的四氧化三铁纳米粒子与活性单体1,3,5-三甲酰基间苯三酚和2,5-二氨基苯磺酸反应,制备混合模式磁性磺化共价有机骨架复合材料,进一步利用其作为分散固相萃取材料,建立一种高效测定食品中β受体激动剂和氟喹诺酮类化合物的方法。结果表明,样品中β受体激动剂和氟喹诺酮类药物的加标回收率分别为95.8%~105.2%和94.5%~105.8%。与固相萃取法相比,分散固相萃取法的稳定性较好,简化了提取和清洗步骤,溶剂消耗量少,同时可以获得高回收率。
3.6 分散微固相萃取
分散微固相萃取技术原理是将待净化提取液直接加入含有固体填料的离心管中,通过涡旋、振荡等方式将待测目标物吸附于填料上,而后将解吸相加入到吸附剂中,将分析物从吸附剂中解吸出来。相较于传统的固相萃取技术,分散微固相萃取将吸附剂分散到样品基质或其萃取物中,吸附剂颗粒和目标物之间的密切接触有利于提高整个过程的效率。Vakh等[26]基于磁分散微固相萃取分析物,使用多泵流系统,采用化学发光法测定牛乳中的氟喹诺酮类药物,采用Ce4+、Tb3+、SO32-与Zr-Fe-C磁性纳米粒子结合制得磁分散微固相萃取材料,将水和混合物注入装有多泵流系统检测器的离心管中,从而在牛乳基质中通过化学发光筛选氟喹诺酮类药物。该法可以减少样品和试剂的损耗,并提高测定结果的重现性。
3.7 超临界流体萃取
超临界流体萃取是采用超临界流体作为萃取剂从固体或液体中萃取可溶组分,根据各物质的特性不同进行萃取分离[27]。与其他提取技术相比,其优点是使用了超临界溶剂,提取过程更加高效。Shen Jingyu等[28]采用超临界流体萃取法提取鸡肉中诺氟沙星和氧氟沙星,通过确定提取参数,优化超临界流体萃取条件,使鸡肉样品中氟喹诺酮类药物的回收率足够高,达到70%~87%,该前处理技术无需进一步的样品清除,简便易操作。
4 氟喹诺酮类药物的检测方法
4.1 高效液相色谱法
高效液相色谱法是以高压系统输送的液体为流动相,试样流经色谱柱时与固定相发生相互作用,由于试样中各组分的性质和结构存在差异,因此,各组分与固定相之间的作用力不同,从而实现分离。高效液相色谱作为一种高效的分离分析技术,具有准确、灵敏、可同时测定多组分等特点,已广泛应用于食品中多种残留物的定性和定量分析等食品安全检测、医药化工、环境监测等领域[29-31]。农业部1025号公告-14—2008[29]规定,动物性食品中氟喹诺酮类药物残留的檢测方法为高效液相色谱法。方永卫等[32]利用高效液相色谱-紫外检测器法对动物性产品中麻保沙星、环丙沙星和恩诺沙星3 种氟喹诺酮类药物残留进行测定,3 种物质的检测限均为500 μg/L,
肉品中的加标回收率为82.0%~105.6%。Yu Hu等[33]采用基质固相分散和高效液相色谱结合二极管阵列检测器同时测定猪组织中氟喹诺酮类、磺胺类和四环素类兽药,平均加标回收率为80.6%~103.1%,检出限为0.007~0.034 μg/kg。
4.2 液相色谱-质谱法
液相色谱-质谱法结合了色谱的分离能力和质谱的定性能力,可对复杂化合物进行更精准、简便的定性和定量分析。与高效液相色谱法相比,液相色谱-质谱法的灵敏度、准确性及适用性均得到提升。此外,与气相色谱-质谱法相比,液相色谱-质谱法在分离和测定高沸点、热不稳定化合物及生物活性物质方面具有独特优势。
夏骏等[34]建立了一种测定动物源性食品中氟喹诺酮类药物残留量的QuEChERS-液相色谱-串联质谱法,结果表明,禽蛋中氟喹诺酮的检出限为3.0 μg/kg,定量限为4.0 μg/kg,加标回收率为61.0%~105.2%。Tian Hongzhe[35]建立了检测牛乳中氯霉素、恩诺沙星及29 种农药残留的液相色谱-质谱法,该方法的定量限为300~1 450 μg/L,加标回收率为71%~107%,可用于实际样品中痕量农药残留的测定。
4.3 免疫分析技术
4.3.1 酶联免疫法
酶联免疫法通过抗原与抗体的高特异性结合和酶的高催化率来增强检测信号,使该检测方法达到高灵敏度。酶联免疫法可定量检测特异性抗体,用于筛选大量样品[36]。杨熠等[37]采用活性脂法合成人工抗原,建立一种基于卵黄抗体的间接竞争酶联免疫吸附法,用于测定动物性产品中恩诺沙星残留,检出限为4.323 μg/L,紫外光谱及人工抗原蛋白电泳结果均表明,半抗原与载体蛋白已成功偶联。Jiang Jinqiang等[38]利用沙拉沙星通过碳二亚胺偶联法合成免疫原和包被抗原,并利用细胞融合技术合成沙拉沙星单克隆抗体,建立一种测定鱼类样品中氟喹诺酮药物残留的间接竞争酶联免疫法,结果表明,鱼类样品中沙拉沙星的检出限为0.002 μg/L。樊晓博等[39]以单克隆抗体为基础,将辣根过氧化物酶标记的抗原与处理好的样品进行偶联,并用该酶标抗原直接竞争酶联免疫法测定生乳、鸡肉、鱼肉和虾中的氟喹诺酮残留。结果表明,该法检测限为0.15 μg/L,加标回收率为70.0%~121.5%。
4.3.2 化学发光及化学发光免疫分析法
化学发光技术主要依赖于氧化反应发出的光[40-41]。化学发光免疫分析技术是基于高灵敏的化学发光分析系统和高特异性的免疫反应,用于抗原、抗体、酶、半抗原、药物等的分析检测技术。Li Jie等[42]基于氟喹诺酮可以增强铈和甲氧基荧光素类化合物之间的化学发光反应,建立一种用于牛乳中氟喹诺酮类化合物的超灵敏化学发光测定方法,采用分子印迹聚合物选择性提取氟喹诺酮,氟喹诺酮的日内加标回收率为93.6%~107.4%,日间加标回收率为92.98%~102.30%,最低检出限为
1×10-4 μmol/L,化学发光系统与分子印迹技术的结合使氟喹诺酮类药物的检测灵敏度和选择性得到较大提升。Tao Xiaoqi等[43]建立一种基于单链可变片段的化学发光竞争间接酶联免疫法,用于测定鱼类和虾中的氟喹诺酮残留,与传统比色检测法相比,化学发光酶联免疫吸附法显著提高了免疫分析的灵敏度,诺氟沙星的检出限为0.2 μg/L,环丙沙星和恩诺沙星的检出限均低于0.2 μg/L。
4.3.3 胶体金免疫层析法
胶体金免疫层析法是将特异性的抗原或抗体相互作用,目标待测物与胶体金垫上的特异性抗体结合,继续前移被截留在聚集带时,可通过肉眼观察到显色结果[44-45]。
胶体金免疫层析法可以在较短时间内获得结果,而酶联免疫法则需要復杂的洗涤和酶消化过程。Zhu Yan等[46]制备了一种快速检测鸡肌肉和肝脏中12 种氟喹诺酮残留的特异性单克隆抗体胶体金免疫层析试纸条,氟喹诺酮与固定在硝酸纤维素膜上的抗原竞争,当检测线存在时,诺氟沙星和培氟沙星的最低检出限为25 μg/L,其他氟喹诺酮的最低检出限为50 μg/L,该方法可作为快速筛选动物源性食品中氟喹诺酮类药物残留的工具。Byzova等[47]利用天然抗血清制备胶体金抗体偶联物,建立氧氟沙星的免疫层析测定方法,胶体金标记的特点是使用天然抗血清代替纯化的免疫球蛋白或特异性抗体,这使得合成过程更容易,且不影响检出限。该方法可用于简化不同化合物免疫层析分析测试系统的制备。
4.3.4 荧光免疫测定法
荧光免疫分析技术是定量荧光标记的免疫分析[48],
有竞争型和夹心型2 种模式,是一种高灵敏检测手段,具有特异性强、检测速度快、实用性强等优势。Hu Gaoshuang等[49]开发了一种基于上转换纳米粒子的荧光免疫技术,检测动物源性食品中氟喹诺酮类残留量,结果表明,恩诺沙星的检出限为1×10-2 μg/L,添加诺氟沙星的动物性食品中其加标回收率为82.37%~132.22%,该方法对氟喹诺酮类残留量的检测具有很大优势,且处理简单,无需任何预处理即可直接进行分析,灵敏、无干扰。赵维章等[50]将环丙沙星抗原与荧光微球标记环丙沙星单克隆抗体偶联,建立一种时间分辨荧光免疫层析的方法,用于测定牦牛肉中环丙沙星、恩诺沙星等药物残留,定量限小于0.96 μg/kg。
4.4 传感器法
传感器是基于待测物的光学或电化学等性质并将待测物的化学信号转化为光信号或电信号进行检测[51-52]。与光谱、质谱和色谱技术相比,传感器法具有响应快、灵敏度高、小型化、检测简单且仪器便于携带等优点。Song Yinpan等[53]合成具有类石墨烯纳米结构的钴镍双金属有机框架,并基于该金属有机框架建立一种测定恩诺沙星的电化学适配体传感器,恩诺沙星的检出限为2×10-7 μg/L。Liu Xiuying等[54]将生物素化的恩诺沙星适配体固定在上转换纳米颗粒表面,接着适配体在恩诺沙星上折叠后形成复合物,进一步利用分子印迹技术使甲基丙烯酸单体围绕复合物进行聚合,移除恩诺沙星后得到双识别印迹孔穴。该适配体-分子印迹聚合物/纳米颗粒混合传感系统可同时实现分子识别和信号转换,不同鱼样品中恩诺沙星的加标回收率为87.05%~96.24%,检出限和定量限分别为0.04、0.12 μg/L。该传感器的选择性好、重现性高、稳定性良好且适用性强。
Wang Minghua等[55]将1,3,6,8-四(4-甲酰基苯基)芘和三聚氰胺通过亚胺键进行缩聚反应,制得共价有机骨架,进一步基于共价有机骨架构建一种电化学适配体传感器,可对氨苄西林和恩诺沙星2 种抗生素进行高灵敏检测,氨苄西林和恩诺沙星的检出限分别为4×10-8、6.07×10-6 μg/L,
加标回收率分别为99.5%~103.0%和101.0%~112.4%。相比传统的电化学传感器,该电化学适配体传感器将适配体与电化学检测方法相结合,使得恩诺沙星等药物的检测灵敏度和选择性大幅提高。
5 结 语
氟喹诺酮类抗生素抗菌活性强、生物利用度高,已被广泛用于预防和治疗家畜疾病。但近年来动物源性食品中氟喹诺酮类抗生素的滥用及残留超标事件时常发生,耐药性微生物的增加对消费者健康保护和兽医医学来说是一个重大挑战。我国国家标准GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》对不同食品中氟喹诺酮类抗生素规定了最大残留限量,因此,建立高效、灵敏、便捷的氟喹诺酮类药物的检测方法对保障动物源性食品安全具有重要意义。目前,食品中氟喹诺酮类兽药检测方法主要有高效液相色谱法、液相色谱-质谱法、免疫分析法和传感器法等。由于动物源性食品中氟喹诺酮类药物的残留量较低和样品基质的复杂性,在测定前需要利用前处理方法对样品中的目标分析物进行有效提取、净化和富集。随着新技术和新材料的不断出现和发展,开发简单、通用的样品制备程序,以实现更少的污染和更快速、有效的分离提取,进一步提高氟喹诺酮类药物检测的重复性、稳定性和便捷性,开发高效的快速检测技术将是今后研究工作的重点。
参考文献:
[1] GHORBANI M, AGHAMOHAMMADHASSAN M, CHAMSAZ M, et al. Dispersive solid phase microextraction[J]. TrAC Trends in Analytical Chemistry, 2019, 118: 793-809. DOI:10.1016/j.trac.2019.07.012.
[2] HAIN E, ADEJUMO H, ANGER B, et al. Advances in antimicrobial activity analysis of fluoroquinolone, macrolide, sulfonamide, and tetracycline antibiotics for environmental applications through improved bacteria selection[J]. Journal of Hazardous Materials, 2021, 415: 125686. DOI:10.1016/j.jhazmat.2021.125686.
[3] MADIKIZELA L M, NOMNGONGO P N, PAKADEV E. Synthesis of molecularly imprinted polymers for extraction of fluoroquinolones in environmental, food and biological samples[J]. Journal of Pharmaceutical and Biomedical Analysis, 2022, 208: 114447. DOI:10.1016/j.jpba.2021.114447.
[4] TUREL I. The interactions of metal ions with quinolone antibacterial agents[J]. Coordination Chemistry Reviews, 2002, 232(1/2): 27-47. DOI:10.1016/S0010-8545(02)00027-9.
[5] The European Medicines Agency. Commission regulation (EU) (2010) No.37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin[S]. 2009-12-22.
[6] Codex Alimentarius Commission (CAC). Codex alimentarius international food standards: maximum residue limits (MRLs) and risk management recommendations (RMRs) for residues of veterinary drugs in foods: CX/MRL 2-2018[S]. CAC, 2018.
[7] GOUVEA R, SANTOS F D, AQUINO M D, et al. Fluoroquinolones in industrial poultry production, bacterial resistance and food residues: a review[J]. Revista Brasileira de Ciência Avícola, 2015, 17(1): 1-10. DOI:10.1590/1516-635x17011-10.
[8] PANG Guofang. Fluoroquinolone[M]//Analytical methods for food safety by mass spectrometry. Salt Lake City: Academic Press, 2018: 375-410. DOI:10.1016/B978-0-12-814165-6.00011-7.
[9] MARTINEZ M, MCDERMOTT P, WALKER R. Pharmacology of the fluoroquinolones: a perspective for the use in domestic animals[J]. Veterinary Journal, 2006, 172(1): 10-28. DOI:10.1016/j.tvjl.2005.07.010.
[10] WIDIYANTI P M, SUDARWANTO M B, SUDARNIKA E, et al. The use of enrofloxacin antibiotic as a veterinary drug and its residual hazards on public health[J]. Indonesian Bulletin of Animal and Veterinary Sciences, 2019, 29(2): 75. DOI:10.14334/wartazoa.v29i2.2015.
[11] 李四華, 张海智. 兽药残留的危害及对策[J]. 中国畜禽种业, 2018, 14(12): 43.
[12] 马君梅. 畜产品中兽药残留检测方法研究进展[J]. 乡村科技, 2020, 11(28): 46-47. DOI:10.19345/j.cnki.1674-7909.2020.28.026.
[13] 李冬玲. 浅谈食品农药残留检测中样品前处理技术[J]. 食品安全导刊, 2020, 33: 172-173. DOI:10.16043/j.cnki.cfs.2020.33.114.
[14] 梁思慧, 戴海蓉, 张铧尹, 等. 聚多巴胺纳米纤维膜固相萃取-超高效液相色谱-串联质谱检测淡水鱼中四环素类和氟喹诺酮类药物残留[J].
色譜, 2021, 39(6): 624-632. DOI:10.3724/SP.J.1123.2020.12026.
[15] BAGHERI N, LAWATI H, SHARJI N, et al. Magnetic zinc based 2D-metal organic framework as an efficient adsorbent for simultaneous determination of fluoroquinolones using 3D printed microchip and liquid chromatography tandem mass spectrometry[J]. Talanta, 2021, 224: 121796. DOI:10.1016/j.talanta.2020.121796.
[16] JOHNSTON L, MACKAY L, CROFT M. Determination of quinolones and fluoroquinolones in fish tissue and seafood by high-performance liquid chromatography with electrospray ionisation tandem mass spectrometric detection[J]. Journal of Chromatography A, 2002, 982(1): 97-109. DOI:10.1016/S0021-9673(02)01407-3.
[17] WANG Qiangfei, CHEN Renji, SHATNER W, et al. State-of-the-art on the technique of dispersive liquid-liquid microextraction[J]. Ultrasonics Sonochemistry, 2019, 51: 369-377. DOI:10.1016/j.ultsonch.2018.08.010.
[18] MOEMA D, NINDI M M, DUBE S. Development of a dispersive liquid-liquid microextraction method for the determination of fluoroquinolones in chicken liver by high performance liquid chromatography[J]. Analytica Chimica Acta, 2012, 730: 80-86. DOI:10.1016/j.aca.2011.11.036.
[19] TSAI W H, CHUANG H Y, CHEN H H, et al. Application of dispersive liquid-liquid microextraction and dispersive micro-solid-phase extraction for the determination of quinolones in swine muscle by high-performance liquid chromatography with diode-array detection[J]. Analytica Chimica Acta, 2009, 656(1/2): 56-62. DOI:10.1016/j.aca.2009.10.008.
[20] YANG Yamei, WANG Yadan, NIU Rui, et al. Preparation and characterization of chitosan microparticles for immunoaffinity extraction and determination of enrofloxacin[J]. International Journal of Biological Macromolecules, 2016, 93: 783-788. DOI:10.1016/j.chroma.2008.08.116.
[21] LI Cun, WANG Zhanhui, CAO Xingyuan, et al. Development of an immunoaffinity column method using broad-specificity monoclonal antibodies for simultaneous extraction and cleanup of quinolone and sulfonamide antibiotics in animal muscle tissues[J]. Journal of Chromatography A, 2008, 1209(1/2): 1-9. DOI:10.1016/j.chroma.2008.08.116.
[22] ARIAS O D, LUCAS J, BATISTA-ANDRADE J A, et al. Chitosan from shrimp shells: a renewable sorbent applied to the clean-up step of the QuEChERS method in order to determine multi-residues of veterinary drugs in different types of milk[J]. Food Chemistry, 2018, 240: 1243-1253. DOI:10.1016/j.foodchem.2017.08.041.
[23] LOMBARDO-AGÜÍ M, GARCÍA-CAMPAÑA A M, GÁMIZ-GRACIA L, et al. Determination of quinolones of veterinary use in bee products by ultra-high performance liquid chromatography-tandem mass spectrometry using a QuEChERS extraction procedure[J]. Talanta, 2012, 93: 193-199. DOI:10.1016/j.talanta.2012.02.011.
[24] 王志昱, 张桂芳, 张晓瑜, 等. QuEChERS-高效液相色谱-质谱联用法同时检测鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素[J]. 肉类研究, 2020, 34(3): 51-57. DOI:10.7506/rlyj1001-8123-20200131-023.
[25] HU Kai, SHI Yanmei, ZHU Weixia, et al. Facile synthesis of magnetic sulfonated covalent organic framework composites for simultaneous dispersive solid-phase extraction and determination of β-agonists and fluoroquinolones in food samples[J]. Food Chemistry, 2020, 339: 128079. DOI:10.1016/j.foodchem.2020.128079.
[26] VAKH C, POCHIVALOV A, KORONKIEWICZ S, et al.
A chemiluminescence method for screening of fluoroquinolones in milk samples based on a multi-pumping flow system[J]. Food Chemistry, 2019, 270: 10-16. DOI:10.1016/j.foodchem.2018.07.073.
[27] 陈淦铭. 超临界流体萃取技术的研究与应用[J]. 辽宁化工, 2021, 50(1): 55-57. DOI:10.14029/j.cnki.issn1004-0935.2021.01.016.
[28] SHEN Jingyu, KIM M R, LEE C J, et al. Supercritical fluid extraction of the fluoroquinolones norfloxacin and ofloxacin from orally treated-chicken breast muscles[J]. Analytica Chimica Acta, 2004, 513(2): 451-455.
DOI:10.1016/j.aca.2004.02.065.
[29] 中国兽医药品监察所. 动物性食品中氟喹诺酮类药物残留检测 高效液相色谱法: 农业部1025号公告-14—2008[S]. 北京: 中国农业出版社, 2008.
[30] 尹华丁, 张蕾, 丁亚平, 等. 水产品中氟喹诺酮类药物残留检测技术研究进展[J]. 今日畜牧兽医, 2020, 36(11): 3-4. DOI:10.3969/j.issn.1673-4092.2020.11.002.
[31] TOLDRA F, REIG M. Methods for rapid detection of chemical and veterinary drug residues in animal foods[J]. Trends in Food Science and Technology, 2006, 17(9): 482-489. DOI:10.1016/j.tifs.2006.02.002.
[32] 方永卫, 师永华, 郭向阳. 高效液相色谱法检测动物性产品中3 种氟喹诺酮类药物残留的研究[J]. 肉类工业, 2019(11): 44-47.
[33] YU Hu, MU Hui, HU Yinmei. Determination of fluoroquinolones, sulfonamides, and tetracyclines multiresidues simultaneously in porcine tissue by MSPD and HPLC-DAD[J]. Journal of Pharmaceutical Analysis, 2012, 2(1): 76-81. DOI:10.1016/j.jpha.2011.09.007.
[34] 夏骏, 李勇, 吳科盛, 等. QuEChERS-液相色谱串联质谱法测定动物源性食品中氟喹诺酮类残留量[J]. 江西畜牧兽医杂志, 2019(6): 1-5.
[35] TIAN Hongzhe. Determination of chloramphenicol, enrofloxacin and 29 pesticides residues in bovine milk by liquid chromatography-tandem mass spectrometry[J]. Chemosphere, 2011, 83(3): 349-355. DOI:10.1016/j.chemosphere.2010.12.016.
[36] LIU Long, ZHANG Aihong, WANG Xinghe. A sensitive and simple enzyme-linked immunosorbent assay using polymer as carrier[J]. Biological and Pharmaceutical Bulletin, 2020, 43(5): 757-761. DOI:10.1248/bpb.b20-00048.
[37] 楊熠, 孟坤杰, 赵红琼, 等. 酶联免疫吸附法检测动物源性食品中恩诺沙星残留量[J]. 食品科学, 2017, 38(8): 239-243. DOI:10.7506/spkx1002-6630-201708037.
[38] JIANG Jinqiang, ZHANG Haitang, WANG Ziliang. Multiresidue determination of sarafloxacin, difloxacin, norfloxacin, and pefloxacin in fish using an enzyme-linked immunosorbent assay[J]. Procedia Environmental Sciences, 2011, 8(1): 301-306. DOI:10.1016/j.proenv.2011.10.048.
[39] 樊晓博, 谢兰心. 酶标抗原直接竞争ELISA检测食品中氟喹诺酮类药物多残留[J]. 食品科学, 2015, 36(24): 265-269. DOI:10.7506/spkx1002-6630-201524049.
[40] 林金明, 赵利霞, 王栩. 化学发光免疫分析[M]. 北京: 化学工业出版社, 2008: 9.
[41] 李源珍, 生威, 刘恩梅, 等. 化学发光酶免疫法测牛奶中3 种喹诺酮类药物[J]. 食品研究与开发, 2013, 34(16): 78-81. DOI:10.3969/j.issn.1005-6521.2013.16.022.
[42] LI Jie, LU Siying, XIANG Jianxing, et al. Class-specific determination of fluoroquinolones based on a novel chemiluminescence system with molecularly imprinted polymers[J]. Food Chemistry, 2019, 298: 125066. DOI:10.1016/j.foodchem.2019.125066.
[43] TAO Xiaoqi, CHEN Min, JIANG Haiyang, et al. Chemiluminescence competitive indirect enzyme immunoassay for 20 fluoroquinolone residues in fish and shrimp based on a single-chain variable fragment[J]. Analytical and Bioanalytical Chemistry, 2013, 405(23): 7477-7484. DOI:10.1007/s00216-013-7174-9.
[44] 路明, 张庆雨, 孙琛, 等. 胶体金免疫层析技术在食品检测中的作用分析[J]. 中国食品, 2021(5): 111. DOI:10.3969/j.issn.1000-1085.2021.05.055.
[45] CHEN Yanni, LIU Liqiang, XU Liguan, et al. Gold immunochromatographic sensor for the rapid detection of twenty-six sulfonamides in foods[J]. Nano Research, 2017, 10(8): 2833-2844. DOI:10.1007/s12274-017-1490-x.
[46] ZHU Yan, LI Lin, WANG Zhanhui, et al. Development of an immunochromatography strip for the rapid detection of 12 fluoroquinolones in chicken muscle and liver[J]. Journal of Agricultural and Food Chemistry, 2008, 56(14): 5469-5474. DOI:10.1021/jf800274f.
[47] BYZOVA N A, SMIRNOVA N I, ZHERDEV A V, et al. Rapid immunochromatographic assay for ofloxacin in animal original foodstuffs using native antisera labeled by colloidal gold[J]. Talanta, 2014, 119: 125-132. DOI:10.1016/j.talanta.2013.10.054.
[48] SHEN Xing, CHEN Jiahong, LÜ Shuwei, et al. Fluorescence polarization immunoassay for determination of enrofloxacin in pork liver and chicken[J]. Molecules, 2019, 24(24): 4462. DOI:10.3390/molecules24244462.
[49] HU Gaoshuang, SHENG Wei, ZHANG Yan, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J]. Analytical and Bioanalytical Chemistry, 2015, 407(28): 8487-8496. DOI:10.1007/s00216-015-8996-4.
[50] 趙维章, 崔乃元, 张汉青, 等. 时间分辨荧光免疫层析定量检测牦牛肉中喹诺酮类药物[J]. 食品工业科技, 2020, 41(18): 239-243; 251. DOI:10.13386/j.issn1002-0306.2020.18.038.
[51] FARIA L V D, LISBOA T P, CAMPOS N D S, et al. Electrochemical methods for the determination of antibiotic residues in milk: a critical review[J]. Analytica Chimica Acta, 2021, 1173: 338569. DOI:10.1016/j.aca.2021.338569.
[52] CAPOFERRI D, ALVAREZ-DIDUK R, CARLO M D, et al. Electrochromic molecular imprinting sensor for visual and smartphone-based detections[J]. Analytical Chemistry, 2018, 90(9): 5850-5856. DOI:10.1021/acs.analchem.8b00389.
[53] SONG Yinpan, XU Miaoran, LIU Xiao, et al. A label-free enrofloxacin electrochemical aptasensor constructed by a semiconducting CoNi-based metal-organic framework (MOF)[J]. Electrochimica Acta, 2021, 368: 137609. DOI:10.1016/J.ELECTACTA.2020.137609.
[54] LIU Xiuying, REN Jing, SU Lihong, et al. Novel hybrid probe based on double recognition of aptamer-molecularly imprinted polymer grafted on upconversion nanoparticles for enrofloxacin sensing[J]. Biosensors and Bioelectronics, 2017, 87: 203-208. DOI:10.1016/j.bios.2016.08.051.
[55] WANG Minghua, HU Mengyao, LIU Jiameng, et al. Covalent organic framework-based electrochemical aptasensors for the ultrasensitive detection of antibiotics[J]. Biosensors and Bioelectronics, 2019, 132: 8-16. DOI:10.1016/j.bios.2019.02.040.

