T2值定量评估不同肝纤维化分期大鼠肝脏铁沉积
金明丽,潘志华,蒋 颖,赵 琪
(成都医学院第二附属医院 核工业四一六医院放射科,四川 成都 610031)
肝纤维化是慢性肝脏疾病进展为不可逆性肝硬化、肝功能衰竭甚至肝细胞癌的必经病理阶段[1],常伴不同程度铁沉积而加速病情进展。肝脏穿刺活检是评估肝脏铁含量的金标准,但存在取样误差及感染等风险;血清铁、铁蛋白等可在一定程度上反映铁沉积,但无法直接定量肝脏铁含量,且受全身代谢状况影响[2]。MR T2 mapping是评估铁含量的无创性方法之一,其参数T2弛豫时间(T2值)及T2弛豫率(R2值)广泛用于定量评估脑、脾、肝及心脏铁含量[3]。本研究观察T2值评估不同纤维化分期大鼠肝脏铁沉积的价值。
1 材料与方法
1.1 建立大鼠肝纤维化模型 60只2~3月龄SPF级SD雄性大鼠,体质量(202.0±3.2)g,购自西南医科大学动物实验中心[生产许可证SCXK(川)2013-17,使用许可证为SCXK(川)2013-181],常规饲养。分别于其腹腔及后腿内侧皮下注射浓度40%的四氯化碳食用调和油悬浊液0.3 ml/100 g体质量,每周每处注射2次,共注射12周,建立大鼠肝纤维化模型。本研究经院实验动物伦理委员会批准。
1.2 仪器与方法 采用Philips MR Achieva 3.0T超导MR仪,配备16通道腕关节线圈。于造模第5~12周,每周选取1~6只体质量偏轻、毛色较枯黄、精神萎靡的大鼠行上腹部扫描。于后腿内侧皮下注射2%戊巴比妥钠0.2 ml/100 g体质量麻醉大鼠,自膈顶至双肾下缘水平进行T2 mapping扫描,采用多回波梯度-自旋回波(multi-echo gradient and spin echo, M-GRASE)序列,回波数4,TE117 ms,TE234 ms,TE351 ms,TE468 ms,TR 1 552 ms,层厚2.5 mm,层间距1 mm,矩阵240×240。
将图像传导至Philips后处理工作站(Extended MR WorkSpace 2.6.3.4),系统自动重建T2 mapping图像。由2名具有5年MR诊断经验的医师于原始图像(TE为17 ms,图1A)显示肝脏较大层面避开伪影、胆管、大血管、局灶性肝脏损伤部位等放置3个面积10 mm2的圆形ROI[4],并将ROI复制到T2 mapping中的相同区域(图1B),测量其T2值;以2名医师对3个ROI的测量结果的均值为最终结果。
1.3 病理检查 扫描结束后处死大鼠,取肝脏组织送病理科行Masson、普鲁士蓝及HE染色。由2名具有8年病理诊断经验的主治医师采用双盲法评估肝纤维化S分期、铁质及脂肪病理分级。肝脏纤维化分期标准:S0期无纤维化;S1期汇管区扩大、纤维化;S2期汇管区周围纤维化,纤维间隔形成,小叶结构存在;S3期纤维间隔伴小叶结构紊乱,无肝硬化;S4期即早期肝硬化。肝脏脂肪分级标准:0级<5%肝细胞受累;1级5%~33%肝细胞受累;2级34%~66%肝细胞受累;3级>66%肝细胞受累。肝脏铁质分级标准:0级无铁颗粒;1级仅极少数肝细胞中可见铁颗粒;2级指5%~10%肝细胞中可见铁颗粒;3级为≥40%肝细胞可见铁颗粒;4级为大多数肝细胞中见丰富铁颗粒[5-7]。意见不一致时,提请上级医师复核并裁定。
1.4 统计学分析 采用SPSS 22.0统计分析软件。计量资料不符合正态分布,以中位数(上下四分位数)表示,采用Kruskal-WallisH检验进行比较,两两比较采用Nemenyi法。采用Spearman相关分析观察大鼠铁质病理分级与T2值的相关性,以Kendall相关系数(tau-b)分析肝脏铁质病理分级与纤维化S分期间的相关性。绘制T2值诊断肝脏铁质病理分级的受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)。采用双因素方差分析评估脂肪、铁质病理分级、肝纤维化分期对T2值的影响。P<0.05为差异有统计学意义。
2 结果
2.1 病理结果 实验过程中20只大鼠死亡,共40只大鼠纳入研究;其中肝脏纤维化S0期6只、S1期6只、S2期8只、S3期10只、S4期10只(图2),铁质病理分级0级7只、 1级9只、2级12只、3级10只、4级2只(图3),脂肪病理分级0级5只、1级8只、2级12只、3级15只。因铁质病理分级4级样本量较少,将3级与4级合并进行统计学分析。
2.2 相关性分析 肝纤维化分期与肝脏铁质病理分级呈正相关(tau-b=0.851,P<0.001),铁质病理分级与T2值呈负相关(rs=-0.803,P<0.001)。
2.3 不同铁质病理分级T2值比较 铁质病理分级0级大鼠肝脏T2值为59.10(60.70,57.80)ms,1级为56.50(57.25,52.05)ms,2级为53.95(56.02, 49.75)ms,≥3级为45.85(48.88,34.93)ms,总体差异有统计学意义(H=26.367,P<0.001);两两比较,铁质病理0级与1级、1级与2级肝脏T2值差异均无统计学意义(P均>0.05),其余各铁质病理分级间T2值差异均有统计学意义(P均<0.05)。
2.4 ROC曲线分析 T2值鉴别肝纤维化分期大鼠肝脏有无铁沉积及铁质病理分级≥3级的AUC分别为0.97、0.94,见表1。
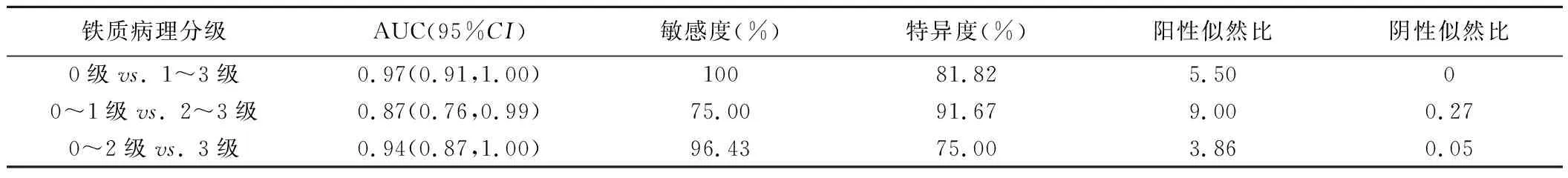
表1 T2值诊断肝纤维化大鼠铁质病理分级的效能(n=40)
2.5 双因素方差分析 对肝脏T2值行正态转换,进一步双因素方差分析结果显示,不同脂肪病理分级肝脏T2值差异无统计学意义(F=0.37,P>0.05),而不同铁质病理分级间肝脏T2值差异有统计学意义(F=5.10,P<0.05),不同肝纤维化分期肝脏T2值差异无统计学意义(F=0.14,P>0.05);三者交互作用对肝脏T2值无明显影响(F=1.43,P>0.05)。
3 讨论
肝纤维化常见于病毒性肝炎、酒精性及非酒精性肝病、血色素沉着症等急、慢性肝损伤,常伴不同程度铁和脂肪沉积,加速芬顿反应,产生活性氧,严重破坏细胞和组织,导致肝纤维化进展为肝硬化,发生门静脉高压等并发症,甚至肝细胞癌。准确评估铁沉积对治疗肝纤维化及评估预后十分重要[8]。既往研究[9]显示,以四氯化碳灌胃建立肝纤维化小鼠模型过程中,随造模时间延长,小鼠肝纤维化程度逐渐增加,并存在不同程度脂肪及铁沉积,且铁沉积随纤维化程度加重而增加。江远等[10]发现正常大鼠存在轻度肝铁沉积;随着肝纤维化加重,肝脏库普弗细胞及活化肝星状细胞铁沉积增多,且存在不同程度脂肪沉积及炎症细胞浸润。本研究结果与上述研究相符。
MRI是量化肝铁沉积的无创性检查方法,有助于指导临床治疗肝纤维化。铁为超顺磁性物质,影响组织的易感性,使B0场不均匀,增加蛋白质结合水的磁化率,致组织T2和T2*弛豫时间缩短,组织信号强度减低, R2及R2*值增加。T2 mapping对静磁场不均匀较不敏感,图像信噪比高于T2*mapping。目前常用组织T2及R2值评估肝脏铁含量。既往研究[11-12]证实,组织R2与肝脏铁含量呈显著相关;肝铁正常及铁过载患者中,R2值与肝脏穿刺活检铁含量呈线性相关(r=0.89)[13-14],提示其诊断铁过载的效能相近,且R2值评估肝脏铁沉积的重复性及准确性较好。KRISTANEEPAILBOON等[15]应用1.5T及3.0T MR仪测量20名健康者及42例肝铁沉积患者的T2及T2*值,发现肝脏T2值(3.0T)及T2*值(1.5T)均能较好评估肝脏铁质病理分级,提示其可作为穿刺活检的替代方法。FRANCA等[16]应用3.0T MR多回波化学位移编码序列图像研究101例弥漫性肝病患者,发现肝脏R2*值随铁质病理分级增高而增加,其鉴别0级与1~4级铁质病理分级的AUC为0.848[95%CI(0.776,0.919)],鉴别0~2级与3~4级铁质病理分级的AUC为0.976[(95%CI(0.949,1.000)],且R2*值评估铁含量不受肝纤维化及脂肪沉积的影响。
本研究结果证实T2值与肝脏铁质病理分级呈负相关,T2值可用于评估肝纤维化大鼠肝脏铁沉积,且不受肝脂肪病理分级、纤维化分期的影响,其鉴别肝纤维化大鼠肝脏有无铁沉积、肝脏铁质病理分级≥3级的效能较好;0级与1级、1级与2级铁质病理分级大鼠肝脏T2值差异无统计学意义,分析可能原因,T2值通过弛豫时间反映组织内铁含量变化,而肝脏弛豫时间受铁浓度、铁颗粒分布及大小的影响,肝纤维化及脂肪沉积均可导致肝脏弛豫时间增加[17-18],部分抵消铁沉积T2弛豫时间的减少,且肝脏炎症和纤维化会限制水分子扩散运动,降低T2值对铁的敏感性。本研究早期肝纤维化大鼠铁沉积较少且不均匀,存在严重脂肪沉积,导致0级与1级、1级与2级铁质病理分级T2值差异无统计学意义;随纤维化进展,肝脏细胞水肿及脂肪变性减轻,肝脏铁沉积增加,S3、S4期肝细胞铁沉积明显,肝脏T2弛豫时间明显缩短。
综上,T2值对定量评估肝纤维化大鼠模型肝脏铁沉积具有一定价值,有助于鉴别有无铁沉积及病理分级≥3级铁沉积。但本研究样本量小,且未能定量检测大鼠肝脏铁质及脂肪含量,有待进一步完善。

