黄芪甲苷对射血分数保留型心力衰竭大鼠心脏功能保护及心肌微血管炎症因子的影响*
崔梁瑜 马 静 张学学 薛松研 王方圆 许 航 张 莎
(1.陕西中医药大学,陕西 咸阳 712046;2.空军军医大学西京医院,陕西 西安 710032)
资料显示,我国心力衰竭(HF)粗发病率为0.87/1 000人年,累积发病率为0.86%[1]。其中约有50%HF患者为射血分数保留型心力衰竭(HFpEF)[2]。西医主要针对症状、心血管基础疾病和合并症、心血管疾病危险因素进行治疗[3],但目前还没有发现可明显改善HFpEF患者治疗结果的方法,因此寻找针对HFpEF更有效安全的治疗药物,仍是心血管疾病领域研究的热点之一。中医药治疗具有多途径、多靶点的优势,可以改善HFpEF的症状。研究显示[4-5],黄芪中的黄芪甲苷(AstragalosideⅣ)对HF有改善作用,可以促进血管生成、改善能量代谢、抑制心肌肥大、凋亡及纤维化,但能否改善HFpEF心脏功能尚未明确。本实验旨在通过观察黄芪甲苷对HFpEF模型大鼠的心脏功能保护及其作用机制,为HFpEF的治疗提供实验依据。
1 材料与方法
1.1 实验动物 6周龄SPF级雄性盐敏感(Dahl-ss)大鼠25只,体质量(200±20)g,均购于北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0006。大鼠适应性饲养1周,饲养环境为昼夜12 h交替,室内温度控制在18~22℃,湿度控制在50%~60%,食物和水自由摄取。
1.2 试药与仪器 黄芪甲苷(规格:60 g,纯度:99.61%,中国Rskbio公司),加入去离子水搅拌均匀,配置为质量浓度2.5 g/mL药液,4℃冰箱冷藏备用。苏木素染色液(中国Beyotime公司);NT-ProBNP ELISA试剂盒(美国Cloud-Clone公司);vWF抗体(Thermo Fisher Scientific公司);VEGF、CD31、TNF-α和 IL-6抗体(美国Sigma公司);生物素标记山羊抗兔IgG(H+L)(美国Sigma公司);酶标仪(型号:EPOCH2,美国BioTek公司);正置荧光显微镜(型号:Axioimager M1,德国CarlZeiss公司);心电图机(型号:Osciloscopio DS6064,美国ADInstruments公司);彩色多普勒超声(型号:IU22,荷兰Phlips公司)。
1.3 分组与造模 将25只大鼠随机分为正常对照组、模型组及黄芪甲苷低(10 mg/kg)、中(20 mg/kg)、高(40 mg/kg)剂量组[6-7],每组5只。正常对照组用0.3%NaCl饲料喂养8周,其余各组采用8%NaCl高盐饲料喂养8周进行HFpEF模型制备。当LVEF≥50%,BNP>100 pg/mL,NT-ProBNP>300 pg/mL,心率增快,提示模型制备成功。
1.4 给药方法 HFpEF模型制备成功后,黄芪甲苷低、中、高剂量组分别按黄芪甲苷10、20、40 mg/kg灌胃8周。正常对照组、模型组灌胃等量蒸馏水。
1.5 心电图检查 于末次灌胃24 h后,麻醉大鼠并固定于鼠板上,连接心电图机,心率稳定3 min后记录心电图。
1.6 标本采集与检测 1)ELISA法检测NT-ProBNP:心电图记录完毕后,大鼠开胸取血,抽取血液5 mL,离心取上清,96孔板中分别加入不同浓度标准品稀释液后,加血清50 μL/孔,采用ELISA法检测NT-ProBNP含量。2)免疫荧光染色:取出完整心脏,心肌组织脱水、浸蜡和包埋,切片厚度为5 μm,脱蜡,滴加山羊血清封闭后PBS冲洗,依次加入一抗(vWF抗体、CD31抗体)、生物素标记山羊抗兔IgG(H+L)后封片,检测心脏组织CD31、vWF表达。3)免疫组化染色:心肌组织切片脱蜡,PBS冲洗以后,加抗原修复液,低火加热,PBS冲洗,内源酶灭活,采用3%的H2O2室温避光孵育,PBS冲洗,依次加入一抗(VEGF抗体、TNF-α抗体和IL-6抗体)、生物素标记山羊抗兔IgG(H+L)、辣根酶标记链霉卵白素工作液,PBS冲洗;DAB显影,苏木素染色液复染,脱水,透明,封片,检测VEGF、TNF-α和IL-6。
1.7 统计学处理 应用SPSS19.0统计软件。计量资料以()表示,各个组间进行比较时采取单因素方差分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠超声心动指标比较 见图1,表1。模型组大鼠较正常对照组大鼠LVEF值降低,舒张期室间隔厚度(IVSd)值升高,有统计学差异(P<0.05),左心室舒张末期内径(LVIDd)和左室后壁舒张期厚度(LVPWd)值差异不明显(P>0.05)。与模型组相比,黄芪甲苷低、中、高剂量大鼠LVEF值升高,差异有统计学意义(P<0.05),中、高剂量组IVSd显著降低(P<0.05);LVIDd和LVPWd值差异不明显(P>0.05)。
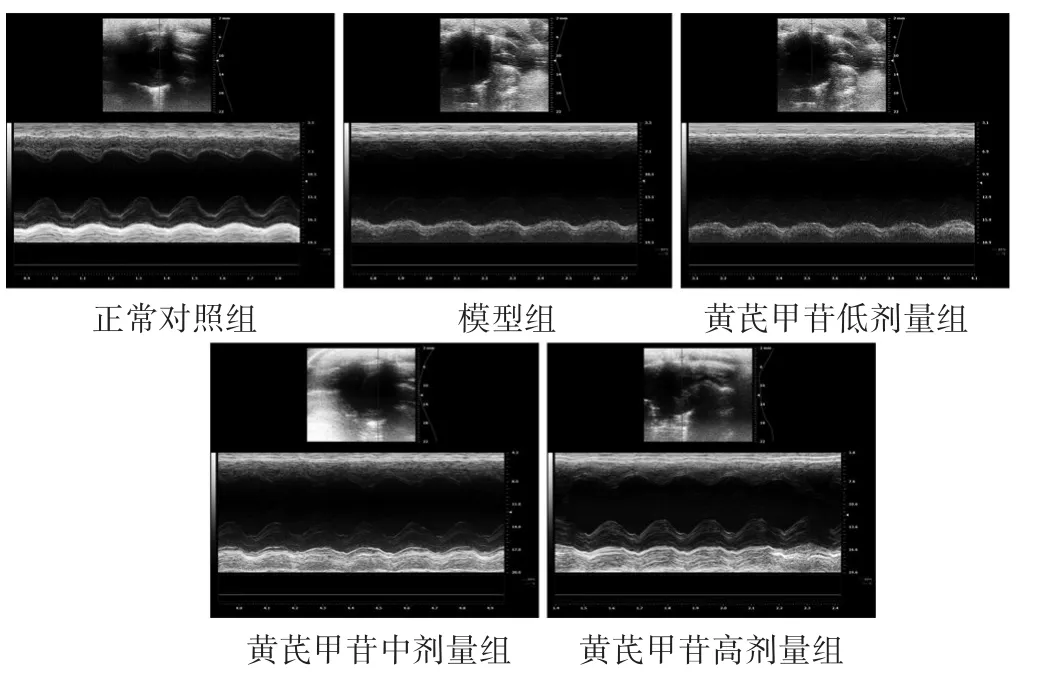
图1 各组实验大鼠超声心电图
表1 各组大鼠超声心动指标比较(±s)
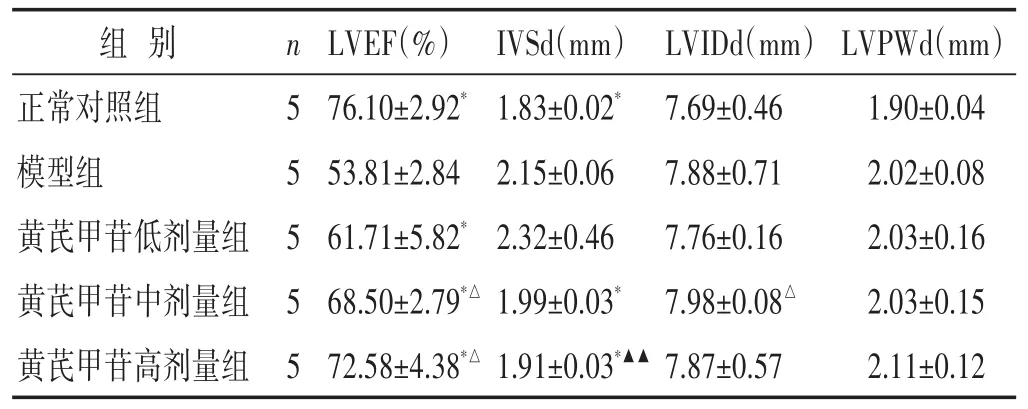
表1 各组大鼠超声心动指标比较(±s)
注:与模型组相比,*P<0.05,**P<0.01;与黄芪甲苷低剂量组比较,△P<0.05,△△P<0.01;与黄芪甲苷中剂量组比较,▲P<0.05,▲▲P<0.01。下同。
组 别n LVEF(%)IVSd(mm)LVIDd(mm)LVPWd(mm)5 5 5 5 5正常对照组模型组黄芪甲苷低剂量组黄芪甲苷中剂量组黄芪甲苷高剂量组76.10±2.92*53.81±2.84 61.71±5.82*68.50±2.79*△72.58±4.38*△1.83±0.02*2.15±0.06 2.32±0.46 1.99±0.03*1.91±0.03*▲▲7.69±0.46 7.88±0.71 7.76±0.16 7.98±0.08△7.87±0.57 1.90±0.04 2.02±0.08 2.03±0.16 2.03±0.15 2.11±0.12
2.2 各组大鼠血清NT-ProBNP水平比较 见表2。与正常对照组相比,模型组大鼠血清NT-ProBNP显著升高(P<0.05);与模型组相比,黄芪甲苷低、中、高剂量组大鼠血清NT-ProBNP均有不同程度的降低(P<0.05)。
表2 各组大鼠血清NT-ProBNP表达水平比较(pg/mL,±s)
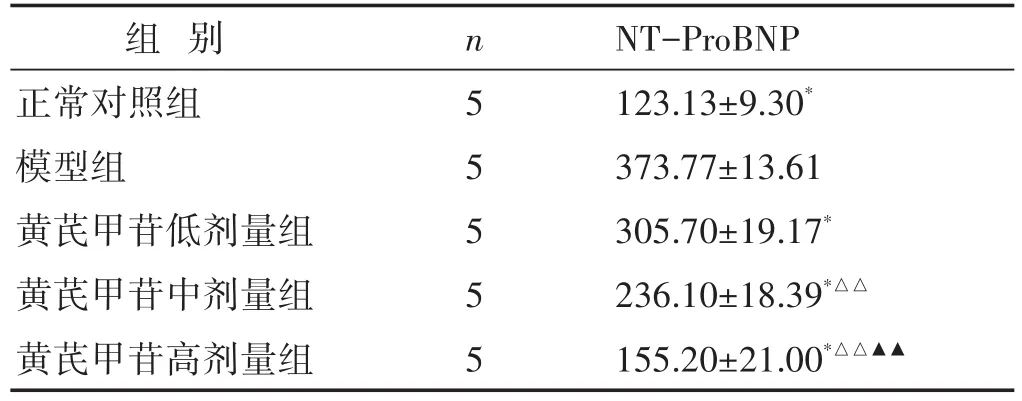
表2 各组大鼠血清NT-ProBNP表达水平比较(pg/mL,±s)
组别正常对照组模型组黄芪甲苷低剂量组黄芪甲苷中剂量组黄芪甲苷高剂量组n5 5 5 5 5 NT-ProBNP 123.13±9.30*373.77±13.61 305.70±19.17*236.10±18.39*△△155.20±21.00*△△▲▲
2.3 各组大鼠心脏组织CD31表达比较 见图2,表3。各组大鼠心肌组织微血管内皮细胞均可见绿色CD31表达。与正常对照组相比,模型组CD31表达量显著下降(P<0.05);与模型组相比,黄芪甲苷高剂量组CD31表达增加(P<0.05)。
表3 各组大鼠心肌组织CD31、vWF荧光表达量比较(%,±s)

表3 各组大鼠心肌组织CD31、vWF荧光表达量比较(%,±s)
组别正常对照组模型组黄芪甲苷高剂量组n5 5 5 CD31 13.10±0.50**4.99±0.60 10.62±1.80*vWF 2.65±0.29**13.04±0.47 4.39±0.82*
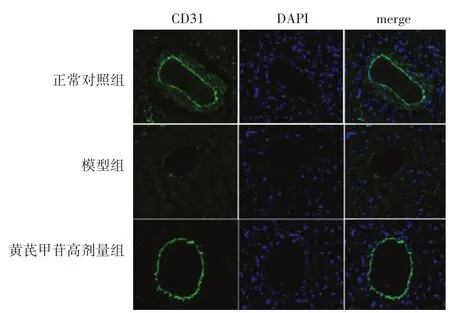
图2 各组大鼠心肌组织的CD31荧光染色(400倍)
2.4 各组大鼠心脏组织vWF表达比较 见图3,表3。大鼠心肌组织微血管内皮细胞可见绿色血管性血友病因子(vWF)的阳性表达。与正常对照组相比,模型组vWF阳性表达量显著增加(P<0.05);与模型组相比,黄芪甲苷高剂量组vWF的阳性表达降低(P<0.05)。
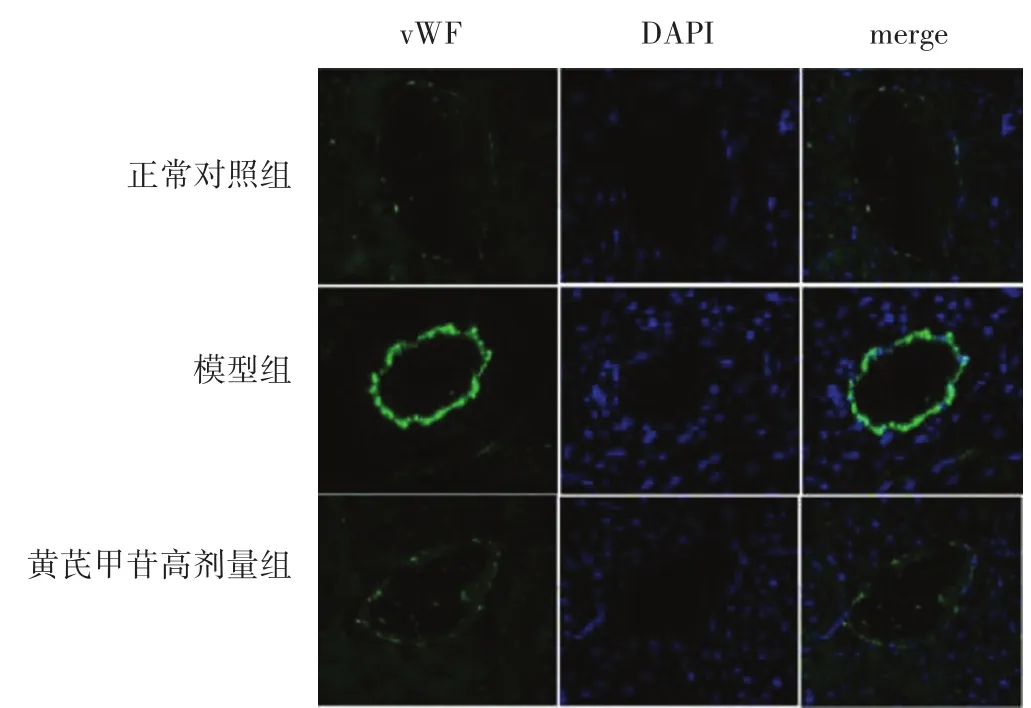
图3 各组大鼠心肌组织的vWF免疫荧光染色(400倍)
2.5 各组大鼠心脏组织VEGF表达比较 见图4,表4。各组大鼠心肌组织微血管壁周围可见VEGF蛋白表达。与正常对照组相比,模型组黄褐色颗粒显著减少,VEGF表达量显著降低(P<0.05);与模型组相比,黄芪甲苷高剂量组VEGF的蛋白表达增加(P<0.05)。
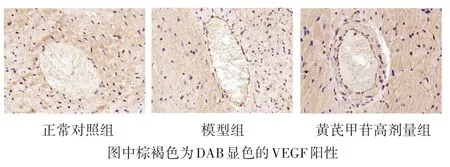
图4 各组大鼠心肌组织的VEGF表达(免疫组化染色,400倍)
表4 各组大鼠心肌组织VEGF、TNF-α、IL-6表达比较(%,±s)
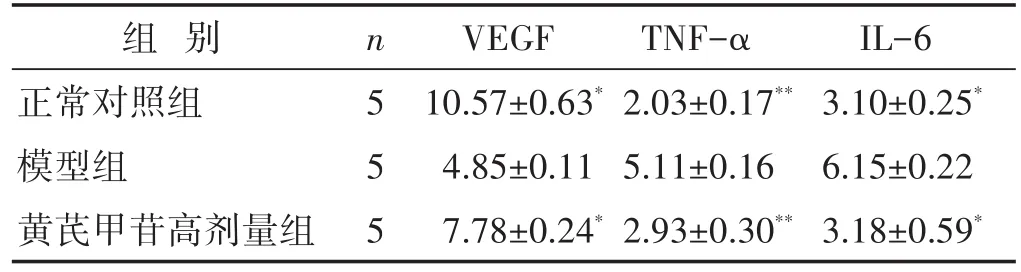
表4 各组大鼠心肌组织VEGF、TNF-α、IL-6表达比较(%,±s)
组别正常对照组模型组黄芪甲苷高剂量组n5 5 5 VEGF 10.57±0.63*4.85±0.11 7.78±0.24*TNF-α 2.03±0.17**5.11±0.16 2.93±0.30**IL-6 3.10±0.25*6.15±0.22 3.18±0.59*
2.6 各组大鼠心脏组织中TNF-α和IL-6表达比较 见图5,表4。各组大鼠心肌组织中内皮细胞周围均可见少量TNF-α、IL-6表达(黄褐色颗粒)。与正常对照相比,模型组TNF-α、IL-6蛋白表达明显增加(P<0.05);与模型组相比,黄芪甲苷高剂量组TNF-α、IL-6表达减少(P<0.05)。
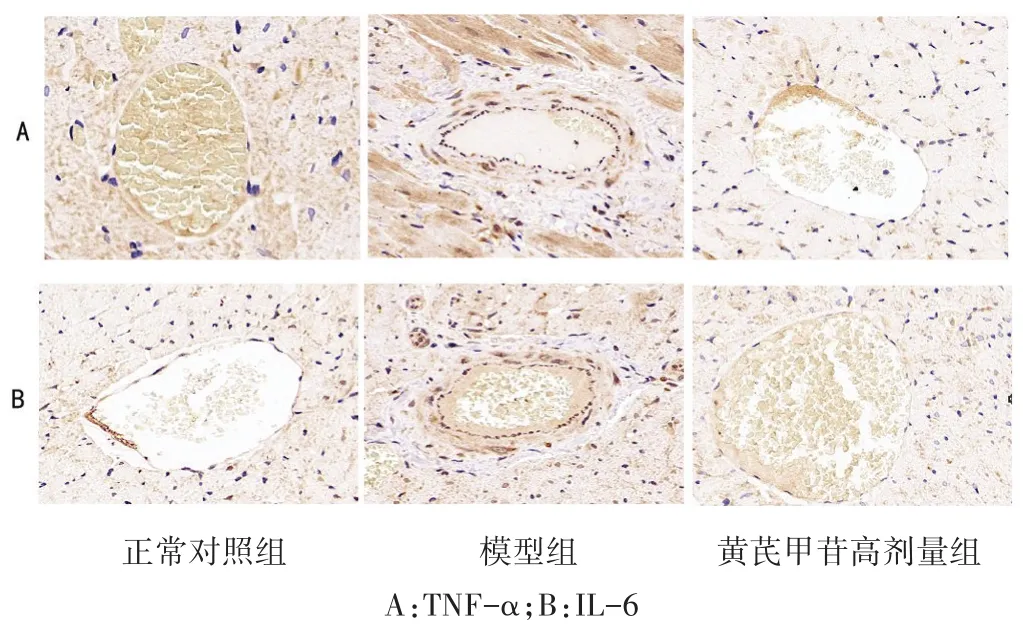
图5 各组大鼠心肌组织的TNF-α、IL-6表达(免疫组化染色,400倍)
3 讨 论
HFpEF发病率日益升高,且在一项急性失代偿性心力衰竭(ADHF)患者的抽样实验中发现ADHF住院趋势增加主要由HFpEF引起[8],以ACEI、ARB为代表的西药虽然具有血管保护作用,但多项荟萃分析显示对HFpEF预后没有明显改善[9]。因此探索中医药治疗,为HFpEF治疗提供更多思路具有重要意义。根据临床表现,HFpEF属于中医学的“心悸”“水肿”等范畴,主要病机为气虚水停[10],治疗多用“补气利水”之法。中药黄芪有补气固表、利尿生肌功效,可以改善HF症状,主要成分黄芪苷中黄芪甲苷生物学活性最好。黄芪甲苷具有促进血管生成、抑制心肌肥厚和纤维化等作用[11],但对于HFpEF的心脏保护作用及相关机制未见报道。
高盐摄入引起的高血压诱发全身性氧化应激和炎症状态,导致IL-6和TNF-α升高,在HFpEF患者的横断面研究中表达增多[12]。TNF-α和IL-6可抑制心肌细胞收缩,诱导炎症激活,引起微血管炎症和功能障碍。TNF-α通过调节环氧合酶2(COX-2)增加血管通透性,诱导内皮黏附分子的表达,增强白细胞与内皮细胞之间的黏附作用[13];IL-6发挥负性肌力作用,通过gp130/STAT3途径促进心肌细胞肥厚[14],导致组织损伤和心脏功能障碍。全身性炎症状态影响冠状动脉微血管内皮功能,HFpEF患者心肌活检样品中观察到的血管细胞黏附分子(VCAM)和E-选择素高表达为此提供证据[15]。vWF作为炎症的标志,是血管内皮标志物,也是血管功能障碍的指标。在一项HFpEF患者10年的长期随访实验中发现,vWF是HFpEF患者风险评估的潜在生物标志物[16]。黄芪甲苷通过激活自噬,减轻心肌肥大,减少炎症实现心脏保护作用,可以通过丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路抑制炎症和凝血介质的表达[17]。在一项异丙肾上腺素诱导的大鼠心肌损伤模型实验中发现黄芪甲苷可以有效抑制主动脉中 IL-1β、IL-6、TNF-α 的 mRNA 表达[18]。CD31位于中性粒细胞、血小板和内皮细胞的连接处,参与血管生成,是血管内皮细胞主要标志物之一,是反应侧支循环的最可靠指标[19]。VEGF在内皮生成中至关重要,通过VEGF R1/R2发出的典型VEGF信号传导调节几种酶的活性,最终参与血管生成过程。Lin Li等[20]发现黄芪甲苷可通过PPARγ依赖性方式将巨噬细胞从M1转化为M2表型,或激活PTEN/PI3K/Akt信号通路促进心肌梗死后的血管生成和心脏保护,促进血管生成,增加VEGF的蛋白质表达。
冠状动脉微血管内皮在全身炎症状态下产生活性氧(ROS),从而限制临近心肌细胞的一氧化氮(NO)生物利用度,导致心肌细胞中蛋白激酶G(PKG)活性降低。PKG活性降低导致心肌细胞肥大,左心室重塑,且由于细胞骨架蛋白低磷酸化使心肌细胞僵硬。心肌细胞僵硬和成纤维细胞增加引起胶原蛋白沉积,从而引起HFpEF舒张功能障碍[21]。
本实验中模型组大鼠较正常对照组LVEF值明显降低,但仍大于50%,收缩功能未受到明显影响,黄芪甲苷低、中、高剂量组与模型组相比,IVSd降低,说明黄芪甲苷可以改善心肌收缩功能、减轻心肌肥厚。黄芪甲苷低、中、高剂量组较模型组血清BNP和NT-ProBNP降低,心肌细胞排列较整齐,血管壁结构完整规则,提示黄芪甲苷对心脏功能有保护作用,且黄芪甲苷高剂量组大鼠与模型组相比,vWF的阳性表达明显减少,说明黄芪甲苷可以改善心脏内皮细胞功能,能够抑制内皮细胞损伤以后诱发的一系列反应,有效缓解心脏微循环障碍,减缓HFpEF的进一步发展,改善HFpEF预后。与模型组相比,黄芪甲苷高剂量组的TNF-α和IL-6蛋白呈现不同程度的下降,说明黄芪甲苷能够减少炎症发生,改善内皮细胞功能,减缓HFpEF的发展进程。与模型组相比,黄芪甲苷高剂量组的VEGF蛋白增多,表明高剂量黄芪甲苷能够改善内皮细胞功能,减缓HFpEF的发展进程。
本实验验证了黄芪甲苷对HFpEF模型大鼠的心脏功能具有保护作用,为HFpEF的治疗提供实验依据。黄芪甲苷高剂量组与模型组比较,结果提示黄芪甲苷对HFpEF模型大鼠心脏保护功能可能与抑制心肌组织炎性反应、改善心肌微血管功能和心肌损伤有关,但因HFpEF疾病本身异质性,相关机制仍需进一步探讨。
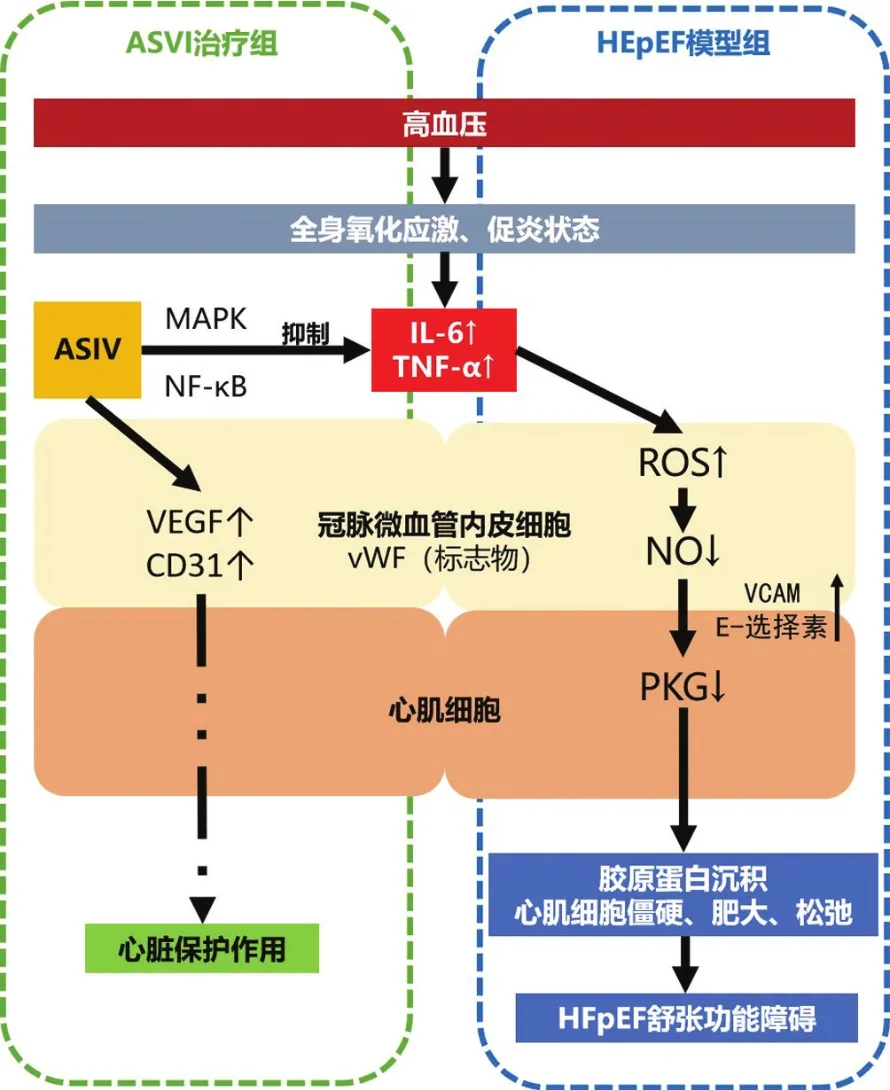
图6 实验机制图

