甜樱桃种子快速萌芽及组培成苗技术研究
董 军,洪 莉,陈令会,阮梦雅
(台州市农业科学研究院,浙江 台州 317000)
甜樱桃(Prunus aviumL.)属于蔷薇科(Rosaceae)落叶果树,是一种重要的经济水果,营养保健价值较高,素来享有“果中珍品”和“春果第一枝”的美誉,深受消费者的喜爱,目前浙江等南方地区已成为甜樱桃种植的热门选地之一[1-2];但是由于浙江等地夏季高温高湿、冬季需冷量不足会严重制约甜樱桃品种的选育工作,甜樱桃对生长环境有着极其严格的要求,常规育种方式速度较慢,可采用组织培养技术有效解决[3-4]。
常规樱桃实生苗的培育一般采用冬季沙藏的方法进行繁殖,也可通过4 ℃冰箱冷藏处理打破休眠,一般情况下每年5—6月成熟采收甜樱桃种子必须经过90~100 d低温层积才能打破种子休眠,保证种子出苗[3-5]。近年来,为保证种子的正常萌发,科研人员大多利用赤霉素(GA)等植物激素处理的方式来促进种子萌发,并且可在当年获得第一代种苗,但是其中所用的激素种类、浓度及培养条件相差较大[6-9]。胚培养是人们利用植物体胚具有细胞全能性的特点来进行人工离体培养的一种繁殖技术,胚培养能够提高成苗率,缩短育种周期,进一步加快育种进程[10]。胚培养在早熟葡萄胚抢救中的应用较为成熟[11],在早熟的李子和杏子的幼胚培养中也有一定应用[12]。
洪莉等[13]在甜樱桃种子快速萌芽育苗试验研究过程中发现赤霉素(GA)对打破种子休眠、萌芽有较好的促进效果,其效果远大于6-苄氨基阿腺嘌呤(6-BA)等植物激素。故本试验以甜樱桃种子为试材,将传统的低温层积、赤霉素处理等技术与胚培养技术相结合,筛选出促进甜樱桃种子快速萌发及生长的最佳条件,建立一套稳定、高效的萌芽培养体系,旨在借助于现代生物育种技术提高育种效率。
1 材料与方法
1.1 试验材料
试验材料来源于台州市农业科学研究院的早罗宾、布鲁克斯、红蜜等甜樱桃种子,取其种子为外植体,取材时间为2022年5月。
1.2 试验方法
1.2.1 种子萌芽处理 开始选择转色期至成熟期的甜樱桃果实,去除果肉,选取颗粒饱满圆润的甜樱桃种子,用锤子敲掉外壳,放入灭菌的三角瓶内,再加入几滴1%的聚山梨酯-80溶液,然后用0.1%的氯化汞溶液浸没种子消毒,接种于1/2MS培养基上,接种过程中保证种子横置半埋于培养基中。设置GA浓度分别为0、50、100、200、400 mg/L,6-BA浓度为2 mg/L,生长素(IBA)浓度为1 mg/L,分别置于4 ℃透明冰箱(处理T1~T5)和24 ℃恒温培养室(处理T6~T10)中进行培养,每种处理10瓶,每瓶接种种子3~5个,处理3周后统计种子污染率、萌芽率、生长情况等。
参照上述种子处理方法将去除果肉后的甜樱桃种子置于室内阴干,然后放入纱网袋内,于4 ℃冰箱中储存备用。储存5周后进行种子萌芽率的比较,然后经处理后3周调查萌芽率、生长状况等。
1.2.2 种苗增殖培养 首先将萌芽的种苗接种到不含激素的增殖培养基上进行继代培养1~2次,以MS培养基为基础培养基,pH值为5.6。然后选取生长一致、健壮良好的种苗接种到含有不同浓度6-BA的培养基中,设置增殖培养基T11~T15共5种处理方式,每个处理中生长素(IBA)、萘乙酸(NAA)的浓度均为0.1 mg/L,6-BA浓度分别为0、0.25、0.50、0.75、1.00 mg/L。每 种 处 理 接 种 约10瓶,每瓶接种3~5株,并进行统计记录种苗的增殖系数、生长状况等。
1.2.3 种苗生根培养 将继代苗转接到不含激素的空白培养基中培养1~2代,以1/2MS培养基为基础培养基,随后选取生长一致、健壮,株高1.5~3.0 cm的种苗接种到生根培养基,试验设置生根培养基种类T16~T20共5种处理方式,生长素IBA的浓度分别为0、0.3、0.6、0.9、1.2 mg/L,每个处理中萘乙酸(NAA)的浓度均为0.1 mg/L。每种处理方式接种10瓶,每瓶接种3~5株,将接种的培养基放入培养室培养,并统计瓶苗的生根长度、生根率以及生长状况等(表4)。
2 结果与分析
2.1 不同激素及温度处理对种子萌芽率的影响
由表1可知,温度和GA激素浓度对樱桃种子萌发有较大影响。3周后,4 ℃条件下GA浓度为100 mg/L(T3)时种子萌芽率最高,达到73.33%;然后随着GA浓度的增加,甜樱桃种子的萌发率开始下降。3周后,24 ℃条件下,GA浓度为400 mg/L(T10)时的种子萌芽率达到最高(68.67%);增加GA浓度对甜樱桃种子萌芽产生较大影响,在一定范围内提高GA浓度可以明显提高种子萌芽率。T1和T6表明,在低温或室温条件下,仅添加6-BA、IBA处理对于甜樱桃种子萌芽效果较差,添加合适范围浓度的GA可以促进甜樱桃种子快速萌芽。随后通过4~5周的研究结果发现,4 ℃条件下,5周时T3、T4的樱桃种子萌芽率超过90%,T5的种子萌芽率开始下降,说明GA浓度超过200 mg/L后对樱桃种子的萌芽率无促进作用,甚至会抑制其发芽;24 ℃条件下,各处理的甜樱桃种子萌芽率普遍不高,提高幅度较小,萌芽率基本稳定在50%~70%,不同浓度的GA对种子萌芽率的促进作用不显著。4 ℃条件下的萌芽不存在子叶增生、易污染等问题,综合考虑,采用4 ℃+100 mg/L GA为最佳处理,可以促进甜樱桃种子快速萌芽,并且萌芽率最高可超过90%。

表1 不同浓度激素及温度处理对种子萌芽的影响
2.2 激素处理对储藏过久甜樱桃种子萌芽率的影响
由表2可知,适当浓度的激素处理可以提高储藏时间过久的甜樱桃种子萌芽率,4 ℃冰箱储存5周后,甜樱桃种子萌芽率呈现较低水平,品种间萌芽率同样存在差异,布鲁克斯的种子萌芽率整体高于红蜜的。随着GA浓度的提高,甜樱桃种子萌芽率不断提高,当GA浓度为400 mg/L时,红蜜和布鲁克斯的种子萌芽率均达到最高,分别为7.12%和9.49%;但红蜜、布鲁克斯的种子萌芽率均不超过10.00%,大部分处理的种子都未出现明显萌动,少部分种皮破裂,还需要一段时间后种子才能正常萌发。综上所述,储藏时间太长会对甜樱桃种子萌芽率产生负面的影响,萌芽率普遍整体偏低;去除果肉后及时用适当浓度的激素处理,可以有效提高甜樱桃种子的萌芽率。

表2 激素处理对储藏时间过久甜樱桃种子萌芽率的影响
2.3 不同增殖培养基对甜樱桃种苗生长的影响
由表3可知,在一定浓度范围内提高6-BA浓度可以有效进行增殖培养。种苗在T23~T25的培养基里增殖系数都超过2.00,其中T24的种苗增殖系数最高,达3.20,且该培养基内的种苗生长较快旺盛,叶片嫩绿;但当6-BA浓度超过0.75 mg/L,樱桃种苗的增殖开始受到抑制,增值系数下降,导致种苗生长不良,出现叶片皱缩,叶片脆硬甚至玻璃化的现象。综合考虑,采用T24培养基,即MS+0.75 mg/L 6-BA+0.1 mg/L NAA为甜樱桃种苗生长的最佳增殖培养基。
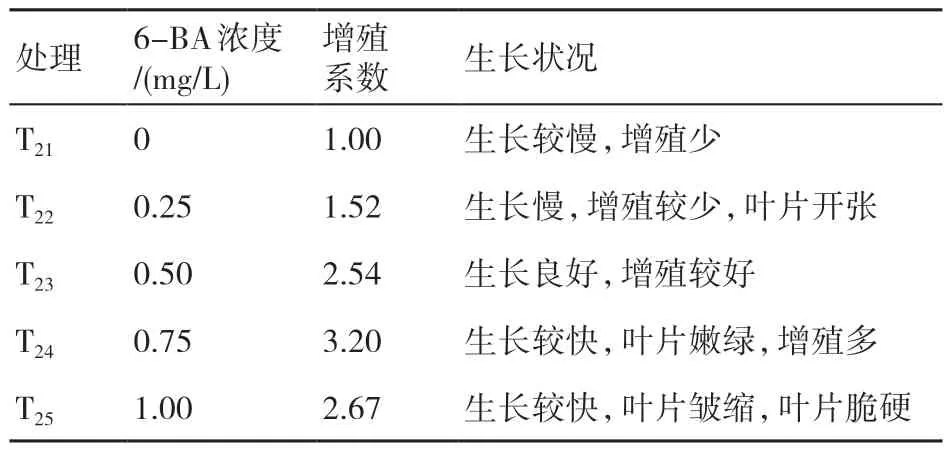
表3 不同增殖培养基对甜樱桃种苗生长的影响
2.4 不同生根培养基对甜樱桃种苗生根的影响
由表4可知,在一定范围内随着IBA浓度增加,甜樱桃种苗生根率逐渐增大,根数增多,根长增大。T29的甜樱桃种苗生根率达到最高,为75.0%,根数也较多,且该培养基内的种苗生根速度快,一般14 d左右有根长出,根系生长状况良好,粗细适中,须根较多;T26培养基中甜樱桃种苗的生根率最低,长根速度慢甚至是不长根的情况。由此可见,适当浓度的IBA处理可以促进甜樱桃种苗的生根,当IBA浓度为0.9 mg/L时,其种苗的生根系数达到最高,生长态势最好,综合考虑,采用T29培养基,即1/2MS+0.9 mg/L IBA+0.1 mg/L NAA为最佳培养浓度。

表4 不同生根培养基对甜樱桃种苗生根的影响
3 结论与讨论
甜樱桃胚培养是解决甜樱桃胚萌芽率低的有效途径,通过胚培养可以获得大量的种苗来进行嫁接扩繁,比常规育种缩短1~2年的周期,胚培养作为一种育种手段可有效提高育种效率。
胚萌发是胚培养技术的第一步,胚萌发的最佳培养条件因材料而异。本试验表明,GA对甜樱桃种子萌芽具有促进作用,GA与6-BA、IBA配合使用可以有效打破种子休眠、促进种子萌芽,其效果相较于单独使用6-BA、IBA更加显著;在4 ℃条件下,浓度为100 mg/L GA处理3周后的种子萌芽率达到73.33%,5周后的萌芽率可以超过90%。张琛等[14-17]用6-BA等激素进行处理同样获得了很高的种子萌芽率,与本试验的研究结果不一致;本试验前期研究发现GA促进甜樱桃种子萌芽的效果更好,6-BA打破种子休眠、促进萌芽的效果一般。赵艳华等[15]研究认为无论在低温还是常温条件下均可以促进甜樱桃的胚萌发。本研究发现常温条件可以促进已萌芽的种子正常生长,但是高浓度的GA会导致甜樱桃种子出现子叶过快裂开、子叶加厚增生等问题,不利于种子萌芽后的生长,需及时将种苗转接到增殖培养基中。本研究还发现甜樱桃种子储存时间过长会对种子萌芽率产生不利影响,去除果肉后及时做保湿处理是保证甜樱桃种子正常萌芽的首要条件。综上认为,甜樱桃种子采收后及时采用适宜浓度GA处理,辅以低温条件,可有效促进甜樱桃种子快速萌芽。
郑玮[18]研究认为不同基因型甜樱桃茎尖培养成活率差异较大,这与本文的不同品种的甜樱桃种子在相同增殖培养基中的增殖系数存在差异的研究结果类似。本研究发现高浓度6-BA(≥1.0 mg/L)会导致植株出现叶片皱缩卷曲、叶片脆硬等现象;同样6-BA浓度(≤0.5 mg/L)过小会导致植株存在生长缓慢、增殖不足等问题。与秦志华等[16-17]研究认为的高浓度6-BA对甜樱桃的增殖效果不利,甚至会导致植株玻璃化现象产生的结果相似。本研究发现MS+0.75 mg/L 6-BA+0.1 mg/L IBA+0.1 mg/L NAA配置最佳,该处理的增殖效果较好,增殖系数达3.2,种苗健壮、生长旺盛。一定范围内随着IBA浓度的增加生根率逐渐提高。本研究生根培养基以1/2MS+0.9 mg/L IBA+0.1 mg/L NAA配 置 为 最佳,生根率达75.0%。一定范围内提高IBA浓度对于提高生根率有明显的促进作用;低浓度的IBA需要延长生根培养时间才能保证正常的生根率,过长的培养时间会导致种苗营养不足,长势减弱,不利于后期炼苗移栽。
传统方法认为甜樱桃等核果类种子需要一定时间的低温来打破休眠才能保证其萌芽率,本试验通过“低温+激素”处理来解决了种子休眠和萌芽率低的问题,通过组织培养的方式对种苗进行组织扩增,提高了育种效率,对于缩短甜樱桃新品种选育周期具有一定参考借鉴作用。

