伴代谢综合征精神分裂症患者肠道菌群多样性分析☆
邢梦娟 盛嘉玲 朱丽萍 陆颖 施凯 卢卫红
代谢综合征(metabolic syndrome,MetS)是精神分裂症患者最常见的代谢相关疾病,也是患者主要的致死因素[1],然而精神分裂症患者发生MetS的机制尚不明确。动物研究发现高脂饮食饲喂引起肥胖的小鼠肠道微生物组成也显著改变[2]。临床研究发现2型糖尿病患者肠道菌群的构成显著改变[3],还有研究发现肠道菌群构成发生变化早于肥胖的发生[4],因此,代谢紊乱与肠道菌群相关性的研究倍受关注[5]。然而,目前精神分裂症伴MetS患者的肠道菌群特征尚未见报道。本研究用高通量测序检测伴与不伴MetS的精神分裂症患者肠道菌群16S rRNA,探索其肠道菌群特征,为精神分裂症患者伴MetS的临床诊治和预防提供参考。
1 对象与方法
1.1 研究对象选取2021年6-12月在上海市第一民政精神卫生中心住院的慢性精神分裂症老年男性患者。入组标准:①符合《美国精神障碍诊断与统计手册第五版》(Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, DSM-5)精神分裂症诊断标准;②年龄55~79岁;③病程≥10年,且维持目前抗精神病药物治疗方案半年以上;④血常规检查在正常范围。排除标准:①患有严重躯体疾病,如心肌梗死、脑梗死或感染;②近2个月内有腹泻;③近2个月内使用过抗生素或益生菌类药物;④存在精神活性物质滥用或成瘾物质依赖;⑤共病符合DSM-5诊断标准的其它精神疾病。
根据是否伴有MetS将患者分组。MetS定义为符合以下标准的3条或以上:①肥胖,腰围(WC)≥90 cm;②高血糖,空腹血糖(FPG)≥6.1 mmol/L和(或)确诊为糖尿病并治疗者;③高血压,收缩压/舒张压≥130 mmHg/85 mmHg和(或)已确诊为高血压并治疗者;④甘油三酯(TG)≥1.7 mmol/L;⑤高密度脂蛋白胆固醇(HDL-c)≤1.03 mmol/L。
共入组115例患者,其中伴MetS组57例,不伴MetS组58例。所有患者或监护人签署知情同意书。本研究方案通过了上海市第一民政精神卫生中心伦理委员会的伦理审查(编号:YJZXLL2022022)。
1.2 研究方法
1.2.1 肠道菌群DNA提取和16S rRNA测序 使用无菌粪便取样器截取中段里部新鲜粪便3 g,置于5 mL EP离心管-20°C保存。肠道菌群基因组DNA使用CTAB法进行提取,随后检测DNA的纯度和浓度(1%琼脂糖凝胶电泳法),使用无菌水将样本的终浓度调整为1 ng/μL。对细菌V3-V4可变区的高保守序列进行PCR扩增,使用美国Bio-Rad公司的T100PCR仪器。将扩增的PCR产物用2%琼脂糖凝胶电泳纯化,然后对目标条带割胶回收(Qiagen,Qiagen 胶回收试剂盒)。使用Illumina公司的建库试 剂 盒(Illumina, USA,TruSeq®DNA PCR-Free Sample Preparation Kit)构建文库,以及用Qubit定量和检测构建好的文库。文库合格后在NovaSeq 6000 PE250进行上机测序。测序由深圳微科盟生物科技有限公司完成。
1.2.2 生物信息学分析 使用QIIME2 dada2软件对测序结果进行质控和修剪、去噪、拼接、去除嵌合体,得到用于生物信息学分析的特征序列表格[6]。将扩增子序列变异(amplicon sequence variants,ASV)的代表序列比对到预先训练好的GREENGENES数据库(13_8版本99%相似度)得到物种的分类信息表[7]。应用ANCOM、ANOVA、Kruskal Wallis、LEfSe和DEseq2等方法鉴定两组样本间丰度有差异的细菌[8-10]。对检测得到的操作分类单元(operational taxonomic units,OTUs)使用Wilcox检验进行测序质量的评估。采用观察到的OTUs(observed OTUs)指数、Faith系统发育多样性指数(Faith’s phylogenetics index, Faith_pd index)、Shannon指数等α多样性指数评估样本的多样性程度。采用Bray Curtis指数、非加权 UniFrac(unweighted UniFrac)指数等β多样性指数评估两组微生物群落结构差异性。微生物群落与相关环境因子间的潜在关联使用冗余分析(RDA)方法进行分析,应用PICRUSt2预测微生物群体可能的功能组成。
1.3 统计学方法应用SPSS 22.0对数据进行统计学分析。两组人口学资料及临床资料采用均数±标准差(±s)描述,组间比较采用独立样本t检验或Mann-WhitneyU检验。分别采用Kruskal-Wallis法和ANOSIM法比较两组患者肠道菌群的α和β多样性指数。应用线性判别分析效应大小(LEfSe)方法比较两组患者肠道菌群物种类别。肠道菌群与空腹血糖、血脂、血压等代谢指标的相关性采用Spearman相关分析。MetaCyc通路的比较首先采用ANOVA检验,经错误发现率法校正后结果存在统计学意义时,再进一步做Duncan检验。双侧检验,α=0.05。
2 结果
2.1 基本情况两组患者年龄和舒张压无统计学差异(P>0.05)。两组的腰围(t=62.648,P<0.001)、空腹血糖(t=19.198,P<0.001)、收缩压(t=10.188,P=0.002)、高密度脂蛋白(t=38.166,P<0.001)和甘油三酯(t=24.840,P<0.001)水平有统计学差异,见表1。
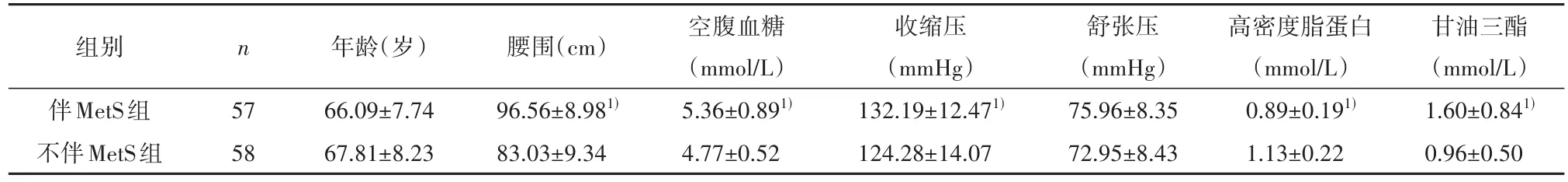
表1 伴MetS组与不伴MetS组患者的基本情况
2.2 测序分析质控及物种注释与评估图1示菌落Rank-Abundance曲线的形状平缓,表明样本的菌群群落均匀度和丰富度良好。该结果提示测序结果有效可靠,可进行后续分析。
图1 Rank-Abundance稀疏性曲线评估样本测序的质量 A为对全体115例样本测序的OTU结果进行分析来评估测序的质量,B为对两组样本测序的OTU进行分析来评估测序的质量。
2.3 菌群α和β多样性分析两组α多样性指标中的 observed OTUs指数(H=3.811,P=0.051)和Faith_pd指数(H=2.920,P=0.088)差异无统计学意义,而综合指数Shannon指数(H=6.853,P=0.009)差异有统计学意义。见图2A。

图2 两组精神分裂症患者肠道菌群的α和β多样性分析 A为肠道菌群α多样性分析,B为肠道菌群β多样性分析。ns,差异无统计学意义(P>0.05);*,差异有统计学意义(P<0.05)。
PCoA分析示,两组的β多样性指数Bray Curtis距离(R=0.140,P=0.001)和非加权Unifrac距离(R=0.083,P=0.003)存在统计学差异。见图2B。
2.4 肠道菌群群落结构差异分析伴MetS组精神分裂症患者粪便拟杆菌门(Bacteroidetes)(LDA=4.158,P=0.015)、变形菌门(Proteobacteria)(LDA=3.992,P=0.031)及协同菌门(Synergistetes)(LDA=2.605,P=0.032)的相对丰度高于不伴MetS组患者;扁桃菌门(Lentisphaerae)(LDA=2.025,P=0.007)、梭杆菌门(Fusobacteria)(LDA=2.967,P=0.031)、厚壁菌门(Firmicutes)(LDA=4.486,P=0.001)及 CD12菌门(LDA=2.826,P=0.045)、SBR1093菌门(LDA=2.759,P=0.024)、GN04(LDA=2.373,P=0.004)、OP8菌门(LDA=2.226,P=0.002)及 NC10菌门(LDA=2.181,P=0.036)的相对丰度低于不伴MetS组患者。见图3。
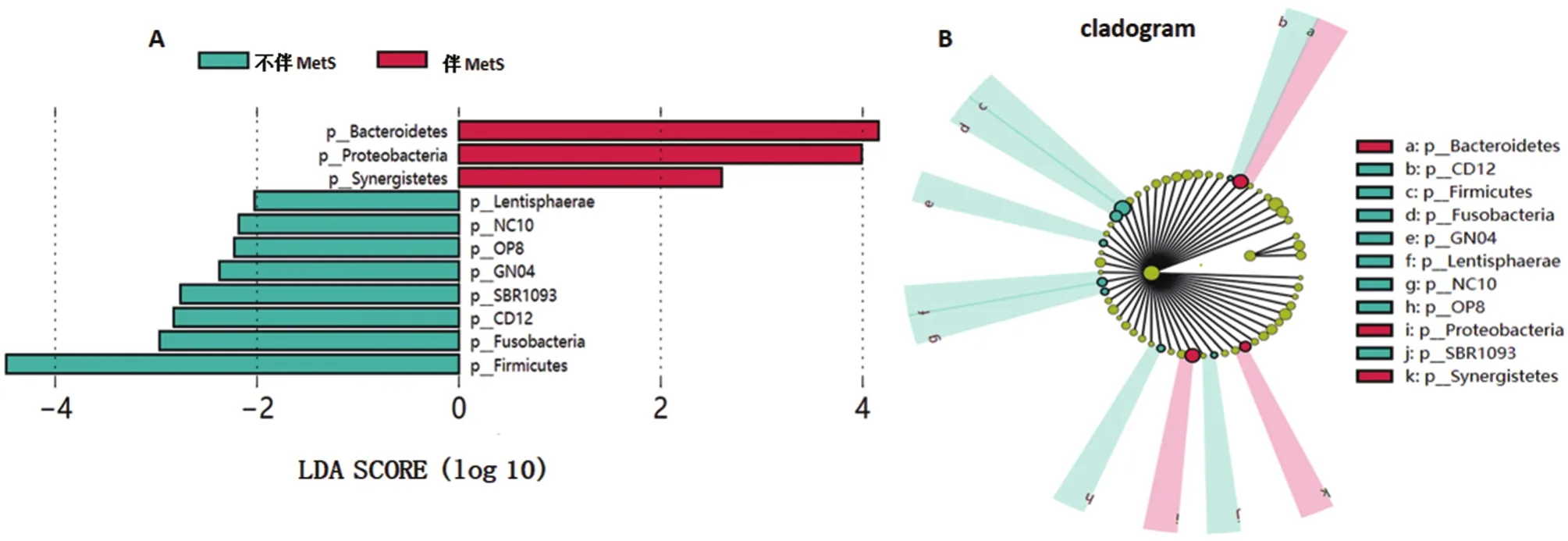
图3 两组的肠道菌群丰度差异 A为对LDA≥2的分类群进行可视化;B为物种分类分支图,展示两组在门水平丰度差异最大的菌群。
2.5 菌群多样性关联分析所有患者空腹血糖与疣微菌门(Verrucomicrobia)(r=-0.215,P=0.021)、梭杆菌门(Fusobacteria)(r=-0.212,P=0.023)、扁桃菌门(Lentisphaerae)(r=-0.101,P=0.018)呈负相关,与OP3菌门呈正相关(r=0.187,P=0.046)。收缩压与厚壁菌门(Firmicutes)(r=-0.256,P=0.006)、协同菌门(Synergistetes)(r=-0.204,P=0.028)呈负相关关系,与螺旋菌门(Spirochaetes)(r=0.245,P=0.008)、氯菌门(Chlorobi)(r=0.202,P=0.030)、硝化螺旋菌门(Nitrospirae)(r=0.245,P=0.008)呈正相关。舒张压与硝化螺旋菌门(Nitrospirae)呈正相关(r=0.226,P=0.015)。HDL-c与OP3菌门(r=-0.218,P=0.019)及GAL15菌门(r=-0.230,P=0.014)呈负相关,与梭杆菌门(Fusobacteria)(r=0.234,P=0.012)、SAR406菌门(r=0.197,P=0.035)、OP8菌门(r=0.268,P=0.004)呈正相关。TG与疣微菌门(Verrucomicrobia)(r=-0.296,P=0.001)、梭杆菌门(Fusobacteria)(r=-0.209,P=0.025)呈负相关。见图4。
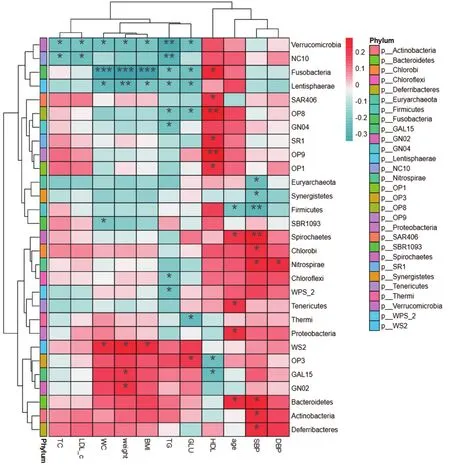
图4 精神分裂症患者MetS组份与门水平肠道菌群丰度的相关性热图 *表示MetS组份与菌群丰度存在统计学相关性(P<0.05),红色表示正相关性,蓝色表示负相关性。
2.6 肠道菌群代谢通路的差异分析利用PICRUSt2对两组精神分裂症患者的肠道菌群进行MetaCyc代谢通路的功能预测。MetaCyc途径主要富集在生物合成途径,如氨基酸生物合成、核苷生物合成等生物途径。两组间6条MetaCyc途径的代谢差异存在统计学意义(P<0.001),包括乙酸盐产甲烷途径(METH-ACETATE-PWY),嘌呤核碱降解I(厌氧)途径(P164-PWY),腺苷核苷酸降解IV途径(PWY-5532),甘油降解为丁醇途径(PWY-7003),钴(II)酰亚胺a,c-二酰胺的生物合成I(早期钴插入)途径(PWY-7377),硝酸盐还原 VI(同化作用)途径(PWY490-3)。见表2。

表2 伴MetS组与不伴MetS组在MetaCyc通路上存在统计学差异的通路
3 讨论
微生物组是人类健康的关键调节器,被认为是人体的“基本器官”,在维持健康中发挥非常重要的作用[11]。本研究发现一些有意义的结果,如伴与不伴MetS的精神分裂症患者肠道菌群分布存在显著差异,肠道菌群与空腹血糖、血脂、血压等存在相关性,机制预测发现肠道菌群可能通过影响糖代谢途径、脂代谢途径和氨基酸代谢途径引起精神分裂症患者出现MetS。
既往研究发现肥胖患者(患或不患2型糖尿病组)在减重手术3个月后,两组粪便菌群的α多样性增加,而β多样性下降至接近健康者[12]。另有研究发现,相对于正常对照,2型糖尿病患者的肠道菌群结构紊乱,且微生物数量和多样性下降[13-14]。本研究也发现伴与不伴MetS两组患者存在肠道菌群的多样性分布差异,这与既往的研究结论一致,提示不同代谢状态存在肠道菌群的多样性分布差异。
在肠道菌群与糖尿病的研究中发现,前驱期糖尿病或2型糖尿病患者比正常血糖人群表现较低丰度的疣微菌门[15]。本研究结果发现空腹血糖与疣微菌门、梭杆菌门及热敏菌门等存在负相关关系,这在一定程度上与之前的研究结果相一致。然而,有研究提出糖尿病患者与非糖尿病人群的梭杆菌门并无差异[16]。本研究结果与之并不一致,分析出现肠道菌群构成差异的可能原因是:其一,代谢综合征的代谢紊乱与糖尿病的代谢异常并不完全一致;其二,精神分裂症患者与正常人群相比本身呈现特异性的肠道菌群分布特征;其三,精神分裂症伴MetS多因素相互作用也可能干扰肠道菌群的菌落结构。
有研究发现高血压患者的厚壁菌门与拟杆菌门比例升高,肠道微生物的丰富度降低,在预防动脉粥样硬化中有非常重要的作用[17]。本研究发现厚壁菌门、拟杆菌门、放线菌门及去铁杆菌门等与血压相关,在一定程度上支持肠道菌群在高血压中的作用。其它研究还发现肠道菌群在肥胖形成过程中有重要作用[18],如研究发现高脂膳食导致肥胖鼠肠道中厚壁菌门丰度增加、拟杆菌门丰度下降[19]。
生理状态下,肠道微生物定殖于肠道粘膜表面以保持其正常的生理功能。高脂饮食摄入可引起肠道微物紊乱,表现为拟杆菌门丰度降低,厚壁菌门丰度增加,使肠道通透性增加,更多内毒素进入血液,导致各种炎症,进而引起肥胖和胰岛素抵抗等代谢相关疾病的形成[20]。本研究也发现肠道菌群与血脂存在一定的相关性,如HDL-c与梭杆菌门丰度存在负相关性,TG与疣微菌门、梭杆菌门等呈负相关关系,以及TC和LDL-c与疣微菌门等存在负相关关系,综上结果提示肠道菌群在精神分裂症患者的血脂代谢紊乱中可能具有作用。
本研究也存在一定的局限性。如研究对象仅来自于一个医疗中心,可能代表性欠佳。本研究是横断面的数据分析,无法解释MetS与肠道微生物多样性间的因果关系。此外,本研究的对象为老年男性患者,由于性别也是引起肠道菌群分布差异的重要因素[21],因此,将本研究结论推广到精神分裂症女性患者中需要谨慎。同时必须指出的是,本研究的对象是老年群体,年龄与代谢状态和代谢效率是明确相关的,本研究结论如果推广到非老年群体中需要进一步地研究论证。
综上所述,本研究探索了伴MetS精神分裂症患者的肠道菌群多样性差异,并对肠道菌群在MetS的作用进了初步探索,识别出了伴MetS精神分裂症患者的肠道菌群特征,为后续MetS的防治与诊断提供了可供参考的方法,也为深入研究精神分裂症伴MetS的机制研究提供部分建议。

