果糖二磷酸钠注射剂质量评价与研究
刘冰滢,穆矛,邓锋,梁蔚阳,薛巧如
广东省药品检验所,广东 广州 510663
20 世纪初,有研究者在研究糖代谢机理时完成了1,6-二磷酸果糖(fructose-1,6-diphosphate,FDP)的分离和鉴定[1]。1942 年,美国Neuberg 等利用新鲜酵母细胞使葡萄糖磷酸化制备了果糖二磷酸钠[2]。国内上海新亚药业有限公司首家仿制并获得批准文号,之后陆续有多家企业研究开发了此品种,临床应用进一步稳固并扩大。多项研究表明,果糖二磷酸钠对人体代谢调节具有多种功能,静脉注射果糖二磷酸钠盐可用于心肌缺血疾病的辅助治疗[3-6]。果糖二磷酸钠剂型有无菌分装粉针、大输液、口服液、片剂,胶囊等。
果糖二磷酸钠系列产品为非基本药物品种,是医保目录的乙类目录品种。截至2016 年11 月,国内共40 家企业生产果糖二磷酸钠注射制剂,批准文号80 个;其中,注射液17 家,批准文号26 个,2 个规格;注射用粉针23 家,批准文号54 个,4个规格。本次抽取的果糖二磷酸钠注射液样品共计55 批,涉及5 家生产企业,8 个批准文号,2 种规格(50 mL∶5 g;100 mL∶10 g);注射用果糖二磷酸钠63 批,涉及10 家生产企业,22 个批准文号,4 种规格(2.5 g;5 g;7.5 g;10 g)。抽样分布于全国21 个省份,其中生产单位抽样21 批,医疗机构抽取 41 批,在经营单位抽取56 批,样品确认率为100%,均为标示企业产品。
1 仪器与关键试剂
仪器:UV-2550 紫外可见分光光度计(日本岛津仪器有限公司);E2695 型高效液相色谱仪,包括紫外检测器、Empower 3 数据处理软件等(Waters 公司);SOLAAR M6 型原子吸收分光光度计(Thermo,GF95 型石墨炉,FS95 自动进样装置);石墨管(Thermo Coated Graphite);KY-Ⅱ型AL 空心阴极灯(北京曙光明电子光源仪器有限公司,灯号:3931);离子色谱仪(Thermo Dionex ICS-5000);电子天平(Sartorius CPA225D);pH 计(Sartorius PB-10);水分测定仪(Metrohm 756)。
关键药品和试剂:固体复合酶(北京众宜隆润科技有限公司,批号LRY2016110102);磷酸二氢钾对照品(中国食品药品检定研究院,批号100745-201503,含量100%)。
2 质量标准
照国家药品标准WS1-(X-063)-2001Z-2011和WS1-(X-064)-2001Z-2011 分别测定果糖二磷酸钠注射液和注射用果糖二磷酸钠。
3 结果与分析
3.1 现行质量标准检验
果糖二磷酸钠注射液按现行质量标准检验共发现10 批不合格,占注射液抽样总数的18.2%,涉及的生产企业2 家,不合格项目均为游离磷酸盐。注射用果糖二磷酸钠有1 批不合格,占注射用粉针抽样总数的1.6%,涉及生产企业1 家,不合格项目为热原。
3.1.1 游离磷酸盐55 批次果糖二磷酸钠注射液共有10 批次游离磷酸盐测定结果不符合规定,涉及2家生产企业;注射用粉针该项目均符合规定,具体结果见图1。目前法定标准采用比色法检测游离磷酸盐,在酸性介质中,正磷酸盐与钼酸铵反应,生成磷钼杂多酸,经亚硫酸钠等还原剂将其还原生成蓝色络合物。此方法简单、方便,重复性较好。检验过程中发现不合格的产品均来自医疗单位和流通领域。不合格批次中标示批号为1505242101 和1506120562 两批流通领域抽样产品,在生产企业也抽检到该2 批次样品,其游离磷酸盐检查却符合规定。不合格批次的样品集中在2 家生产企业,其余企业的所有样品均符合规定。经调研了解到不合格企业采用热处理辅助灭菌加除菌过滤的生产工艺,而其他3 家生产企业则均采用无菌生产工艺,提示热处理可能是游离磷酸盐含量超限的原因之一。
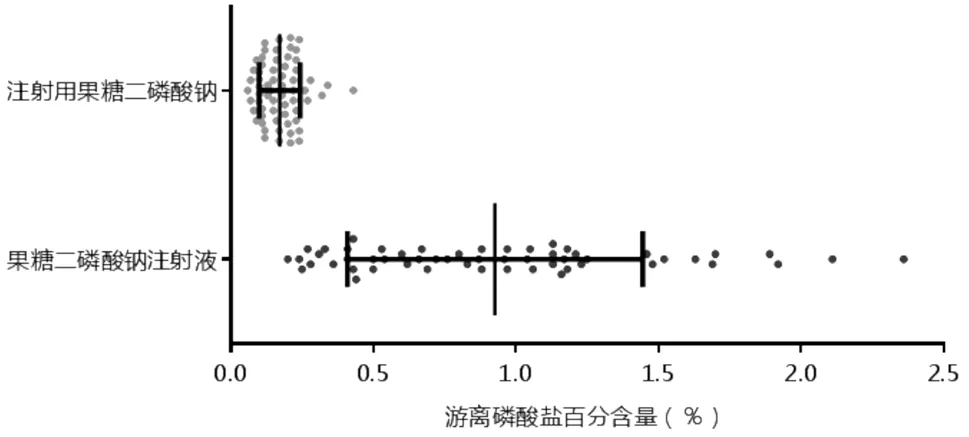
图1 游离磷酸盐测定结果
3.1.2 热原63 批次注射用果糖二磷酸钠中有1 批次热原不符合规定,不合格率为1.58%。这可能与原料和制剂生产过程中微生物污染有关,提示企业应严格控制生产环境。
3.1.3 其他项(1)果糖二磷酸钠注射液其他项目包括性状、鉴别、pH 值、颜色、异常毒性与热原、无菌、含量测定等,均符合规定。五家企业产品的pH 值分布较为分散,有2 家企业的产品pH 值分布在3.08~3.84,另外3 家企业产品的pH 值分布在4.21~4.59,可能是辅料和生产工艺导致这种差异。采用酶法测得果糖二磷酸钠的含量,限度为90.0%~110.0%,均符合规定。大部分产品含量分布在93.1%~102.7%,显示基本控制在一个合理的水平范围。(2)注射用果糖二磷酸钠其他项目主要包括性状、酸度、溶液的澄清度与颜色、水分、异常毒性、无菌、含量测定等,均符合规定。所有样品的pH 值均在5.5~6.5,大部分产品pH 值主要分布在6.01~6.09,分布集中,标准设置合理。按无水物计算样品含量,大多数样品结果在99%~100%的范围,各厂家差异较小,质量稳定。
3.2 探索性研究结果与分析
根据产品的特点及其标准检验中存在的问题开展了9 项探索性研究,包括薄层色谱鉴别、溶液吸光度、有关物质分析、渗透压、5-羟甲基糠醛、铝含量、辅料分析、加速稳定性考察及模拟灭菌试验。
3.2.1 薄层色谱鉴别现行标准鉴别项下薄层色谱主斑点拖尾严重,影响展开效果。参照果糖二磷酸钠原料薄层色谱鉴别方法,同时针对主斑点过大,拖尾较为严重的情况,将点样量由5 μL 减少为1 μL,效果良好。
3.2.2 溶液吸光度吸光度作为注射剂的一项重要理化指标,主要考察产品外在性状是否发生了改变,从而可以了解产品质量的波动。果糖二磷酸易降解,生成醛类物质,可聚合形成聚合物,从而导致溶液颜色发生改变,因此有必要对其吸光度进行检查以控制产品的质量。在380 nm 的波长处测定吸光度,其中注射液全部小于0.15,注射用粉针全部小于0.10,说明该项目风险较小。
3.2.3 有关物质分析针对注射用粉针剂现行标准采用微晶纤维素板进行薄层色谱检查,除果糖有显色斑点外,其他3 种成分1,6-二磷酸果糖、6-磷酸果糖、6-磷酸葡萄糖均无明显显色斑点的问题进行方法研究和探索,调整方法,采用硅胶G 板,以正丁醇-冰醋酸-水-丙酮-10%氨溶液为展开剂,显色剂改为苯胺-二苯胺丙酮溶液。经试验,发现该方法显色效果比原标准好,4 种成分都能显色。混合对照品溶液中,果糖和 6-磷酸葡萄糖能显示2个清晰分离的斑点,但6-磷酸果糖和果糖二磷酸钠2 个点不能明显分离。但由于该方法本身灵敏度和分离度局限,不能很好地考察产品的有关物质。
果糖二磷酸钠系列品种中,根据其合成工艺,葡萄糖、果糖、6-磷酸葡萄糖为工艺杂质,6-磷酸果糖为降解杂质。针对果糖和葡萄糖,采用HPLC 法示差检测器进行分析,所有抽取样品均未检出。采用酶法对6-磷酸葡萄糖、6-磷酸果糖2种杂质进行测定,注射液2 种杂质之和均低于2.0%,注射用粉针均低于0.5%,提示该项目风险较小。
3.2.4 渗透压溶液的渗透压依赖于溶液中溶质粒子的数量,制剂过程中添加的各种辅料会导致渗透压的增高,是重要的安全性指标。有1 家企业所有注射液产品渗透压均大于1 000 mOsm/kg,其余企业产品的结果均小于700 mOsmol/kg;63 批次注射用粉针产品中有8 批大于700 mOsmol/kg。
3.2.5 5-羟甲基糠醛5-羟甲基糠醛是1 种呋喃类化合物,有研究表明,5-羟甲基糠醛对眼睛、上呼吸道、皮肤和黏膜等有刺激性;对人体横纹肌及内脏有损害,且具有神经毒性,能与人体蛋白质结合产生蓄积中毒[7]。采用HPLC 法测定5-羟甲基糠醛,注射用粉针均未检出,注射液中5-羟甲基糠醛含量不同厂家产品之间差异较大。有1 家生产企业的2 批产品5-羟甲基糠醛含量超过2 μg/g,其中1 批达到4.8 μg/g,其余生产企业的产品5-羟甲基糠醛含量均低于1 μg/g[8]。
3.2.6 铝含量从2004 年7 月起,FDA 要求生产厂家对大多数肠外营养液中的铝进行定量。大容积的注射用溶液,如葡萄糖、氨基酸、脂肪乳和注射用蒸馏水,要求其铝含量低于25 μg/L。采用原子吸收分光光度法对所有抽取样品进行测定,本次抽取注射液中铝含量覆盖范围从4~500 ng/mL,55 批次样品中有18 批次铝含量超过200 ng/mL,存在风险。不同企业控制情况不同,其中有1 家企业所有批次样品均控制在20 ng/mL 以下,远低于其他4 家企业。注射用粉针63 批次样品有2 批次大于2 μg/g,为同一公司产品,最高达到3.5 μg/g,其余企业产品大部分小于1 μg/g。进一步研究发现原料供应商产品铝含量与注射液终产品有直接关联[9]。
3.2.7 辅料分析研究采用离子色谱法分别对样品中Cl-和SO42-进行测定。分析结果发现,有1 家企业产品Cl-含量远高于其他企业,该企业产品渗透压也均超过1 000 mOsm/kg,添加了过多的辅料可能是该企业产品渗透压高的原因。各企业样品中均检出硫酸根离子,可能是原料及工艺中带入的,对比果糖二磷酸钠原料质量标准中检查项下硫酸根的限度0.05%,有1 家企业抽检的21 批样品中,17 批超过限度。其余4 家企业的27 批样品,硫酸根含量结果均远小于0.05%。提示生产工艺中可能带入一定量的硫酸根。
3.2.8 加速稳定性考察本研究选取了5 家生产企业7 批注射液分别放置在30 ℃、40 ℃及50 ℃进行了连续8 周的稳定性实验,考察项目为游离磷酸盐与含量测定。
结果发现该产品对热不稳定,如图2、图3 所示,随着温度的升高,其降解的速度越快。30 ℃条件下,放置4 周内比较稳定,8 周内游离磷酸盐逐渐增加,果糖二磷酸钠含量缓慢下降;40 ℃条件下,放置到第4 周游离磷酸盐明显增加,部分批次超限,果糖二磷酸钠含量出现较为明显的下降;50 ℃条件下,放置1 周游离磷酸盐全部超限,放置2 周,果糖二磷酸钠含量明显下降。
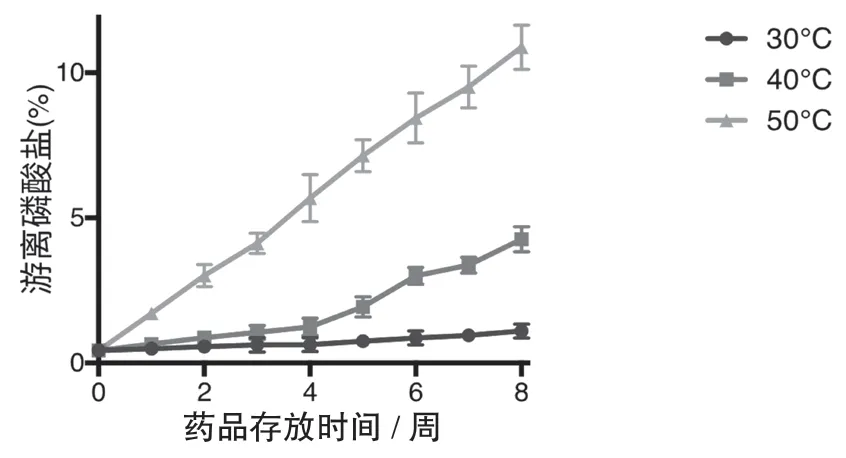
图2 游离磷酸盐含量和时间的关系
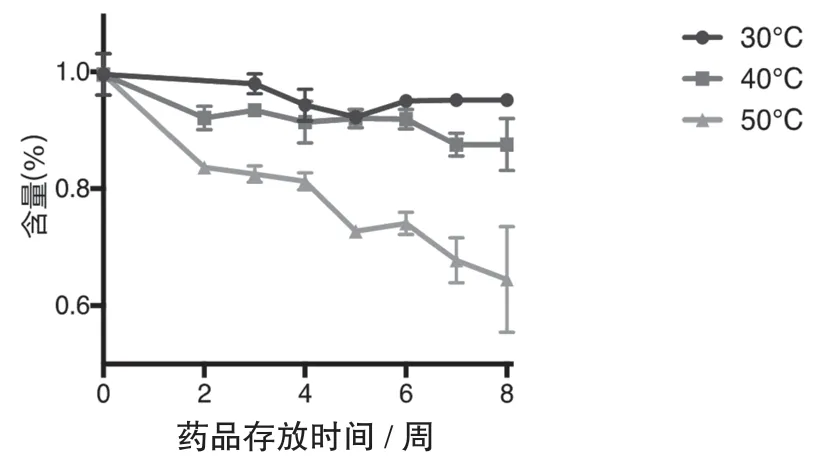
图3 果糖二磷酸钠含量和时间的关系
使用Prism 6 统计计算分析结果,游离磷酸盐在30 ℃、40 ℃、50 ℃时均与时间存在显著相关(P<0.01)。含量与时间在30 ℃时无显著相关,在40 ℃、50 ℃时存在显著性相关(P<0.01)。提示温度是产品质量的主要影响因素。
3.2.9 模拟灭菌工艺质量考察根据调研了解到保证果糖二磷酸钠注射液无菌的主要方式有无菌生产工艺和热处理辅助加过滤除菌。取果糖二磷酸钠原料和辅料,按配比制成果糖二磷酸钠溶液,密封,分别在121 ℃和100 ℃高温灭菌15 min,60 ℃加热1 h。监测灭菌前后该批次样品中果糖二磷酸钠含量和游离磷酸盐变化。原料含量99.30%,游离磷酸盐为0.15%。121 ℃灭菌15 min,游离磷酸盐均上升至9.9%以上,含量降至65%;100 ℃灭菌15 min后游离磷酸盐迅速增加2.2%,含量降至83%;在60 ℃加热1 h,游离磷酸盐含量上升至0.89%,含量降低到97%。要保证F0 值不低于8 min,又要确保灭菌后SAL≤10-6,采用加热灭菌工艺难度很大。
4 讨论
4.1 通过质量分析发现的问题
4.1.1 标准检验发现的主要问题(1)现行标准可行性和有效性方面存在一定问题,如薄层色谱鉴别时经常出现Rf 值小,样品展开不完全,且有点样量过高,拖尾严重的情况,方法条件需要进一步优化;注射用粉针有关物质薄层色谱检查项下,按标准要求的点样量,斑点不明显,方法可行性较差,需要进一步改进。(2)现行质量标准中安全性指标部分缺失,如未对有关物质、渗透压摩尔浓度、铝离子和抗氧剂等进行控制。有关物质是反映产品质量的一个重要指标,是生产工艺和储存条件是否合理的重要依据;渗透压摩尔浓度可以反映产品的质量情况,渗透压摩尔浓度过高会引起注射疼痛甚至溶血;金属铝作为一种对人体有害的元素,在体内可造成蓄积,大容量注射液中的铝离子直接进入体内,风险较大;抗氧剂作为重要辅料,在注射液中的添加可能引起副作用。建议增加以上安全性指标,对现行标准进行完善。
4.1.2 生产工艺对产品质量影响较大灭菌工艺的选择对产品质量至关重要;检验结果表明果糖二磷酸钠对热不稳定,故生产工艺不宜采用终端灭菌或是热处理等辅助灭菌工艺;采用无菌生产工艺生产的产品其产品质量相对较好,采用热处理辅助灭菌方式的2 家企业按标准检验均出现了不合格的产品。
4.1.3 原辅料的选择对终端产品质量影响大果糖二磷酸钠产品质量与原料的质量好坏密切相关,注射用粉针采用原料直接分装,原料的质量控制很大程度上影响终产品的质量。探索性研究中发现质控水平高的原料生产出来的制剂相应产品质量较好,如采用铝含量低的原料生产的终产品铝含量也相对较低;制剂生产过程中应严格把控辅料的添加,如添加过多的Cl-可能导致渗透压的增高;注射液中添加焦亚硫酸盐作为抗氧剂易引起过敏等副反应[10]。
4.1.4 贮存条件对产品质量影响较大该产品要求在密封,在阴凉处(不超过20 ℃)贮藏,但是在实际使用过程很难保证。此次评价性抽验结果发现不合格的产品均在流通领域及医疗单位,果糖二磷酸钠注射液同一批次不同地点抽样产品检验结果存在显著差异。不合格的原因不排除是由于贮存或运输条件不当造成的。
4.2 评价与建议
4.2.1 质量总体评价通过标准检验和探索性研究结果分析,注射用果糖二磷酸钠产品质量总体一般;注射液由于剂型和生产工艺等问题,不合格率较高,整体质量较差。标准检验中果糖二磷酸钠注射液55批次产品共10 批次不合格,不合格率为18.2%;注射用果糖二磷酸钠63 批次产品有1 批次不合格,不合格率为1.6%。进一步探索性研究中果糖二磷酸钠注射液55 批次产品共36 批次不合格,不合格率达到65.5%;注射用果糖二磷酸钠63 批次产品共10 批次不合格,不合格率为15.9%。
4.2.2 建议(1)建议加快标准提高的进度,提高相关质量控制水平;在现有注射用果糖二磷酸钠质量标准基础上,改进鉴别、有关物质检查的方法,增加渗透压摩尔浓度及铝含量等项目;在现有果糖二磷酸钠注射液标准上增加渗透压摩尔浓度、有关物质及铝含量等项目。(2)建议监管部门对果糖二磷酸钠注射液原辅材料及处方工艺进行专项核查;建议企业加强原辅料的质量控制,考察处方的合理性。加强关键工艺指标(灭菌工艺)的质量控制,规范生产工艺及相关验证,确保药品按合法的工艺进行生产。(3)建议针对此类对储存温度有特殊要求的样品,应加强使用终端贮存条件的控制,强调抽样及运输时保存条件,进一步加强对此类热不稳定样品在流通环节的监控。
综上所述,果糖二磷酸钠注射剂质量状况存在不足,现行标准已不能满足现阶段对产品质量有效控制的基本要求,在项目制定、方法选取等方面需提高。此外,建议生产企业严格控制生产环境,改进生产工艺,提高产品质量,以降低使用风险,保障人民用药安全。

