IgA肾病患者血清IgM水平、肾小球系膜IgM沉积与临床病理特征的关系分析
夏虹 张培培 陈红波 张春丽 郑霖 方鸽 马红珍
IgA肾病是世界范围内最常见的肾小球疾病[1],主要由自身抗体结合半乳糖缺陷型IgA1组成的循环或原位免疫复合物沉积于肾小球引起[2]。病理学特征是肾小球系膜区沉积致病性多聚IgA1免疫复合物(或可能原位形成),伴或不伴有IgG和IgM沉积[3]。既往研究表明IgA肾病中单独IgA沉积仅占25%,IgA与IgG或IgM共沉积的比例分别为60%~83%和22%~60%[4]。目前已有一些针对血IgM水平或IgM沉积对IgA肾病临床病理及肾脏预后影响的研究[5-8],但血IgM水平或系膜IgM沉积是否具有单独临床病理价值仍存在争议。本研究回顾性分析不同血IgM水平或肾小球系膜IgM沉积的IgA肾病患者的特征,评估IgM在IgA肾病中的临床意义,现报道如下。
1 对象和方法
1.1 对象 回顾2012年7月至2020年6月浙江中医药大学附属第一医院收治的IgA肾病患者380例,均经肾穿刺活检确诊。其中男148例,女232例,男女比为 1∶1.58;年龄为(37.07± 12.58)岁。纳入标准:(1)符合2020年改善全球肾脏病预后组织(kidney disease:improving global outcomes,KDIGO)肾小球肾炎指南中IgA肾病的诊断标准;(2)肾穿刺活检诊断为IgA肾病;(3)患者在肾穿刺活检前均未服用糖皮质激素和(或)免疫抑制剂。排除标准:(1)合并其他继发性肾小球肾炎,如系统性红斑狼疮、过敏性紫癜、慢性乙型病毒性肝炎等;(2)存在各种原因引起的急性肾损伤;(3)资料不完整者。本研究经浙江中医药大学附属第一医院医学伦理委员会批准(批件号:2017-k-047)。
1.2 方法
1.2.1 患者临床资料收集 收集患者肾穿刺活检前1周内清晨空腹检查时的年龄、性别、病程(指从出现肾病相关症状如浮肿,或从明确检查出尿常规及肾功能异常到肾穿刺活检时)、收缩压、舒张压、高血压病史、肉眼血尿病史、尿红细胞、24 h尿蛋白定量、血清IgA、IgM、IgG 和补体 3(complement 3,C3)、补体 4(complement 4,C4)水平、血清白蛋白、血清 TC、血清 TG、LDL、血尿酸、血肌酐、尿素氮、ESR。肉眼血尿定义为肉眼可以直接发现的血样、浓茶样或洗肉水样真性血尿,且排除急性泌尿系统感染、泌尿相关肿瘤或泌尿系统结石等引起的非肾小球源性血尿。高血压定义为既往或住院期间存在2次或2次以上收缩压≥140 mmHg和(或)舒张压≥90 mmHg,目前正在服用降压药物但是血压正常患者。
1.2.2 肾脏病理分级和分型标准 病理诊断除了对IgA肾病进行Lee氏分级外[9],还根据2017年的IgA肾病牛津分型[10]。(1)系膜细胞增生(M0/1):≥50%肾小球系膜区超过 3个系膜细胞即为 M1;(2)内皮细胞增生(E0/1)无或有;(3)节段性肾小球硬化或粘连(S0/1)无或有;(4)肾小管萎缩和(或)肾间质纤维化(T0/1/2)。T0为≤25%,T1为>25%~50%,T2为>50%;(5)细胞/纤维细胞性新月体(C0/1/2)。C0为无,C1为<25%,C2为≥25%[10-12]。IgA、IgG、IgM、C3沉积强度和肾脏病理的诊断是经2位病理科医师独立诊断,最终的诊断经过本研究所有作者参与临床病例讨论后确定。
1.2.3 经皮肾活检 患者俯卧位,在B超引导下右肾下极经皮肾穿刺取得肾组织,获得的穿刺组织经石蜡包埋切片厚度2~3 μm,常规HE染色、糖原(periodic acid-Schiff,PAS)染色、过碘酸六胺银染色(periodic acid-silver metheramine,PASM)和马松(Masson)染色;冷冻切片厚度4~5 μm;取<1 mm3的肾组织前期处理后制作超薄切片,分别进行光学显微镜、免疫荧光及电镜检查。
1.3 观察指标 (1)按患者血清IgM水平中位数分为低IgM水平组(IgM<1.1 g/L)和高IgM水平组(IgM≥1.1 g/L)。比较两组患者临床病理特征,并分析血清IgM水平与临床病理特征的关系。(2)根据患者肾小球免疫荧光检查是否有IgM沉积,分为IgM无沉积组与IgM沉积组。比较两组患者临床病理特征,并分析血清IgM水平与临床病理特征的关系。
1.4 统计学处理 采用SPSS 20.0统计软件。非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验。相关性分析采用Spearman相关。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况 380例IgA肾病中以女性为主(61.1%),肾穿刺活检时中位病程 6(1,24)个月,中位年龄 35(28,45)岁,以青壮年为主要发病人群,76 例(20.0%)患者有肉眼血尿发作史,122例(32.1%)患者肾穿刺活检时合并有高血压。实验室检查示24 h尿蛋白定量 0.81(0.34,1.48)g,尿红细胞 111(38.9,362.8)/L,血 IgA 2.91(2.31,3.62)g/L,血 IgG 10.94(8.98,12.60)g/L,血C3 0.85(0.73,1.00)g/L,血 C4 0.20(0.16,0.25)g/L,血清白蛋白 37.15(34.01,40.38) g/L,血清 TC 4.38(3.83,5.20)mmol/L,血清 TG 1.43(0.96,2.96)mmol/L,LDL 2.33(1.88,2.78)mmol/L,血尿酸 344.25(278.00,421.85)μmol/L,血肌酐 69.00(55.00,94.68)μmol/L,尿素氮 5.00(4.10,6.22) mmol/L,ESR 8(3,18)mm/h。
2.2 IgA肾病患者血清IgM水平与临床病理特征的关系 血清IgM水平中位数为1.1g/L,低IgM水平组(血IgM<1.1g/L)患者189例,高IgM水平组(血IgM≥1.1g/L)患者191例。
2.2.1 低IgM水平组与高IgM水平组患者临床病理特征比较 与高IgM水平组患者相比,低IgM水平组患者中男性占比及肾活检时合并有高血压占比、收缩压、血IgA、血C4、LDL、血尿酸、血肌酐、尿素氮水平均较高(均P<0.05);血IgG水平较低(P<0.05)。两组患者年龄、病程、舒张压、肉眼血尿发作史、尿红细胞计数、24 h尿蛋白定量、血C3、血清白蛋白、血清TC、血清TG、ESR比较差异均无统计学意义(均P>0.05),见表1。
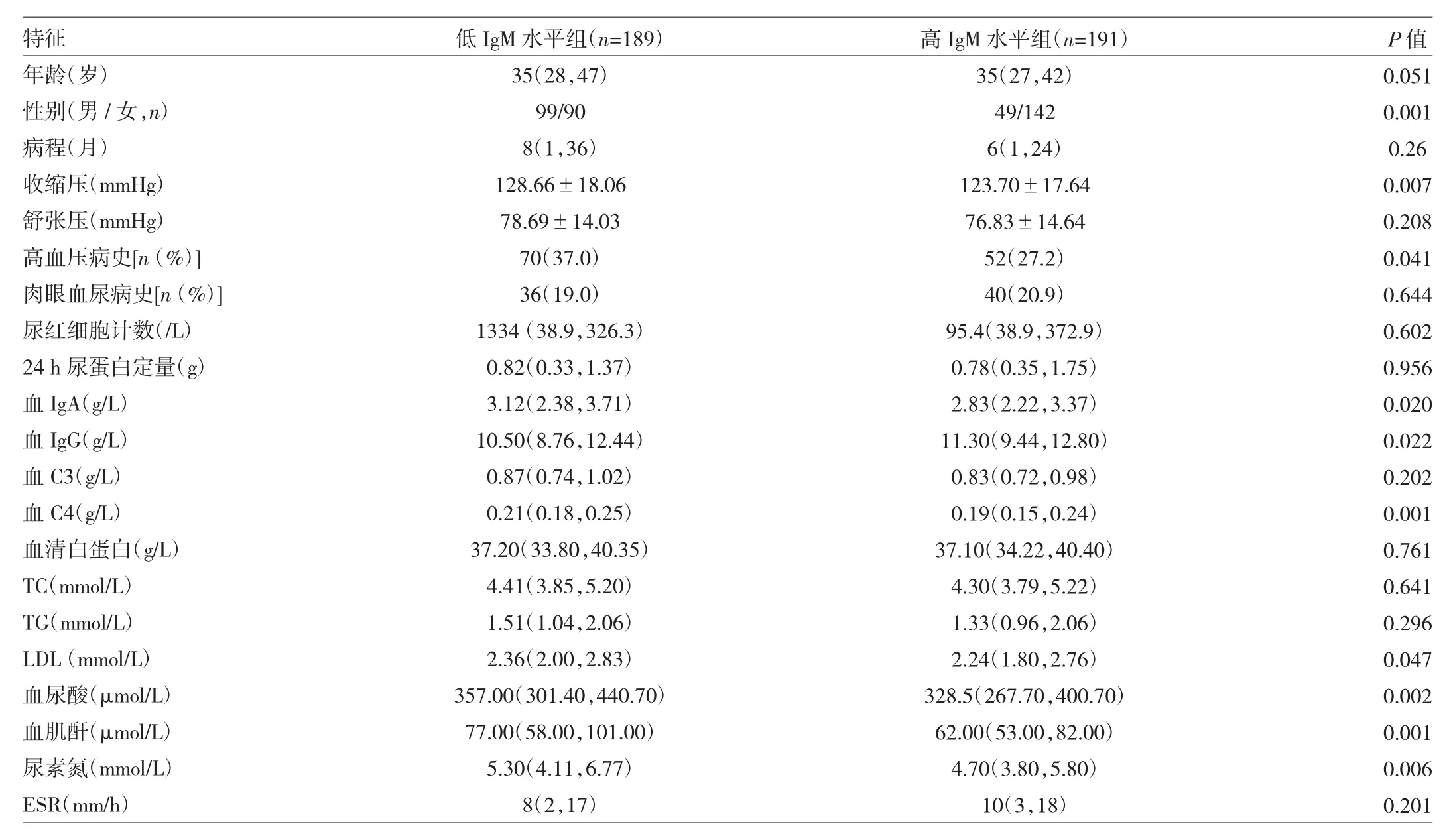
表1 低IgM水平组与高IgM水平组患者临床病理特征比较
2.2.2 IgA肾病患者血IgM水平与临床病理特征相关性分析 相关性分析显示,IgA肾病患者血清IgM水平与肾活检时合并有高血压占比、收缩压、血IgA、血C4、LDL、血尿酸、血肌酐、尿素氮水平均呈负相关(均P<0.05),与男性占比、血IgG水平呈正相关(均P<0.05),见表 2。
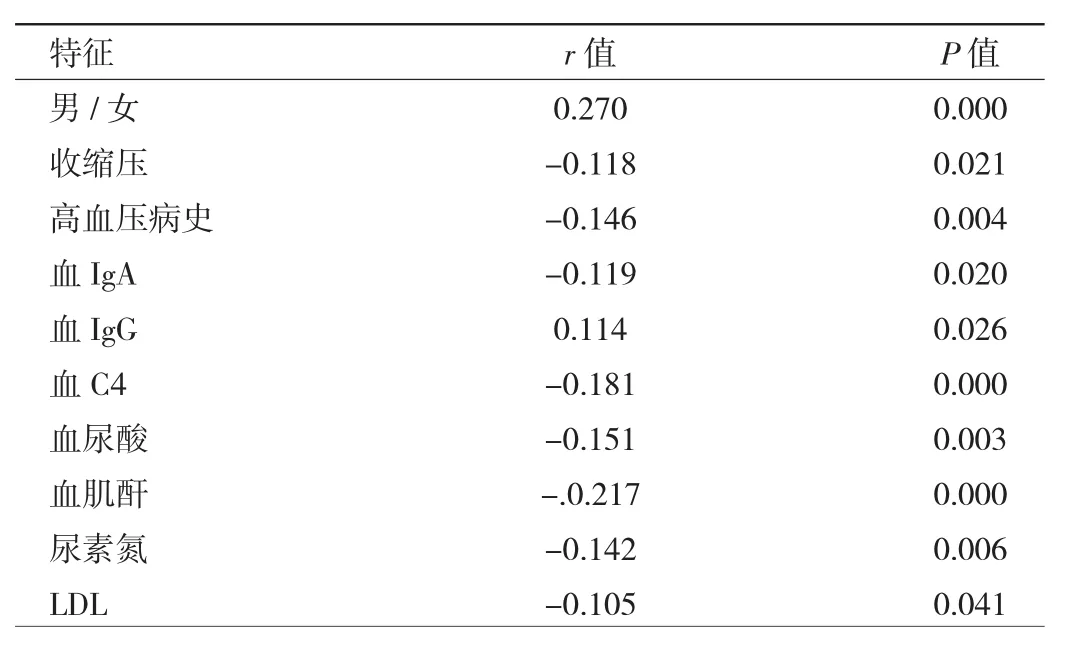
表2 IgA肾病患者血IgM水平与临床病理特征相关性分析
2.2.3 低IgM水平组与高IgM水平组患者肾脏病理分级、分型及IgA、C3沉积强度比较 考虑到Lee氏分级为Ⅰ级的患者仅有3例,剔除此3例,即纳入病理分析的共377例,低IgM水平组189例,高IgM水平组189例。低IgM水平组患者IgM沉积占比较高IgM水平组低(P<0.05),两组患者肾脏病理牛津分级中M1、E1、S1、T1~2、C1~2 型占比及 Lee 氏Ⅱ、Ⅲ、Ⅳ、Ⅴ级占比比较差异均无统计学意义(均P>0.05),两组患者IgA、C3的沉积强度比较差异均无统计学意义(均P>0.05)。见表 3。
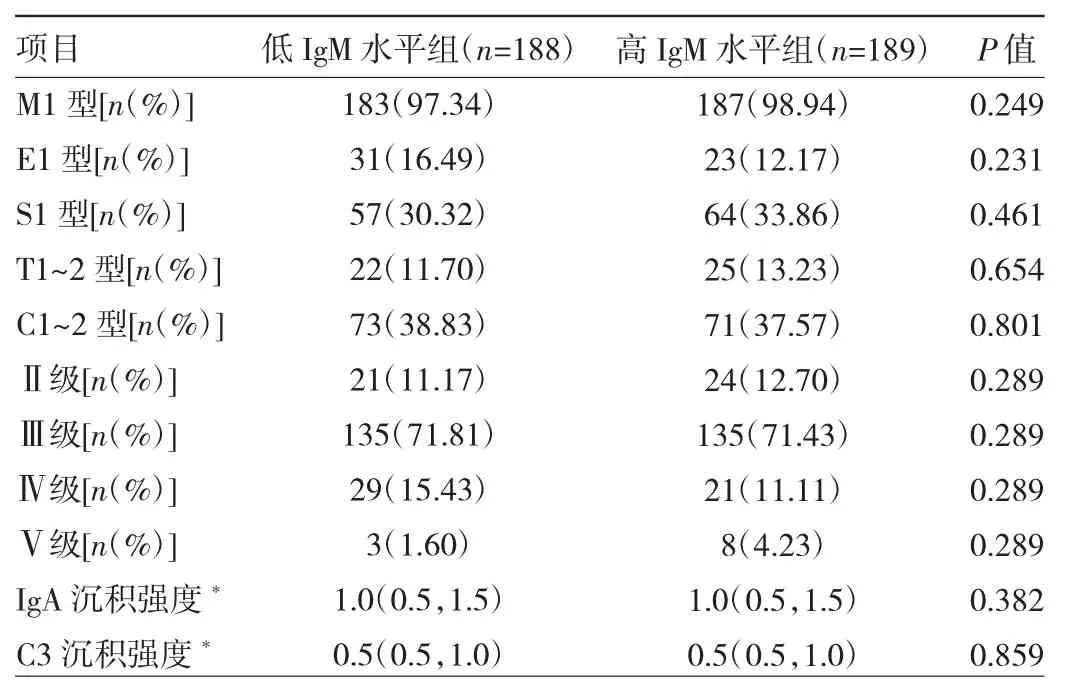
表3 低IgM水平组与高IgM水平组患者肾脏病理分级、分型及IgA、C3沉积强度比较
2.3 IgA肾病患者IgM沉积情况与临床病理特征的关系分析 肾小球免疫荧光检查显示380例患者中IgM无沉积组128例,IgM沉积组252例。
2.3.1 IgM无沉积组与IgM沉积组患者临床病理特征比较 肾穿刺活检前,IgM沉积组患者肉眼血尿发作比例高于IgM无沉积组(P<0.05);IgM沉积组患者尿红细胞计数低于IgM无沉积组(P<0.05);体液免疫中IgM沉积组血清IgA水平低于IgM无沉积组(P<0.05)。两组患者年龄、性别、病程、收缩压、舒张压、高血压病史、24 h 尿蛋白定量、血 IgM、血 IgG、血 C3、血 C4、血清白蛋白、TC、TG、LDL、血尿酸、血肌酐、尿素氮、ESR比较差异均无统计学意义(均P>0.05),见表4。
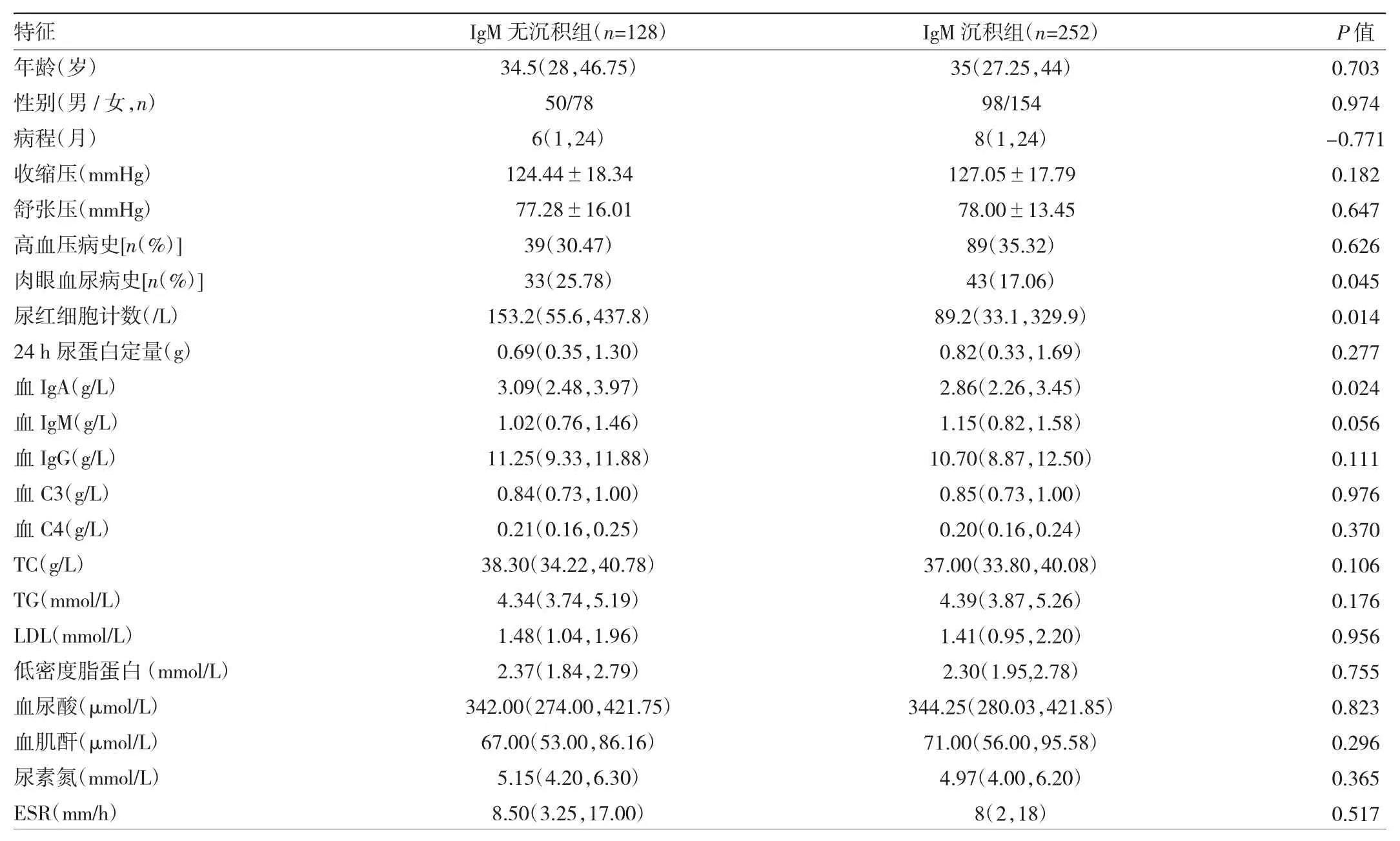
表4 IgM无沉积组与IgM沉积组患者临床病理特征比较
2.3.2 IgA肾病患者IgM沉积情况与临床病理特征相关性分析 相关性分析显示,IgA肾病患者IgM沉积与肉眼血尿发作、尿红细胞计数呈负相关(均P<0.05),见表5。
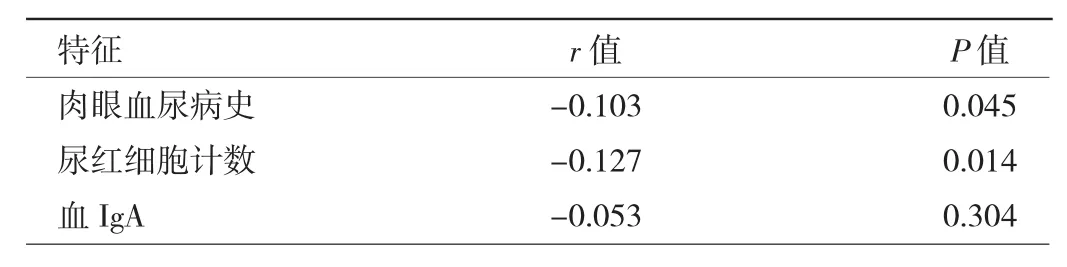
表5 IgA肾病患者IgM沉积情况与临床病理特征相关性分析
2.3.3 IgM无沉积组与IgM沉积组患者肾脏病理分级、分型及IgA、C3沉积强度比较 考虑到Lee氏分级为Ⅰ级的患者仅有3例,剔除此3例,即纳入病理分析的共377例,IgM无沉积组128例,IgM沉积组249例。两组患者肾脏病理牛津分型中M1、E1、S1、T1~2、C1~2型占比及Lee氏分级中Ⅱ、Ⅲ、Ⅳ、Ⅴ级占比比较差异均无统计学意义(均P>0.05),且两组患者IgA、C3沉积强度比较差异亦无统计学意义(均P>0.05)。见表6。
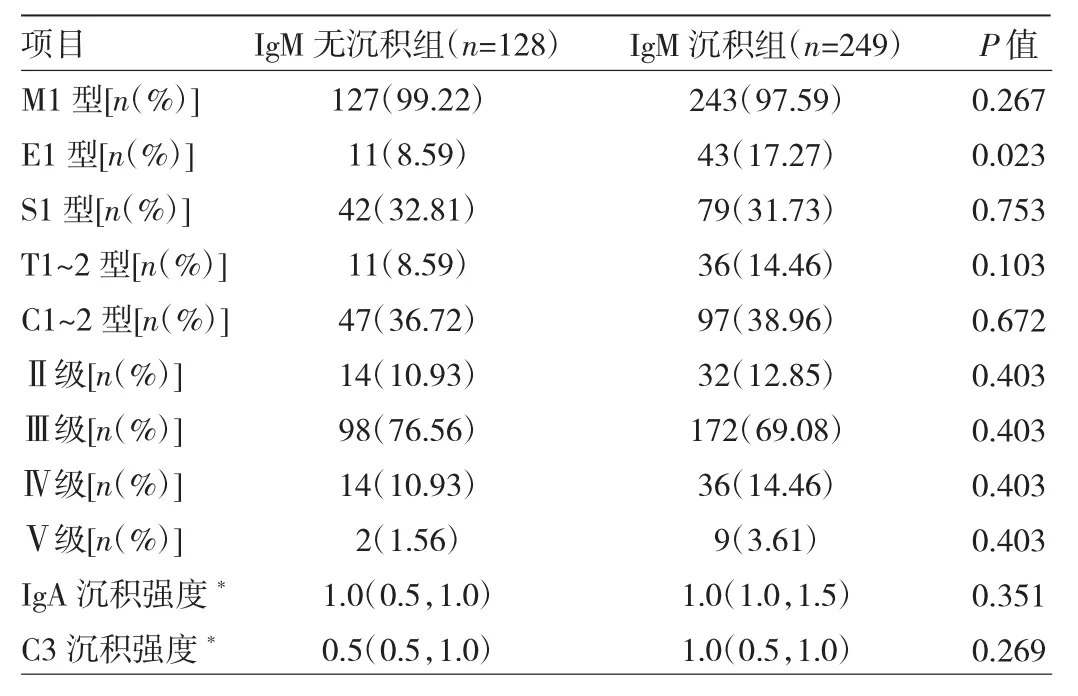
表6 IgM无沉积组与IgM沉积组患者肾脏病理分级、分型及IgA、C3沉积强度比较
2.4 IgA肾病患者血清IgM水平与IgM、IgA、C3免疫荧光沉积强度的相关性分析 相关性分析显示,IgA肾病患者血清IgM水平与IgM沉积强度呈正相关(P<0.05),与 IgM、IgA 沉积强度无关(均 P>0.05),见表7。

表7 IgA肾病患者血清IgM水平与IgM、IgA、C3免疫荧光沉积强度的相关性分析
3 讨论
目前公认的IgA肾脏发病中心机制是异常糖基化的IgA1与自身IgG形成抗原抗体免疫复合物[3]。病理表现为系膜区IgA和补体沉积,可伴有IgM或IgG沉积。然而,这其中免疫球蛋白沉积的机制和作用,即使是关于IgA的,也仍不完全清楚。有研究发现,IgM在系膜区的沉积是疾病恶化的标志,一些学者也提出降低IgM抗体水平可以延缓疾病的恶化[14]。本研究发现,患者血清IgM水平与肾穿刺活检时合并有高血压占比、收缩压、血 IgA、血 C4、LDL、血尿酸、血肌酐、尿素氮水平呈负相关,与男性占比、血IgG水平呈正相关。
本研究发现,不同血IgM水平的IgA肾病患者表现出不同的临床特征。本研究纳入的IgA肾病患者,其中低IgM水平组189例,高IgM水平组191例,与高IgM水平组比较,低IgM水平组患者的男性占比及肾穿刺活检时合并有高血压占比、收缩压、血IgA、血C4、LDL、尿酸、血肌酐、尿素氮水平较高,血IgG水平较低。这些结果提示低血清IgM水平组患者在肾功能进展中面临着更高的风险。张惠雅等[5]回顾性分析了252例IgA肾病患者,指出低IgM水平组患者的临床指标,如年龄、男性占比、收缩压、尿素氮、血尿酸、尿蛋白量较高IgM水平组高,血清IgG、C3水平较低。这与本研究结果在临床指标方面具有较大一致性。有文献报道,低血IgM水平的局灶节段性肾小球硬化症患者的肾脏损伤更严重[15]。IgM在肾脏疾病中可能参与循环免疫复合物形成[16],具体致病机制需要分子实验进一步研究证实。张惠雅等[5]还指出,低血IgM水平组的肾小管萎缩或间质纤维化分型占比较高IgM水平组高。本研究分析表明IgA肾病牛津分型(M1、E1、S1、T1~2、C1~2)及Lee氏分级(Ⅱ、Ⅲ、Ⅳ、Ⅴ)比例与IgM水平无关。这一差异需要更大的样本量进一步验证。张惠雅等[5]通过采用多因素Cox比例风险模型分析IgA肾病预后的危险因素,指出低IgM水平是IgA肾病患者进展至终末期肾脏病的独立危险因素。本研究没有涉及到肾脏预后的分析,这是不足之处。
本研究还发现,伴IgM沉积的IgA肾病患者表现出不同的临床特点,即IgM沉积组患者肉眼血尿发作比例高于IgM无沉积组,尿红细胞计数、血IgA低于IgM无沉积组。进一步相关性分析提示,IgM沉积与肉眼血尿发作、尿红细胞计数呈负相关。在健康个体中,IgM可在感染的初始防御中起作用,而肉眼血尿的发生多在感染后出现,已有研究指出IgM可通过其他铰链区表位被循环免疫复合中的IgA1识别,可能参与循环免疫复合物的形成[16]。笔者推测IgM参与的循环免疫复合物与肉眼血尿发生相关。本研究结果与已有的一些研究存在差异。Welch等[17]发现IgM沉积与大量蛋白尿有关,不影响儿童IgA肾病患者预后。病理方面,本研究分析表明IgA肾病牛津分型(M1、E1、S1、T1~2、C1~2)及Lee氏分级(Ⅱ、Ⅲ、Ⅳ、Ⅴ)比例与IgM沉积无关。Cihan Heybeli等[7]发现IgM沉积组的肾小球节段硬化评分更高,并且指出系膜IgM沉积与肾脏不良转归独立相关[7]。Tang等[18]认为系膜区IgM沉积与新月体形成有关。这些差异与很多因素有关系,比如说随访时间、肾穿刺活检时间等。IgM沉积可能是病因性的,除了上述提到的参与循环免疫复合物的形成,也可激活补体造成肾脏损伤[19];也可能只是一种伴随现象,一种病情变化的标志。
本研究还发现,低IgM水平组的IgM沉积占比较高IgM水平组低,血清IgM水平与其沉积强度间呈正相关。相关研究提示肾小球内IgM的结合可能是在肾小球损伤之后继发出现的[20-21]。IgM是相对分子质量最大的免疫球蛋白,一般不能通过血管壁。笔者推测IgA肾病患者肾脏出现损伤后,IgM由受损的滤过屏障滤出,与肾脏局部抗原结合沉积。因而血清IgM水平越高,其沉积强度越高。这与低血清IgM水平患者在肾功能进展中面临着更高的风险并不矛盾。对于同一个个体而言,随着疾病的发生、发展,血IgM的水平以及IgM沉积是一个动态演变的过程。
本研究从不同方面全面分析了IgA肾病患者血清IgM水平以及IgM沉积情况与临床病理特征的关系。根据血清IgM水平分组,或根据IgM沉积与否分组,患者临床特征存在明显差异,病理特征均无明显差异。不过本研究也存在一定局限性。作为回顾性分析,所有患者在诊断和治疗方面存在差异,不能保证一致性;在收集资料过程中,没有完全排除治疗药物可能造成的差异,尤其是血管紧张素转换酶抑制剂等。另外,本研究仅收集了肾穿刺活检时的基线资料,没有对患者进行长期随访,没能就血清IgM水平以及IgM沉积对肾脏及疾病预后进行分析。以后的研究中,要综合考虑以上因素,增加样本量,以明确IgM对IgA肾病患者预后的影响,从而指导临床诊疗。

