经尿道膀胱肿瘤整块切除与电切术对患者循环肿瘤细胞的影响
虞随 姚立锋 苏翼 庞彤彤 严泽军 刘厚先
循环肿瘤细胞(circulating tumor cells,CTCs)是指从原发实体瘤或转移灶脱落,侵袭进入外周血液循环的细胞,其具有原发灶肿瘤细胞相似的遗传特性与抗原[1]。荟萃分析显示外周血CTCs阳性与膀胱癌肿瘤分期、组织学分期、转移和局部淋巴结转移相关[2],是肿瘤复发和转移的最直接因素[3]。另外,外周血中CTCs数量的改变要先于传统影像学检查的改变[4],在膀胱癌诊断中具有潜在价值。传统经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)被认为是治疗非肌层浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)的“金标准”。但有研究发现在TURBT中,肿瘤细胞有经血流播散的风险,而将膀胱肿瘤整体切除或许能解决这一问题[5]。基于此,本研究对初发NMIBC患者采用经尿道膀胱肿瘤整块切除术(en bloc transurethral resection of bladder tumor,EBRT)治疗,与同期行TURBT的患者进行比较,观察两种术式在肿瘤切除前后CTCs数量的变化差异,探讨EBRT的临床应用价值,现报道如下。
1 对象和方法
1.1 对象 选取2019年8月至2020年7月宁波市第一医院泌尿外科连续收治的拟行手术治疗的57例初发NMIBC患者为研究对象,采用随机数字表法分为两组,分别行 EBRT(EBRT组)和 TURBT(TURBT组)治疗。纳入标准:(1)经膀胱镜检查诊断为膀胱肿瘤患者;(2)影像学检查提示膀胱肌层未受侵犯,无远处转移;(3)单个肿瘤直径为l~4 cm;(4)肿瘤数量<3个;(5)术前评估能耐受手术。排除标准:(1)肿瘤位于膀胱颈口和前壁;(2)既往接受过膀胱癌手术治疗;(3)既往接受放、化疗;(4)合并其他肿瘤。因患者情况在术中及术后与初期纳入时可能存在差异,制定剔除标准:(1)术后病理提示非尿路上皮肿瘤或原位癌或肿瘤分期≥T2期;(2)术后因出血需再次手术止血;(3)因样本采集、保存方法不规范等原因至CTCs检测失败;(4)因任何原因要求退出研究者。手术均由3位同组高年资医师(10年以上NMIBC内镜治疗经验)完成。本研究通过宁波市第一医院医学伦理委员会审批(批件号:2018-R069),所有患者均签署知情同意书。
本研究共剔除患者9例,其中3例术后病理报告提示为尿路上皮内翻性乳头状瘤,2例术后病理报告提示为肌层浸润性膀胱癌(T2分期),1例术后24 h内因出血再次行手术电凝止血,3例因样本采集、保存方法不规范等原因致CTCs检测失败,最终本研究共纳入48例患者,其中EBRT组27例,TURBT组21例。
1.2 治疗方法
1.2.1 手术方法 EBRT组患者术前8~12 h常规禁食,待连续硬膜外麻醉效果满意后采取膀胱截石位,进行常规消毒铺巾,使用日本奥林巴斯F26等离子电切镜,在双极模式下进行切除手术。设定电切功率为200 W,电凝功率为120 W,患者术前均未行闭孔神经阻滞,术中以0.9%氯化钠溶液作为冲洗液。术中使用针状电极电凝距肿瘤基底周边1 cm处的膀胱黏膜层,以标记切除范围;同时封闭基底周围怒张的血管,以减少术中出血,保持术中视野清晰,以实现术中精准切割,避免损伤正常的膀胱黏膜。然后用电极的尖端插入黏膜层,将黏膜挑起与肌层分开,将肿瘤周围的膀胱黏膜连同部分肌层完整地切除,肿瘤基底组织单独送检。术后更换环状电极对创面进行彻底止血。肿瘤标本体积较小时可直接用0.9%氯化钠溶液经电切镜鞘冲出或使用环状电极勾出标本,若肿瘤标本体积较大,可以在完全封闭膀胱肿瘤周围血供后,使用环状电极在基底部纵向切开病灶,分为两部分或两部分以上,后再沿电切镜鞘完整取出。TURBT组患者使用环状电极,常规经尿道将肿瘤逐层分片切除,直至露出膀胱壁肌层,肿瘤基底组织单独送检,并将距肿瘤周边1.0 cm的瘤旁组织切除。肿瘤碎片较少时,可直接用0.9%氯化钠溶液经电切镜鞘冲出或使用环状电极勾出标本,若肿瘤碎片较多,使用ELLIK冲洗瓶完全冲出组织标本。
1.2.2 术后治疗 所有患者术中及术后将输液袋置于膀胱上方50 cm处,术后均留置F22三腔导尿管,行膀胱连续冲洗12~24 h。术后24 h内均行吉西他滨1.0 g膀胱灌注化疗。
1.3 CTCs检测方式 两组患者在术前和术后72 h,分别从外周静脉中抽取3.2 ml血液样本检测CTCs。注意将患者前2 ml血液弃去,以避免静脉穿刺过程中混入表皮细胞致CTCs计数呈假阳性,所有样本均在4℃冰箱内保存,24 h内送检处理。本研究采用中国莱尔生物医药科技有限公司Cyttel技术富集CTCs,后续采用免疫荧光与原位杂交结合技术(immuno fluorescence in situ hybridizationt,imFISH)鉴定 CTCs。另外,本研究选择同期健康志愿者血样本10例,进行CTCs检测。本研究将CTCs定义为同时满足染色体超二倍体、CD45阴性、4',6-二脒基-2-苯基吲哚阳性的细胞。由2位实验室检验人员进行CTCs计数,检验者对临床病理数据不知情。CTCs阳性界定标准:患者外周血标本中CTCs检测值≥2个/3.2 ml为阳性。
1.4 观察指标 观察并比较:(1)两组患者的一般资料,包括性别、年龄、吸烟史、BMI、肿瘤分期、肿瘤分级、肿瘤最大径、术前CTCs阳性率等;(2)不同临床特征患者术前外周血CTCs计数;(3)两组患者手术前后外周血CTCs计数;(4)两组患者预后情况;(5)复发患者与未复发患者术后CTCs计数。
1.5 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,组间比较采用两独立样本t检验,组内术前、术后比较采用配对t检验;计数资料以频数和构成比表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,两组患者生存曲线的比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组患者性别、年龄、吸烟史、BMI、肿瘤分期、肿瘤分级、肿瘤最大径、术前CTCs阳性率比较差异均无统计学意义(均P>0.05),见表1。此外,本研究10位健康志愿者中均未检测出外周血CTCs。
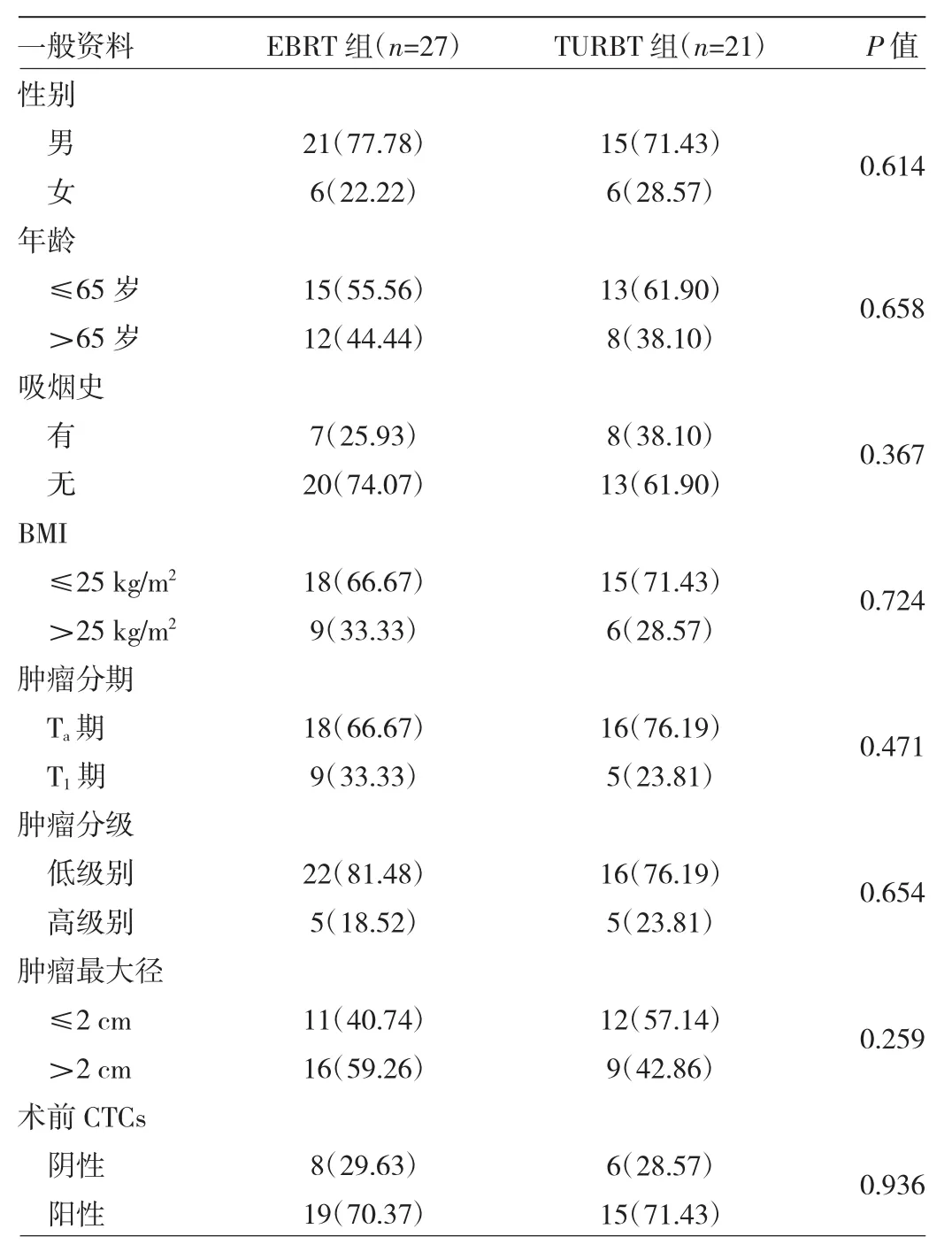
表1 两组患者一般资料比较[例(%)]
2.2 不同临床特征患者术前外周血CTCs计数比较不同年龄、性别、吸烟史、BMI和肿瘤最大径患者术前CTCs计数比较差异均无统计学意义(均P>0.05)。T1分期患者术前外周血CTCs计数高于Ta分期患者(P<0.05)。肿瘤分级为高级别的患者术前外周血CTCs计数高于低级别患者(P<0.05)。见表2。
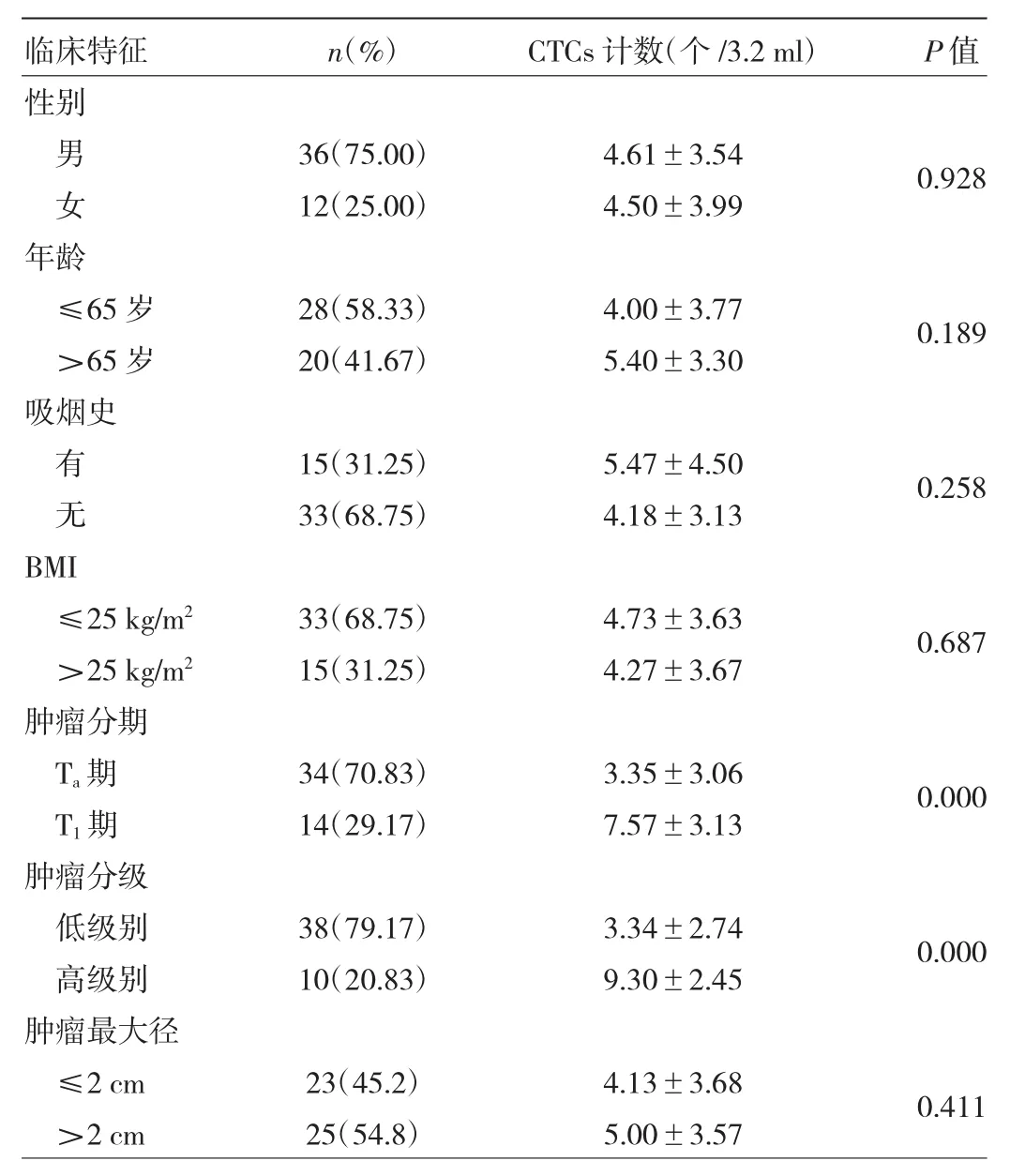
表2 不同临床特征患者术前外周血CTCs计数比较
2.3 两组患者手术前后外周血CTCs计数比较 术前两组患者外周血CTCs计数比较差异无统计学意义(P>0.05),术后EBRT组患者外周血CTCs计数低于TURBT组(P<0.05)。EBRT组患者术后CTCs水平与术前比较差异无统计学意义(P>0.05),而TURBT组患者术后CTCs计数高于术前(P<0.05)。见表3。
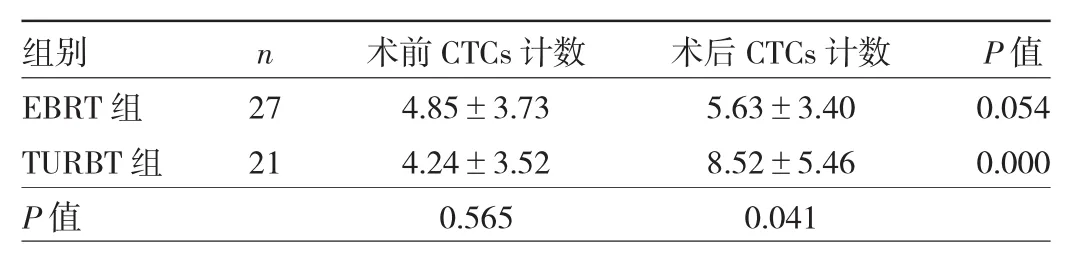
表3 两组患者手术前后外周血CTCs计数比较(个/3.2 ml)
2.4 两组患者预后情况比较 两组患者术后随访12~26个月,中位随访时间22个月,EBRT组术后复发2例(分别在术后11、13个月复发),TURBT组术后复发3例(分别在术后3、6、7个月复发)。生存分析显示,两组患者1年无复发生存率比较差异无统计学意义(92.4%比 85.7%,P<0.05),见图 1。
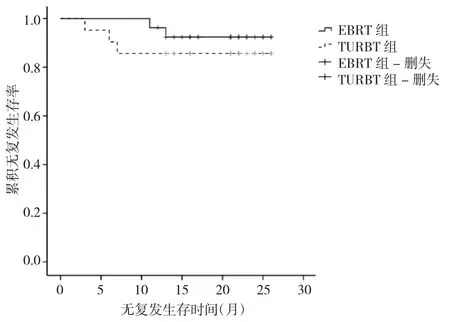
图1 两组患者术后无复发生存曲线比较
2.5 复发患者与未复发患者术后CTCs计数比较术后复发的患者术后CTCs计数高于术后未复发患者[(12.00±4.80)个/3.2 ml比(6.30±4.25)个/3.2 ml,P<0.05]。
3 讨论
CTCs这一概念最早由Ashworth于1869提出[6],其在1例癌症患者的外周血中发现了某些细胞与肿瘤细胞相似。CTCs的形成过程非常复杂,通过上皮-间充质转化,肿瘤细胞的形态结构、黏附分子及其骨架结构发生改变,降低黏附能力并增强可塑性后脱落入血,逃脱宿主免疫系统及避免血流剪切力;同时肿瘤细胞分泌的基质金属蛋白酶通过增强肿瘤细胞迁移能力,使其在血液循环中扩散、迁移[7]。近年来,CTCs检测因具有微创、快速、便捷、特异性高等优点,并与肿瘤的复发转移密切相关,在转移性乳腺癌、胃癌、前列腺癌和结直肠癌等多种肿瘤临床诊疗中发挥出越来越大的价值[8-10]。通过检测CTCs,临床可以追踪膀胱癌患者的肿瘤细胞从早期原发病灶微转移至晚期远处转移的全过程,目前该技术已经在膀胱癌的诊断分期、选择治疗方案及评价预后中发挥了重要的作用[11]。
目前CTCs检测方式超过50种,其中美国强生公司CellSearch系统是唯一标准化平台,已获得美国FDA批准[12]。该系统需要依赖上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)抗原阳性标记 CTCs,灵敏度较低。为避免这一不足,本研究采用了Cyttel技术,利用CD45磁珠抗体将白细胞吸附并去除,阴性富集全部特征的CTCs,排除传统依赖于EpCAM抗原表达捕获CTCs的局限性,可最大限度地获取血液中的CTCs[13]。后续采用imFISH鉴别技术,通过判别染色体超二倍体性,同时偶联血源性细胞标志物排除血源性异常细胞的干扰从而鉴别CTCs,较之传统上皮标志物蛋白染色的 CTCs鉴别方法具有更高的灵敏度和特异度。本研究中患者术前CTCs阳性率为70.83%,与文献报道相近[14],且在10位健康志愿者中均未检测出CTCs。然而该技术单次检测成本较高,这也制约笔者团队进行大样本数据采集。
一项荟萃分析显示,外周血CTCs阳性与膀胱癌肿瘤分期、组织学分期、转移和局部淋巴结转移相关,提示外周血中CTCs的存在是膀胱癌患者预后不良的独立预测指标[2]。缪应新等[15]在NMIBC患者中研究发现,术后CTCs计数≥5个/3.2 ml的患者复发及转移风险均远高于CTCs计数<5个/3.2 ml的患者。而在本研究中,笔者观察到在术后复发的5例患者中,术后CTCs均≥5个/3.2 ml,且这5例患者术后CTCs水平显著高于术后未复发患者,提示了CTCs用于监测膀胱癌患者术后转移进展的价值。本研究所有患者术后24 h内均行吉西他滨1.0 g膀胱灌注化疗,并视患者疾病复发风险高低进行吉西他滨1.0 g膀胱灌注化疗1~3年。
膀胱癌是泌尿外科最常见的恶性肿瘤之一[16],其中NMIBC占75%以上[17]。虽然NMIBC被认为是一种非侵袭性肿瘤,但其复发风险高达78%,进展风险高达45%[18]。目前TURBT被认为是治疗NMIBC的“金标准”,然而TURBT在切除肿瘤时需将肿瘤逐片切除,在碎片化过程中可能导致肿瘤扩散、种植转移,与肿瘤手术的“无瘤原则”相悖。Engilbertsson等[5]在行TURBT术后发现患者CTCs计数升高,提示术中可能存在癌细胞入血。而在本研究中,TURBT组患者术后CTCs计数显著高于术前,这与文献报道结果相符。
EBRT相较于传统开放膀胱部分切除术具有出血风险小,术后并发症少等优点,相较于TURBT术,可减少术中漂浮的肿瘤细胞数量并降低肿瘤再植的风险,更遵循“无瘤原则”。一项荟萃分析显示接受EBRT治疗患者的住院时间、置管时间、术中及术后并发症和24个月复发率明显低于接受TURBT治疗的患者[19]。另外由于没有频繁使用电凝,EBRT术后完整切除的肿瘤标本有助于更准确地进行病理学分级和分期。本研究结果显示,EBRT组患者术后CTCs计数与术前比较无统计学差异。组间比较,现TURBT组患者术后CTCs计数高于EBRT组,进一步提示了EBRT相比于TURBT能降低癌细胞入血的风险。
目前膀胱肿瘤的大小是EBRT的主要限制。大部分研究选择最大径≤3 cm的膀胱肿瘤行EBRT手术[20-22]。对于难以整块取出的较大膀胱肿瘤,有学者提出可以在EBRT后沿基底部分块切除膀胱肿瘤[23],或先分段切除膀胱肿瘤外生部分,后整体切除肿瘤基底部[24]。欧洲泌尿外科协会共识中提出,即使对于最大径>3 cm的膀胱肿瘤,EBRT仍然是可行的,依旧能保留病理精确分期和肿瘤完整切除的优点[25]。虽然EBRT术后肿瘤标本切碎后在膀胱内留置时间较短,但仍可能存在癌细胞入血的风险。在本研究中,针对10例EBRT术中肿瘤较大无法将其从膀胱中完整取出的患者,笔者团队使用环状电极对创面彻底止血后,将肿瘤在基底部纵向切开分块取出,术后CTCs数量增加与标本完整取出的17例相比无统计学差异。由于本研究样本量相对较小,尚无法确定EBRT术中将肿瘤分块取出膀胱是否会导致患者肿瘤种植及复发风险增加,下一步需要进一步扩大样本量进行前瞻性研究。
在文献报道中,EBRT组的2年复发率为10.0%,TURBT组的2年复发率为38.5%,两者有统计学差异[26]。对于本研究所有患者,笔者团队进行终身随访,每3个月复查泌尿系统彩色超声、膀胱镜等检查。本研究发现两组患者术后1年无复发生存率比较无统计学差异,术后复发患者二次手术后均无再次复发,这可能与本研究随访时间较短有关。对于复发患者,本次研究未进行CTCs再次检测,后续有待进一步实验研究CTCs与膀胱癌复发的关系。据文献报道,CTCs和循环肿瘤DNA可能在预后和转移评估中具有互补作用[27]。因此,两者的共同检测在未来膀胱癌的诊疗中或许能发挥更大的作用。后续笔者团队将继续随访观察患者术后复发情况,进一步分析CTCs和循环肿瘤DNA与NMIBC预后及进展之间的关系。
综上所述,与TURBT比较,EBRT治疗NMIBC可以降低患者术后外周血中因膀胱肿瘤切除播散的CTCs数量,可能是治疗NMIBC更为优良的手术方式。当然,这需要后续进行多中心、大样本的随机对照研究进一步验证。

