宫颈癌组织HPV16 E7蛋白表达水平与患者预后的关系研究
姚国荣 黄筱竑 黄惠莲 汪筱谢 徐彬 朱逢佳 平金良 王燕燕 顾元忻 费玉琴
全球范围内,宫颈癌占恶性肿瘤的5%,在女性恶性肿瘤中其发病率位居第二,仅次于乳腺癌[1]。宫颈癌的演变历经宫颈上皮内瘤变、早期宫颈癌、宫颈浸润癌这一连续发展的过程。HPV持续感染是宫颈癌发生的重要危险因素。HPV有200余种亚型。大多数患者HPV感染经1~2年便能自愈,但仍有小部分患者会出现HPV持续感染、宫颈上皮内瘤变甚至发展为宫颈癌。根据HPV的致病强度可以将其分为高危型和低危型两种[2]。在高危型HPV中以HPV16致病性最强,宫颈癌及癌前病变患者中至少50%以上能检测到HPV16感染。HPV16感染引发宫颈癌的机制之一是HPV16 E6、E7基因表达的 E6、E7蛋白通过与宿主p53蛋白和成视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)结合,使p53和pRb蛋白失活,引起细胞周期失控而永生化,进而导致宫颈上皮细胞恶性增生[3]。基于此,本研究通过检测购买的宫颈癌及癌旁正常宫颈黏膜组织芯片中HPV16 E7蛋白表达水平,探讨其与患者预后的关系,现报道如下。
1 材料和方法
1.1 材料 以购自上海芯超生物科技有限公司的宫颈癌及癌旁正常宫颈黏膜组织芯片(编号:HUteS154Su01)为研究材料。该芯片收集了117例2010至2011年间宫颈癌患者的癌组织样本(其中配对的癌组织和癌旁正常宫颈黏膜组织样本35例,单独癌组织样本82例);患者年龄29~70岁,中位年龄46岁。该组织芯片纳入的癌组织均经病理学检查证实为宫颈癌,患者病历资料完整、无全子宫切除史、无自身免疫性病变,癌旁正常宫颈黏膜组织与癌组织边缘距离≤1.5 cm。排除行新辅助放化疗、全身系统明显病变、近期伴阴道和宫颈手术治疗史的患者。患者生存期随访从术后至2017年3月,随访持续时间86个月。
1.2 宫颈癌及癌旁正常宫颈黏膜组织常规病理检查 采用HE染色。将组织芯片按常规HE染色方法染色,切片置于全景扫描显微镜下观察染色情况。
1.3 宫颈癌及癌旁正常宫颈黏膜组织HPV16 E7蛋白、低分子量角蛋白(low molecular weight,35βH11)、细胞增殖相关抗原(cell proliferation antigen,Ki-67)、p53、表皮生长因子受体(epidermal growth factor receptor,EGFR)、P-糖蛋白(P-glycoprotein,P-gp)、淋巴细胞瘤-2(B cell lymphoma/leukemia-2,Bcl-2)表达水平检测 采用免疫组化染色法。将组织芯片脱蜡。室温下予以3%过氧化氢溶液浸泡15 min,采用蒸馏水冲洗,并予以PBS浸泡 3次。将切片进行热抗原修复,给予 PBS液冲洗 3次,并滴加 5%BSA以封闭,于室温环境下孵育 20 min,并加入对应的HPV16 E7抗体(1∶100稀释,英国 Biorbyt公司)、35βH11 抗体(1∶100稀释,美国 COVANCE 公司)、Ki-67抗体(1∶400稀释,美国 CST公司)、p53抗体(1∶500稀释,英国 Abcam 公司)、EGFR 抗体(1∶150稀释,美国 CST公司)、P-gp抗体(1∶100稀释,英国 Abcam 公司)、Bcl-2抗体(1∶200稀释,英国Abcam公司),于 4℃ 冰箱中放置过夜。次日取出切片,于室温环境下放置 0.5 h,予以 PBS液冲洗3次,并加入生物素以标记二抗工作液,于37℃环境下孵育0.5 h。予以PBS冲洗3次,加入链霉亲和素复合体,于 37℃ 环境中孵育20 min,并取PBS冲洗3次。再滴加DAB显色剂,并予以苏木素复染,常规75%乙醇溶液脱水、透明并封片,于显微镜下查看染色情况,并控制反应时间,以终止反应。取自来水冲洗,予以复染、脱水、透明并封片。
1.4 HPV16 E7蛋白表达水平判断标准 (1)染色强度:在低倍镜(×100)下观察整个组织视野,细胞核或细胞质浅黄色为弱阳性,计1分;棕黄色为阳性,计2分;棕褐色为强阳性,计3分。(2)染色阳性率:在低倍镜(×100)下观察整个组织视野,然后选取3个不同染色强度视野在高倍镜(×400)下进行判读,计算呈棕黄色的阳性细胞数量,如果定位于细胞核,则在每个视野中随机计数100个细胞,然后计数100个细胞中阳性细胞所占比例,3个视野取平均值;如果定位于细胞质或细胞膜,同样选取3个不同染色强度视野,分别计算阳性率后取平均值。染色强度评分×染色阳性率≥2为HPV16 E7蛋白高表达,<2为低表达。
1.5 统计学处理 采用SPSS 16.0统计软件。计数资料以频数和构成比表示,HPV16 E7蛋白高表达与低表达患者比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法绘制生存曲线,HPV16 E7蛋白高表达与低表达患者生存曲线的比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌及癌旁正常宫颈黏膜组织病理检查所见HE染色显示,宫颈癌细胞核呈深蓝色,细胞质呈桃红色。癌旁正常宫颈黏膜细胞核呈蓝色,细胞质呈淡粉色。免疫组化染色显示,宫颈癌细胞核及细胞质呈棕黄色或棕褐色。癌旁正常宫颈黏膜细胞核呈蓝色,细胞质无着色或呈灰白色。HPV16 E7蛋白表达于细胞质及细胞核。见图1(插页)。
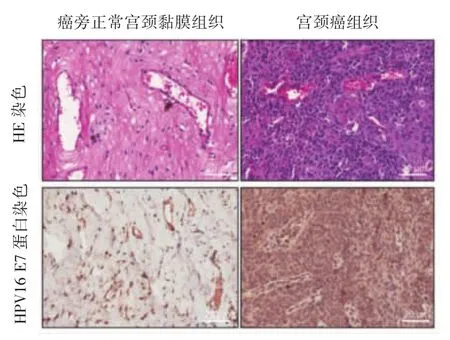
图1 宫颈癌及癌旁正常宫颈黏膜组织病理检查所见(HE染色和HPV16 E7蛋白染色,×200)
2.2 宫颈癌及癌旁正常宫颈黏膜组织HPV16 E7蛋白表达水平比较 比较染色强度评分发现,宫颈癌组织HPV16 E7蛋白表达水平高于癌旁正常宫颈黏膜组织(P<0.05),见图 2。
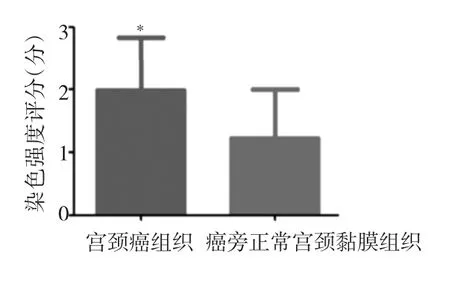
图2 宫颈癌及癌旁正常宫颈黏膜组织HPV16 E7蛋白表达水平比较
2.3 宫颈癌组织HPV16 E7蛋白高表达与低表达患者临床病理特征比较
2.3.1 宫颈癌细胞质HPV16 E7蛋白高表达与低表达患者临床病理特征比较 117例患者中宫颈癌细胞质HPV16 E7蛋白高表达74例,低表达43例。与低表达患者相比,高表达患者35βH11阳性率升高、p53阳性率升高、EGFR阳性率升高、HPV 16感染率升高(均P<0.05);年龄、病理类型、临床分期、病理分级、淋巴结转移、Ki-67、35βH11等指标比较均无统计学差异(均 P>0.05),见表 1。
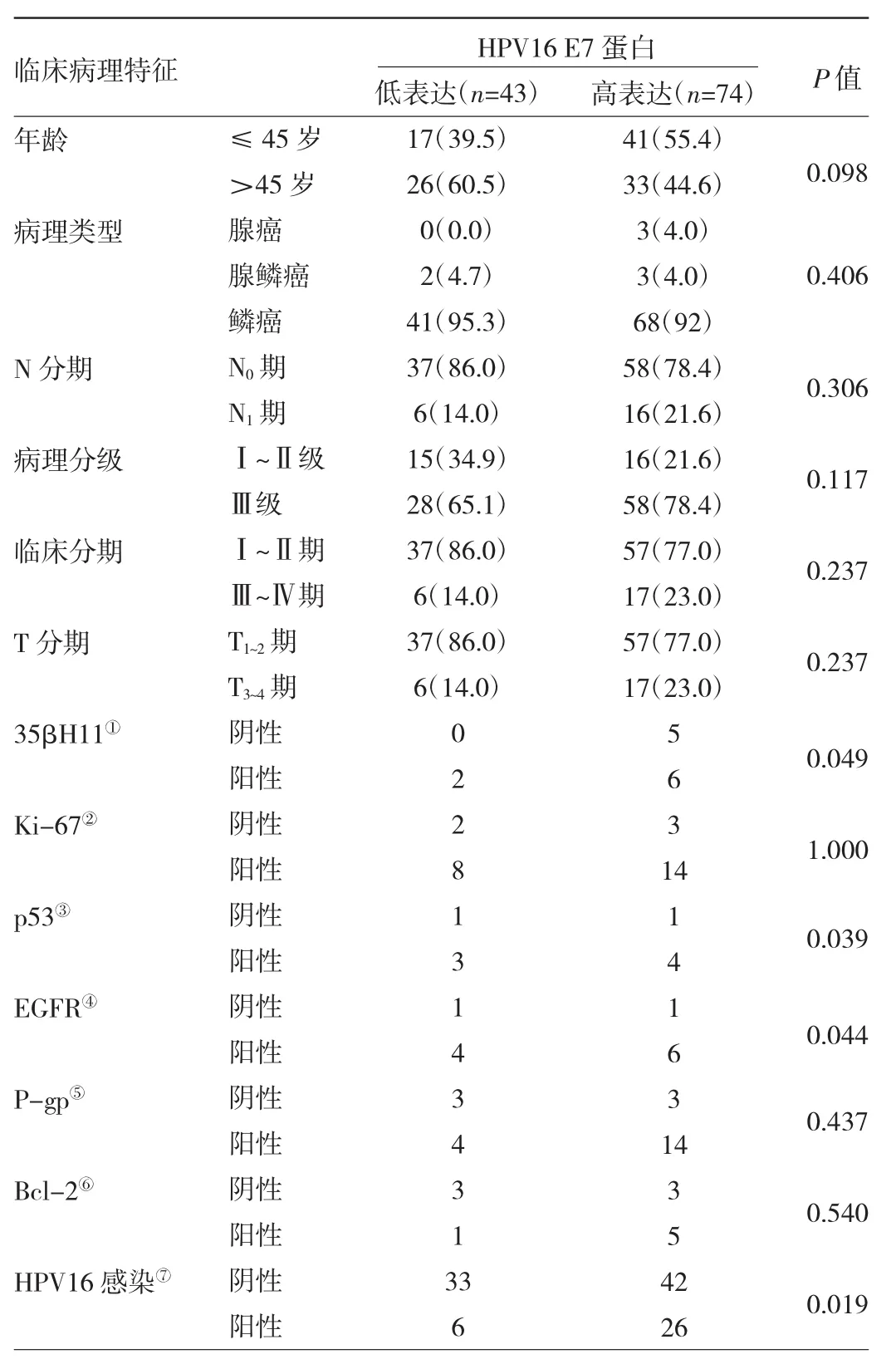
表1 宫颈癌细胞质HPV16 E7蛋白高表达与低表达患者临床病理特征比较[例(%)]
2.3.2 宫颈癌细胞核HPV16 E7蛋白高表达与低表达患者临床病理特征比较 117例患者中宫颈癌细胞核HPV16 E7蛋白高表达28例,低表达89例。与低表达患者相比,高表达患者临床病理特征比较差异均无统计学意义(均 P<0.05),见表 2。
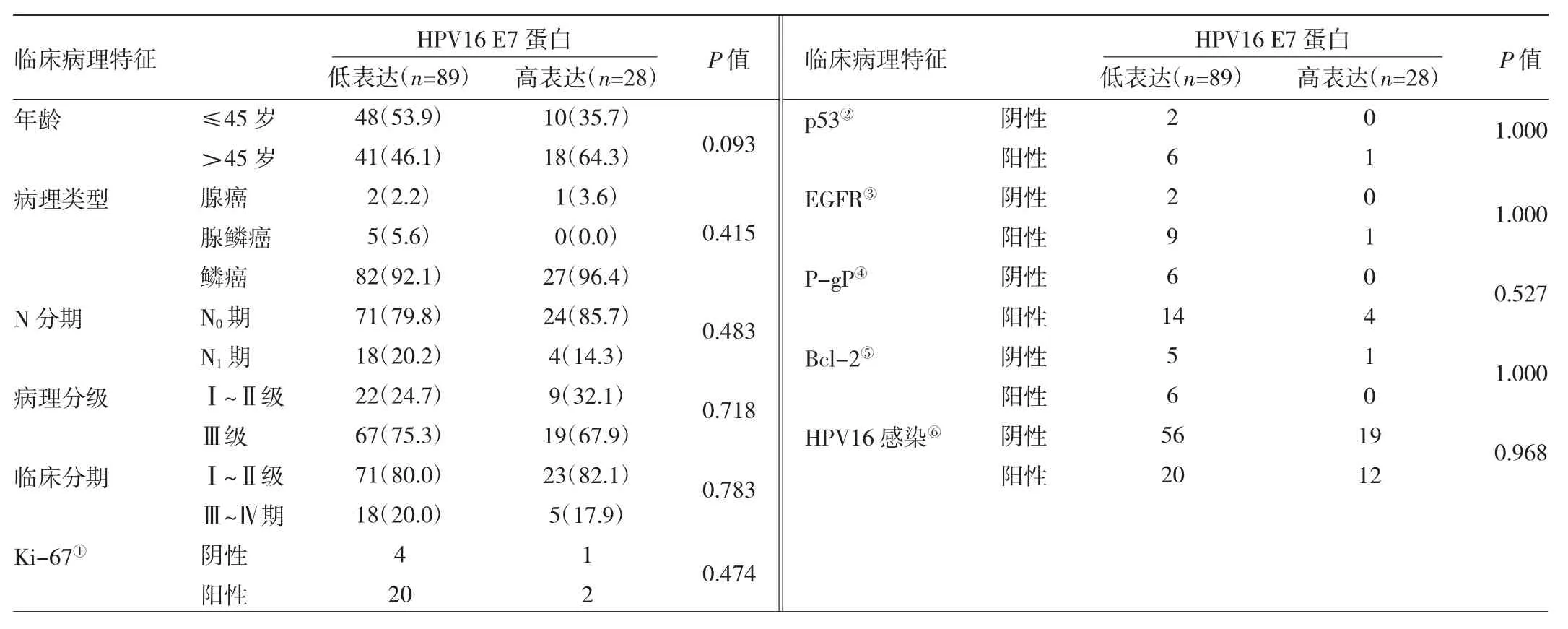
表2 宫颈癌细胞核HPV16E7蛋白高表达与低表达患者临床病理特征比较[例(%)]
2.4 宫颈癌组织HPV16 E7蛋白高表达与低表达患者预后情况比较 细胞质HPV16 E7蛋白高表达和低表达患者平均生存时间分别为68.76、75.16个月,低表达患者5年生存率高于高表达患者(81.4%比66.2%),但差异无统计学意义(P>0.05);低表达患者5年无复发生存率高于高表达患者(79.1% 比 60.8%,P<0.05)。细胞核HPV16 E7蛋白高表达和低表达患者5年生存率、5年无复发生存率比较差异均无统计学意义(70.8%比75.0%、68.5% 比 64.3%,均P>0.05),见图3。
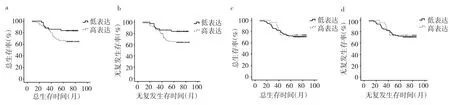
图3 宫颈癌组织HPV16 E7蛋白高表达与低表达患者预后情况比较(a、c:分别为细胞质、核HPV16 E7蛋白高表达与低表达患者总生存曲线比较;b、d:分别为细胞质、核HPV16 E7蛋白高表达与低表达患者无复发生存曲线比较)
3 讨论
HPV与多种癌症如宫颈癌、口腔癌、肺癌等的发生密切相关,而预防性HPV疫苗对HPV感染所引起的肿瘤没有治疗作用[3]。高危型HPV持续感染是宫颈癌的重要致病因素,宫颈鳞癌组织标本经提取DNA进行HPV分型及定量检测,证实超过99%的宫颈癌组织存在HPV的感染[4]。
高危型HPV持续感染引起宫颈细胞学异型性改变甚至宫颈癌的发生,其中HPV16、HPV18型最常见,而E6、E7编码蛋白是宫颈细胞恶性转化的关键[5]。有研究报道了E6蛋白通过直接抑制细胞周期蛋白表达发挥致癌作用,并且E6可负性调控Fas传导通路,抑制细胞凋亡,从而使细胞进入S期合成DNA[6]。E7蛋白是HPV主要的致癌因子,E7结构中包含两个氨基酸保守结构域CR1和CR2,其中CR1与pRb蛋白相关因子p600相互作用,导致细胞无限增殖。CR2与肿瘤抑制因子Rb结合并使其失活,活化转录因子E2F,激活S期DNA复制相关因子的转录[7]。另外,E7还可抑制细胞周期蛋白抑制因子,影响细胞的G1期正常进行,使染色体异常复制,细胞过度增殖导致癌变。此外,除了调节p53和Rb之外,也有其他机制参与了E6和E7蛋白促进肿瘤进展的过程。E7蛋白可以加速claspin翻转,引起DNA损伤修复异常[8];其他如p21、p27等可以参与E7介导的上皮细胞分化过程[9-10];E7蛋白还可以与其他“口袋蛋白”(如p107、p130)等相互作用,通过影响E2F4和E2F5调节细胞周期[11]。此外,E7蛋白还可以参与调节EGFR/PI3K/Akt信号通路,控制细胞周期、生存、代谢和基因组稳定性等[12]。
本研究探讨宫颈癌组织HPV16 E7蛋白表达水平与临床宫颈癌患者预后的关系,结果显示HPV16 E7蛋白与患者无复发生存期密切相关。宫颈癌组织HPV16 E7蛋白高表达提示宫颈癌不良预后。

