长链非编码RNA ST7-AS1靶控miR-580-3p对卵巢癌细胞增殖、迁移及侵袭能力的影响研究
徐玉红 张慧雅 王运根 陈君霞 周艳敏
卵巢癌是人类第七大常见癌症,死亡率居妇科恶性肿瘤首位。据数据统计,2018年全球185个国家中,卵巢癌新发病例超过290 000例,死亡病例超过180 000例[1]。尽管手术和化疗可以延长卵巢癌患者的生存期,但5年生存率仍然很低,不足30%[2]。作为卵巢癌预后不良的重要因素,肿瘤转移和侵袭的具体机制尚未完全明确[3]。长链非编码RNA(long non-coding RNA,lncRNA)是潜在的可用于癌症筛查和诊断的新型肿瘤标志物[4]。lncRNA中ST7-AS1是近几年新发现的重要癌症因子,在胃癌、宫颈癌中表达异常[5-6]。目前,关于ST7-AS1在卵巢癌中的表达情况及具体作用机制研究相关报道不多。且经starBase3.0软件分析预测miR-580-3p为ST7-AS作用靶点。基于此,本研究探讨ST7-AS1在上皮性卵巢癌(epithelial ovarian cancer,EOC)组织中的表达情况,并分析其对卵巢癌细胞恶性生物学行为的影响及其与miR-580-3p的调控关系,现报道如下。
1 材料和方法
1.1 材料
1.1.1 组织标本和细胞株 收集2019年6月至2021年6月绍兴市人民医院30例卵巢癌患者手术切除并经病理学检查确诊的EOC组织标本,同时取配对的癌旁正常组织(距病灶边缘<3 cm)。EOC患者年龄41~84岁,中位年龄58.5岁;病理分期Ⅰ期11例,Ⅲ期15例,Ⅳ期4例。所有患者术前均未进行新辅助化疗或中医药治疗,组织标本采集后立即置于液氮中冻存。本研究经医院医学伦理委员会批准,患者知情同意并签署知情同意书。人卵巢癌A2780细胞株购自上海icell生物技术公司。
1.1.2 主要试剂和仪器 胰酶,100 U/ml青、链霉素双抗,FBS购自美国Gibco公司。1640培养基购自上海icell生物技术公司。TRIzol试剂、Lipofectamine 2000转染试剂购自美国invitrogen公司。逆转录试剂盒、荧光定量PCR试剂盒购自日本TaKaRa公司。CCK-8试剂盒购自美国MedChemExpress公司。Transwell小室、Matrigel基质胶购自美国Corning公司。引物序列、小干扰 RNA(siRNA)、miR-580-3p 模拟物(miR-580-3p mimic)及阴性对照(NC mimic),ST7-AS1 野生型和突变型双荧光素酶报告载体均由上海吉玛制药公司设计合成。双荧光素酶报告系统检测试剂盒购自美国Promega公司。荧光实时定量PCR仪购自德国Roche公司,倒置荧光显微镜购自日本Olympus公司,酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 EOC组织与癌旁正常组织ST7-AS1、miR-580-3p表达水平检测 采用荧光实时定量PCR法。利用TRIzol试剂提取组织标本中的RNA,采用逆转录试剂盒将1 μg的总RNA反转录为cDNA,按荧光定量PCR试剂盒说明书进行qPCR。ST7-AS1的引物序列上游 5'-ACCCTACTCTGCCTCCCTTAT-3',下游 5'-TAGCATCTGCCACCCAAATC-3';miR-580-3p 的引物序列 5'-GCTGCGTTGAGAATGATGAATC-3',下游 5'-AGTGCAGGGTCCGAGGTATT-3',GADPH 的引物序列上游 5'-CATGAGAAGTATGACAACAGCCT-3',下 游5'-AGTCCTTCCACGATACCAAAGT-3'。以 GADPH 为内参基因,采用 2-ΔΔCt法计算 ST7-AS1 和 miR-580-3p 的相对表达水平。
1.2.2 细胞培养及转染 采用siRNA转染技术,设计合成si-ST7-AS1转染入细胞,敲除卵巢癌A2780细胞中ST7-AS1,设计合成阴性对照si-NC转染入细胞。具体如下:卵巢癌A2780细胞株在含10%FBS,1%双抗和1%谷氨酰胺的1640培养基中培养,置于37℃、5% CO2的培养箱中,每1~2 d换液。将生长状态良好的处于对数生长期的细胞接种于6孔培养板中,当细胞融合度达60%~70%时,根据Lipofectamine 2000转染试剂盒说明书进行转染,分别转染si-ST7-AS1(si-ST7-AS1组)和阴性对照 si-NC(si-NC组)。转染后48 h,采用荧光实时定量PCR法检测两组细胞ST7-AS1表达水平验证转染效果。
1.2.3 细胞增殖能力检测 采用CCK-8法。将si-ST7-AS1组和si-NC组细胞重悬调整密度为1×104/ml,取100 μl/孔铺于96孔培养板,于接种培养第6、24、48、72 h每孔加入10 μl的CCK-8溶液,将培养板置于培养箱中继续孵育1 h,在酶标仪上450 nm处测定各孔吸光度(OD)。
1.2.4 细胞迁移能力检测 采用Transwell迁移实验。细胞转染48 h后消化离心,用无血清1640培养液将细胞重悬调整密度为 1×105/ml,Transwell上室加入200 μl/孔的细胞悬液,培养板下室每孔加入 500 μl/孔的完全培养液,培养板置于培养箱中继续培养48 h后取出小室,甲醇固定和0.1%结晶紫溶液染色各30 min,PBS清洗。棉签擦拭上室中未穿过基底膜的卵巢癌细胞。100倍显微镜下观察,随机选取5个视野拍照,对穿过基底膜的卵巢癌细胞进行计数,取平均值。
1.2.5 细胞侵袭能力检测 采用Transwell侵袭实验。将Matrigel基质胶与1640空培养液按1:8比例稀释后轻轻混匀,以100 μl/孔加入到Transwell小室的上室中,将培养板置于培养箱中6 h以充分凝固。后续同Transwell迁移实验。
1.2.6 双荧光素酶报告试验 将构建好的ST7-AS1野生型(WT-ST7-AS1)和突变型(MUT-ST7-AS1)双荧光素酶报告载体分别与miR-580-3p mimic或NC mimic共转染卵巢癌A2780细胞,转染48 h后,收集并裂解细胞,离心收集上清液,根据试剂盒说明书检测荧光素酶活性。
1.3 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 EOC组织与癌旁正常组织ST7-AS1表达水平比较 ST7-AS1在EOC组织中的表达水平(2.23±1.34)高于癌旁正常组织(1.23±0.70),差异有统计学意义(P<0.01),见图 1。
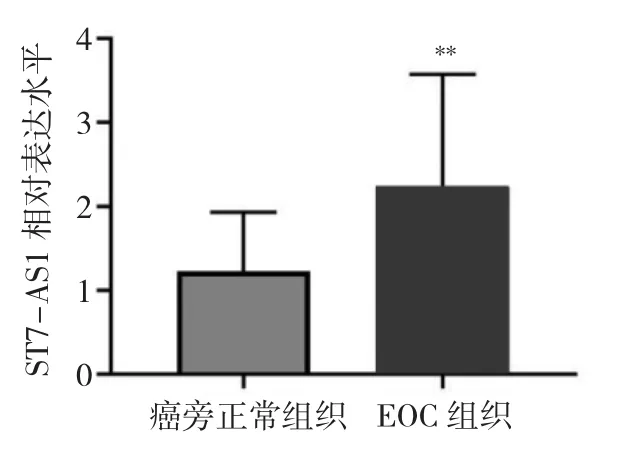
图1 EOC组织与癌旁正常组织ST7-AS1表达水平比较
2.2 si-ST7-AS1组与si-NC组卵巢癌细胞ST7-AS1表达水平及增殖、迁移、侵袭能力比较 与si-NC组相比,si-ST7-AS1组卵巢癌细胞ST7-AS1表达水平明显降低[(0.41±0.07)比(1.01±0.15)],差异有统计学意义(P<0.01),即转染成功,见图 2a。下调 ST7-AS1表达后,si-ST7-AS1组细胞 24、48、72 h细胞增殖能力分别为 0.58±0.01、0.80±0.04、0.91±0.05,低于 si-NC 组0.63±0.04、0.88±0.03、1.18±0.09,差异均有统计学意义(均P<0.05),见图2b。Transwell迁移实验表明,与si-NC 组(715.20±28.43)相比,si-ST7-AS1组(359.20±22.88)穿过基底膜的细胞数减少(P<0.01),见图 2c。Transwell侵袭实验表明,与 si-NC 组(736.40±32.59)相比,si-ST7-AS1组(320.40±29.35)穿过基底膜的细胞数减少,差异有统计学意义(P<0.01),见图2d。
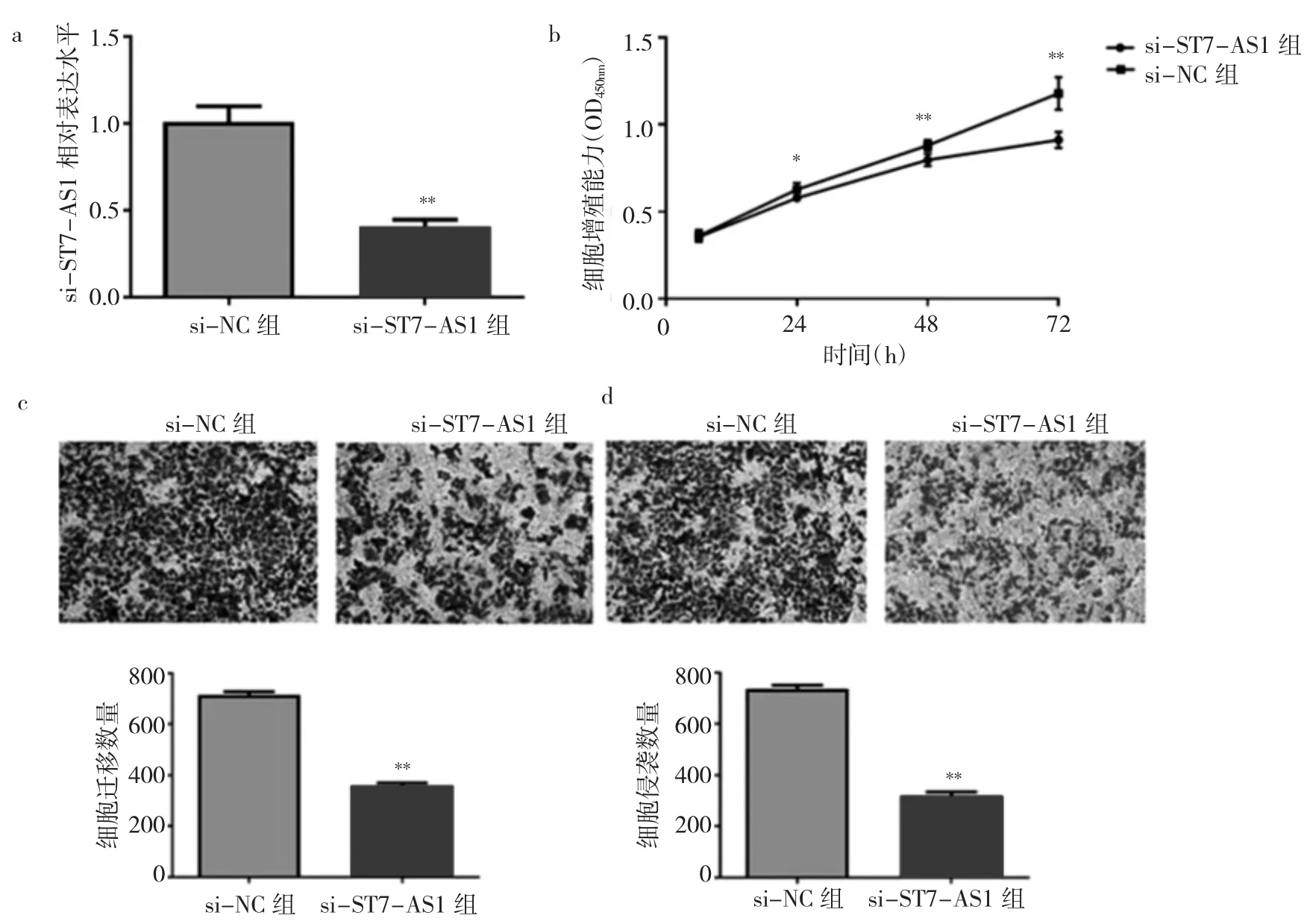
图2 si-ST7-AS1组与si-NC组卵巢癌细胞ST7-AS1表达水平及增殖、迁移、侵袭能力比较[a:ST7-AS1表达水平比较;b:增殖能力比较;c:迁移能力比较(×100);d:侵袭能力比较(×100)]
2.3 ST7-AS1靶向调控miR-580-3p验证结果 通过starBase3.0软件分析预测显示,ST7-AS1序列中含有与miR-580-3p互补的结合位点,见图3a。与NC mimic组细胞(0.98±0.07)相比,miR-580-3p mimic组细胞(0.61±0.09)野生型WT-ST7-AS1的荧光素酶相对活性显著下降(P<0.01),而两组的突变型MUT-ST7-AS1的荧光素酶相对活性没有明显变化[(0.96±0.07)比(0.95±0.08),P >0.05],见图 3b。与癌旁正常组织(1.17±0.71)相比,miR-580-3p在卵巢癌组织(0.71±0.39)中的表达水平下降(P<0.01),见图 3c。si-ST7-AS1组细胞miR-580-3p的表达水平为(4.69±1.39),较si-NC 组(1.08±0.47)升高,差异有统计学意义(P<0.05),见图 3d。
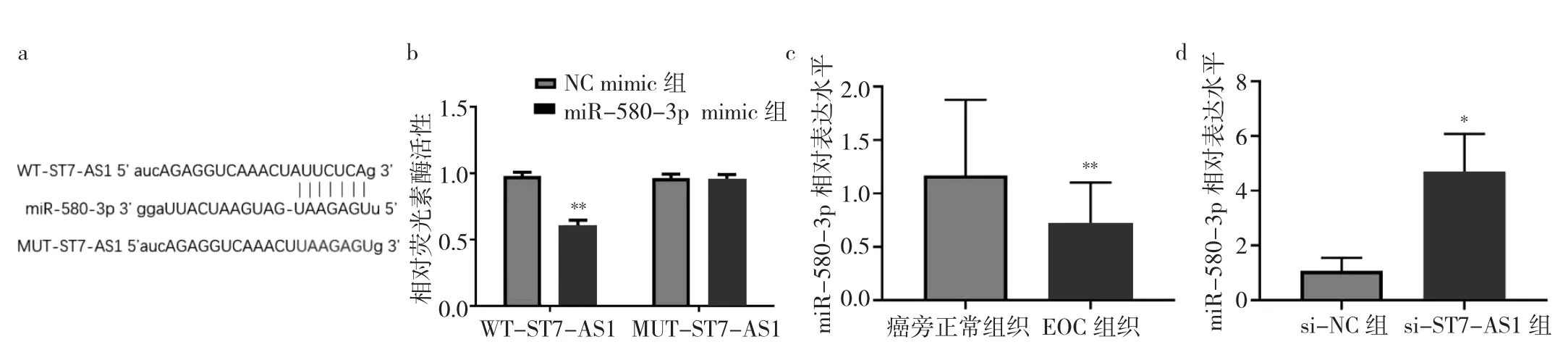
图3 ST7-AS1靶向调控 miR-580-3p验证结果(a:软件预测结果;b:WT-ST7-AS1、MUT-ST7-AS1荧光素酶活性比较;c、d:分别为组织细胞miR-580-3p表达水平比较)
3 讨论
目前研究认为,lncRNA可通过影响细胞增殖、迁移、侵袭、凋亡、细胞周期等途径参与肿瘤疾病发生、发展[7]。多种lncRNA在卵巢癌中发挥了致癌或抑癌的作用。Xu等[8]研究发现,卵巢癌组织中lncRNA EIBC表达上调,lncRNA EIBC的表达水平与肿瘤体积、淋巴结转移、预后等密切相关,抑制lncRNA EIBC表达后卵巢癌细胞的增殖、迁移及侵袭能力下降,且顺铂耐药性被抑制。lncRNA GAS5表达水平在卵巢癌组织中降低,卵巢癌细胞中过表达lncRNA GAS5可明显抑制癌细胞增殖及克隆形成,促进细胞凋亡,深入研究lncRNA GAS5的致病机制发现其在卵巢癌中可能通过细胞炎性坏死发挥作用[9]。目前,多项研究表明,lncRNA ST7-AS1在癌症中表达失调,可作为潜在的新型的肿瘤标志物。Zhang等[10]研究表明,ST7-AS1与乳腺癌免疫浸润相关,是乳腺癌潜在的新型预测指标。Qin等[11]研究发现111种与喉鳞状细胞癌相关的lncRNA,ST7-AS1表现出最高的表达异常。ST7-AS1在喉癌组织及细胞中表达升高,它可以与组蛋白精氨酸甲基转移酶 1(coactivatorassociated arginine methyltransferase 1,CARM1)相互作用,通过ST7-AS1/CARM1/Sox-2信号轴在喉癌中发挥致癌作用。ST7-AS1在胃癌组织及细胞系中表达升高,胃癌细胞中敲除ST7-AS1后细胞的增殖、迁移及侵袭能力减弱,细胞凋亡增加,组蛋白甲基转移酶(enhancer of zeste homolog 2,EZH2)可与ST7-AS1相互作用,削弱ST7-AS1对癌细胞的迁移及侵袭能力[6]。EOC是卵巢癌最常见的组织学类型,关于ST7-AS1在EOC中的表达情况及具体的致癌机制,相关报道较少。本研究发现,与癌旁正常组织相比,ST7-AS1在EOC组织中呈现高表达,卵巢癌A2780细胞中抑制ST7-AS1表达后,癌细胞的增殖、迁移及侵袭能力减弱,提示ST7-AS1在EOC中具有致癌作用,其可能通过增强癌细胞的恶性生物学行为促进EOC进展。由于笔者单位能收集到的非EOC的组织样本较少,本次研究未能检测ST7-AS1在其他病理类型的卵巢癌中的表达情况,后续笔者将收集足够的样本进行相关的研究。
作为内源性非编码小RNA,miRNA在卵巢癌中表达异常,将有可能作为卵巢癌诊断、预后的预测指标及潜在治疗靶点[12]。研究表明,lncRNA可通过竞争性吸附miRNA抑制其表达,导致miRNA介导的靶基因表达失调而在卵巢癌进展中发挥作用[13-14]。有研究发现,环状RNA circRAB3IP通过吸附miR-580-3p上调TWIST1促进骨肉瘤进展[15]。此外,lncRNA LHFPL3-AS1/miR-580-3p/STAT3轴通过激活JAK2/STAT3信号通路促进黑色素瘤恶性转移[16]。本研究通过starBase3.0软件分析预测ST7-AS1与miR-580-3p存在结合位点,由此推测ST7-AS1可能通过吸附miR-580-3p参与卵巢癌进展。本研究表明,miR-580-3p在EOC组织中表达下降,在卵巢癌A2780细胞系中ST7-AS1负性靶控miR-580-3p。通过本研究,笔者认为ST7-AS1可能通过竞争性吸附miR-580-3p介导其下游靶基因表达失衡促进卵巢癌进展。基于该推测,后续笔者将进一步研究探讨与miR-580-3p相关的靶基因以分析ST7-AS1在卵巢癌中的具体致癌机制。
综上所述,LncRNA ST7-AS1在EOC组织中表达升高,抑制ST7-AS1表达可能通过竞争性吸附miR-580-3p致卵巢癌细胞增殖、迁移及侵袭能力减弱。ST7-AS1/miR-580-3p轴可能是EOC潜在的诊断及治疗靶点,深入研究ST7-AS1对miR-580-3p的具体调控机制或可进一步阐明卵巢癌的发病机制,为卵巢癌的靶向治疗提供新的方向。

