体外氧糖剥夺培养条件促进人牙髓细胞内质网应激的研究
李莉芬, 朱亚琴, 江龙
上海交通大学医学院附属第九人民医院口腔综合科,上海交通大学口腔医学院,国家口腔医学中心,国家口腔疾病临床研究中心,上海市口腔医学重点实验室
内质网是细胞蛋白质合成加工的主要场所,多种因素如氧化应激、钙离子紊乱、细菌感染等刺激下均可影响细胞蛋白质的合成,破坏内质网的稳态。内质网通过减少蛋白质翻译、分子伴侣以及相关蛋白表达上调,促进错误折叠蛋白质降解等途径恢复稳态,以上变化统称内质网应激(endo⁃plasmic reticulum stress,ERS)[1]。内质网应激的作用是促进蛋白质降解以期恢复内质网的体内平衡。然而,如果没有实现内质网体内平衡,当细胞内的错构蛋白质超过内质网的处理极限时,促凋亡因子C/EBP 同源蛋白(C/EBP homologous protein,chop)[2]和caspase⁃12 等[3]介导的细胞凋亡途径就会被激活,引起细胞的死亡。缺血条件下,细胞生命活动所依赖的糖和氧气不足,易发生内质网应激,这在多项研究中得到了证实。体外氧糖剥离(oxygen⁃glucose deprivation,OGD)是目前国际上比较公认的体外模拟细胞缺血的手段[4],研究显示,内质网应激可调节OGD 导致的人SH⁃SY5Y 细胞的死亡[5]、小鼠骨细胞死亡[6],并参与肾脏缺血再灌注损伤[7]。牙髓由于其特殊的解剖结构,被低让性的硬组织所包绕,缺乏有效的侧枝循环,因此在受到外界刺激如外伤、充填操作以及局部药物应用等情况下,易发生缺血现象[8⁃9]。目前对缺血条件下牙髓生物学行为了解并不多,内质网应激是否参与调控缺血条件下牙髓细胞的生命活动尚不清楚。因此,本研究通过无血清DMEM 加上低氧(2%O2)建立人牙髓细胞(human dental pulp cells,hD⁃PCs)OGD 模型来模拟牙髓细胞缺血[10⁃12],检测其内质网应激变化情况及调控机制。
1 材料和方法
1.1 主要实验试剂和仪器
DMEM 高糖培养基、胎牛血清(Hyclone,美国);0.25%胰蛋白酶(Gibico,美国);噻唑蓝[3⁃(4,5⁃dimethyl⁃2⁃thiazolyl)⁃2,5⁃diphenyl⁃2H⁃tetrazolium bromide,MTT]、二甲基亚枫(dimethyl sulfoxide,DMSO)、β⁃甘油磷酸钠、Trizol 总RNA 提取试剂(Sigma,美国);地塞米松(Sigma,美国),维生素C(Sigma,美国);BCIP/NBT 碱性磷酸酶(alkaline phosphatase,ALP)显色试剂盒、RIPA 蛋白裂解液、BCA 蛋白浓度试剂盒(碧云天,上海);RNA 逆转录试剂盒、Realtime PCR 试剂盒(Takara,日本);兔抗鼠磷酸化RNA 依赖的蛋白激酶样内质网激酶(phospho⁃PKR like ER kinase,p⁃perk)抗体(1∶1 000稀释)、兔抗鼠磷酸化活化真核起始因子2α(phospho⁃eukaryotic initiation factor,p⁃eIF2α)抗体(1∶1 000 稀释)、鼠抗人β⁃actin 抗体(1∶5 000 稀释)(Cell Signaling,美国),鼠抗人基质细胞抗原⁃1(stromal cell antigen⁃1,STRO⁃1)抗体(1∶1 000 稀释)(Abcam,美国);酶标仪(Infinite,Tecan,瑞士);流式细胞仪(Attune NxT,BD,美国);倒置显微镜(IX70,奥林巴斯,日本)。
1.2 hDPCs 的培养与鉴定
本实验已经获得上海交通大学医学院附属第九人民医院伦理委员会的批准(审批号:SH9H⁃2020⁃T305⁃1)。取14~28 岁健康个体因治疗需要拔除的健康恒牙,用无菌PBS 冲洗。利用灭菌的高速涡轮开髓,取出牙髓组织,并用组织剪把牙髓组织剪成约1.0 mm3大小的组织块,均匀铺在培养皿底部,表覆细胞培养专用玻片,加入20%胎牛血清的DMEM 培养液,于培养箱37 ℃,5%CO2培养。每72 h 换1 次培养液,待细胞长满后进行传代培养。
取第三代长势良好的细胞融合至70%~80%时,更换矿化诱导液培养(含有10 mmol/L β 甘油磷酸钠、50 μg/L 维生素C 和0.1 μmol/L 地塞米松的DMEM 培养液),培养7 d 后取出,PBS 洗涤,4%多聚甲醛固定10 min 后进行ALP 染色。收集第2 代细胞制备单细胞悬液,PBS 洗涤后离心,重悬获得细胞悬液后装入EP 管中,加入STRO⁃1 抗体避光孵育30 min 后,离心5 min 后去上清加入PBS 重悬,使用流式细胞仪进行检测。
1.3 OGD 模型建立及hDPCs 形态观察、活性检测
取第三代牙髓细胞生长至80%~90%时,进行OGD 处理。OGD 处理前一天撤掉血清,将无糖培养基放入低氧培养箱(2%O2)中30 min,同时弃掉细胞原有的高糖培养基,更换为无糖培养基,进行低氧培养(作为OGD 培养条件),常规培养的细胞作为对照。
OGD 培养0、2、4、8 h 时,显微镜下观察细胞形态变化。
在96 孔板中将hDPCs 以每孔5 × 104个接种(每孔100 μL),常规培养孵育24 h,去除上清,每孔加入100 μL 无糖DMEM 培养液后置于2%O2培养。所有组别均设5 个复孔。分别培养0、2、4、8 h后,每孔加入20 μL MTT 溶液置于培养箱避光孵育4 h 后弃上清液,加入DMSO 终止反应。常温充分震荡10 min 后,酶标仪选定490 nm 波长检测每孔吸光度值。
1.4 qRT⁃PCR
将OGD 培养4 h 的hDPCs 取出,加入Trizol 获取细胞总RNA。每个样品的RNA 反转录为cDNA,然后以SYBGreen 为探针进行荧光定量PCR 反应,检测内质网应激关键基因剪切型X 盒结合蛋白1(spliced X⁃box binding protein 1,sXBP1)、激活转录因子4(activating transcription factor 4,ATF4)、chop mRNA 表达。以管家基因GAPDH 作为对照,具体引物序列参照文献[13]详见表1。

表1 qRT⁃PCR 引物序列[13]Table 1 Sequences of the qRT⁃PCR primers[13]
1.5 Western blot 检测
取OGD 培养4 h 的hDPCs,用预冷PBS 冲洗细胞3 次,加入RIPA 裂解液冰上裂解收取上清液。用BCA 法检测细胞样本总蛋白浓度。蛋白样品经聚丙烯酰胺凝胶电泳电泳分离,转至聚偏二氟乙烯膜膜上,脱脂奶粉封闭2 h 后,加入p⁃perk、p⁃eIF2α、β⁃actin 抗体,4 ℃孵育过夜,二抗孵育1 h,洗膜后电化学发光显色拍照。
1.6 统计学分析
采用SPSS18.0 软件包对数据进行t检验,检验水准α=0.05。
2 结 果
2.1 hDPCs 的体外培养
原代培养1 周左右,倒置显微镜中可见散在的牙髓细胞从各个组织块边缘爬出,呈梭形,形态类似于成纤维细胞;常规传代后,贴壁生长于整个培养皿底部(图1a、1b);流式细胞仪检测到牙髓细胞STRO⁃1 抗体表达阳性(图1c);矿化诱导7 d 后,细胞ALP 染色呈阳性(图1d);以上结果符合文献对于hDPCs 特性的报道[14]。
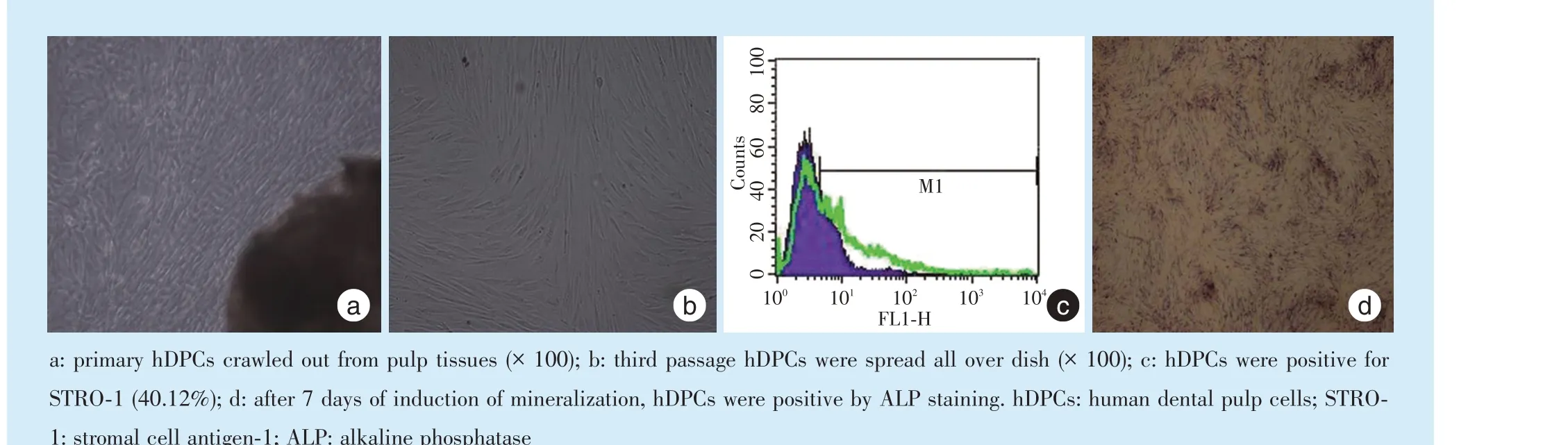
Figure 1 Culture of hDPCs in vitro图1 人牙髓细胞的体外培养及鉴定
2.2 OGD 培养对hDPCs 细胞形态、活性的影响
显微镜下观察发现,对照组细胞呈梭形,胞体饱满,细胞连接紧密(图2a);OGD 处理2 h 后细胞排列较稀疏,胞体变肿胀,可见少量死细胞(图2b),OGD 处理4 h 后,细胞排列更加稀疏,细胞完整性遭到严重破坏,胞膜破裂,可见大量悬浮死细胞(图2c);OGD 处理8 h 后细胞大量死亡,基本无细胞结构(图2d)。
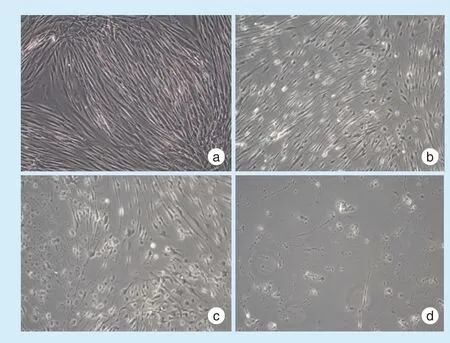
Figure 2 Morphological changes in hDPCs after different OGD culture times图2 氧糖剥夺不同时间下牙髓细胞形态变化
MTT 实验结果显示,与未经OGD 处理的细胞相比,随着OGD 处理时间增加,hDPCs 吸光度值逐渐下降,细胞存活率下降,2 h、4 h、8 h 组与对照组(0 h)差异均有统计学意义(图3)。由于OGD 处理时间过长,细胞大部分发生死亡,因此将之后的OGD 处理时间设为4 h。

Figure 3 Detection of survival rate of hDPCs after different OGD culture times图3 氧糖剥夺不同时间hDPCs 细胞存活率检测
2.3 qRT⁃PCR 结果
与常规培养细胞相比,OGD 培养4 h 后,hDPCs内质网应激关键分子mRNA 表达明显增加:sXBP1(t=7.441)、ATF4(t=6.953)、chop(t=7.989)的mRNA相对表达明显上调(P<0.05)(图4)。
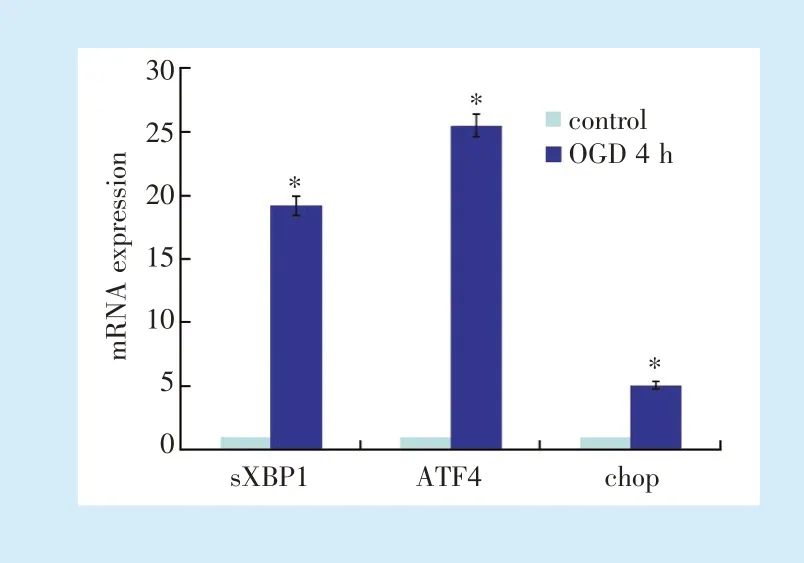
Figure 4 mRNA expression of endoplasmic reticulum stress markers detected by qRT⁃PCR 4 h after OGD culture图4 qRT⁃PCR 检测OGD 培养4 h 后hDPCs 内质网应激关键信号分子mRNA 表达
2.4 Western blot 结果
OGD 处理4 h 后,hDPCs p⁃perk(t=13.681)和p⁃eIF2α(t=42.907)蛋白水平增加(P<0.05)(图5)。
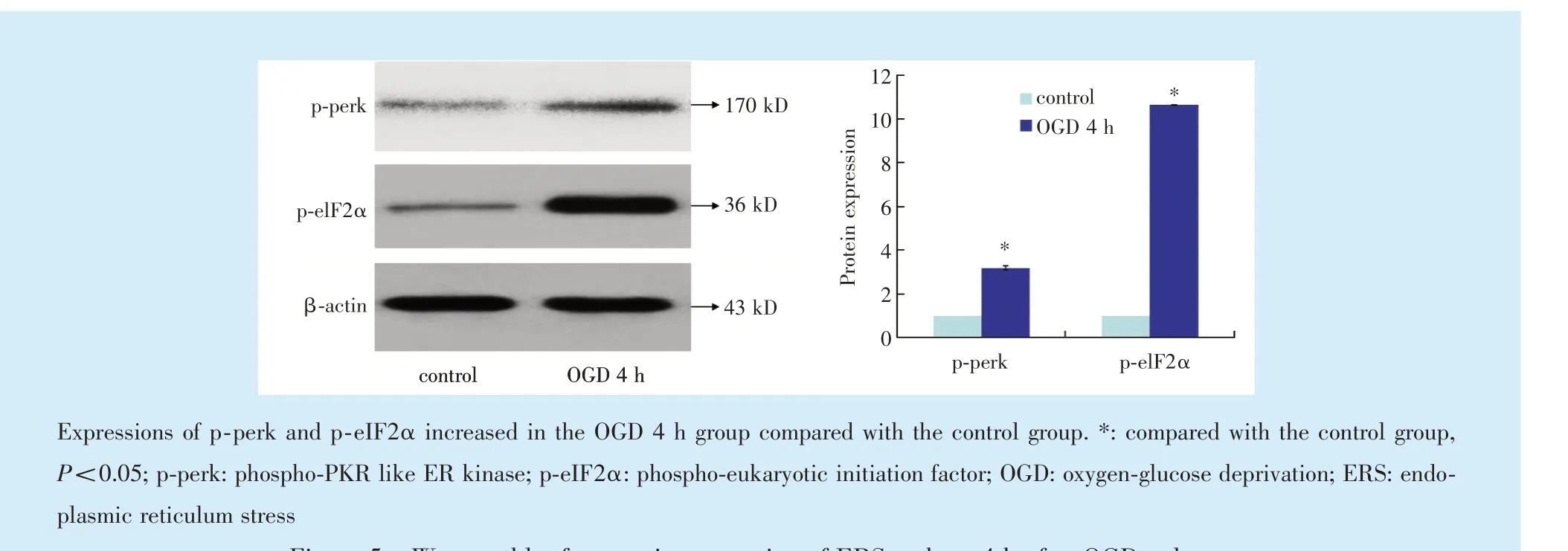
Figure 5 Western blot for protein expression of ERS makers 4 h after OGD culture图5 Western blot 检测OGD 培养4 h 后hDPCs 内质网应激关键信号分子蛋白表达
3 讨 论
牙髓作为结缔组织,含有神经和血管,但由于其仅通过根尖孔与外界相通,因此在发生组织炎症、外伤、局部物理或化学药物刺激时很容易出现血供减少的现象。血供减少将导致细胞氧气和葡萄糖供应不足,限制了细胞能量产生所需的基本物质,造成细胞处于低能量状态,扰乱细胞正常活动,最终导致细胞的死亡[15]。内质网应激则是细胞面对此类刺激产生的反应。细胞通过内质网应激减少未折叠或错构蛋白的堆积使内质网功能恢复稳态,从而调节细胞的生命活动[16],为了证实在缺血缺氧条件下,内质网应激是否参与了调控牙髓细胞的生命活动。本研究首先在体外建立了OGD 模型,模拟细胞的体外缺血[4,10]。本研究实验结果显示,OGD 处理的hPDCs,胞体肿胀变圆,排列疏松,漂浮的死细胞增多;较正常培养的细胞存活率下降,并呈现出明显的时间趋势。
同时,本研究从mRNA 和蛋白水平两方面比较了OGD 处理和正常培养的hPDCs 内质网应激水平的变化。perk、ER 跨膜蛋白肌醇酶1(inositol⁃re⁃quiring enzyme type 1,IRE1)和ATF6 这3 个跨膜蛋白是细胞内质网应激的启动因子[17⁃19]。细胞受到刺激后,内质网应激信号通路启动,可以激活各种转录因子,诱导下游目的基因的表达,磷酸化的IRE1 能够诱发sXBP1 的mRNA 剪切成具有高度转录活性的sXBP1[20]。同时perk 蛋白的激活能够增加eIF2α 的磷酸化从而导致转录因子ATF4 的活化[21]。如果细胞内质网应激活动持续发生而无法被缓解,则会进一步会激活信号通路的下游因子chop[2]的表达,从而调控细胞的凋亡。在本研究中,OGD 诱导的牙髓细胞ATF4、chop 和sXBP1 分子的mRNA 表达明显升高;同时,磷酸化perk 和eIF2α蛋白的表达明显增加。这些结果提示,hPDCs在OGD 条件下内质网应激水平上调。
综上所述,hPDCs 在OGD 条件下细胞活性下降,并伴随内质网应激活动增强。在其他组织细胞的研究中发现,适度的内质网应激可以保护细胞,而持续严重的内质网应激活动则可以导致细胞死亡,同时会引起细胞内质网的扩张,并观察到细胞胞浆出现大量空泡[22]。在机体脑缺血再灌注损伤的研究中发现,内质网应激可以通过诱导cas⁃pase12 激活[23],引起一系列的级联反应,引发细胞的凋亡,从而加重机体细胞的损伤,然而hPDCs 在OGD 条件下,内质网应激的调控机制还不清楚。需要进一步的研究来阐明内质网应激与牙髓缺血的关系,为牙髓病治疗提供新的策略和方向。
【Author contributions】Li LF designed the study, peformed the ex⁃periments,analyzed the data,and wrote the article. Zhu YQ,Jiang L revised the article. All authors read and approved the final manuscript as submitted.

