过敏性鼻炎-哮喘综合征患儿血清25(OH)D与病情控制的相关性
李定富,黄 健,蔡枚龄,王丽珍,简开乾,杨飞飞
(1.海南西部中心医院检验科,海南 儋州 571700;2.海南西部中心医院儿科,海南 儋州 571700;3.咸阳市中心医院检验科,陕西 咸阳 712000)
过敏性鼻炎-哮喘综合征是一种慢性呼吸系统疾病,与单纯哮喘或过敏性鼻炎相比,患儿呼吸系统的情况会进一步恶化、合并症更多、生活质量更低[1]。有研究结果显示,过敏性鼻炎-哮喘综合征发病与年龄、空气污染、呼吸道感染等多种危险因素相关[2]。以往关于过敏性鼻炎-哮喘综合征的研究多侧重于比较哮喘、过敏性鼻炎和过敏性鼻炎-哮喘综合征的临床特征,缺乏对疾病发病危险因素的关注。近年来,25-羟基维生素D[25-hydroxyvitamin D,25(OH)D]在肺部疾病中的作用越来越受到关注,25(OH)D缺乏在哮喘患儿中很常见,并与肺功能的恶化有关[3]。哮喘患儿25(OH)D的降低会导致病情恶化,补充维生素D能有效预防病情的恶化[4]。另外,高25(OH)D水平与哮喘患者的肺功能改善、糖皮质激素反应性升高有关[5]。目前,关于血清25(OH)D水平与过敏性鼻炎-哮喘综合征的关系尚未见报道。因此,本研究拟探讨过敏性鼻炎-哮喘综合征患儿血清25(OH)D水平与病情严重程度及激素反应性的相关性。
1 材料和方法
1.1 研究对象
选取2017年12月—2020年1月海南西部中心医院就诊的过敏性鼻炎患儿50例,其中男28例、女22例,年龄(8.1±3.6)岁,病程(2.2±1.4)年,激素使用率为100%(50/50);哮喘患儿50例,其中男31例、女19例,年龄(7.8±3.5)岁,病程(2.8±1.1)年,激素使用率为92%(46/50);过敏性鼻炎-哮喘综合征患儿50例,其中男30例、女20例,年龄(8.0±2.8)岁,病程(2.7±1.3)年,激素使用率为100%(50/50)。以同期海南西部中心医院体检健康儿童50名作为正常对照组,其中男25名、女25名,年龄(8.5±3.1)岁。4组之间上述基线资料差异均无统计学意义(P>0.05)。本研究经海南西部中心医院伦理委员会批准,所有对象的家属均自愿签署知情同意书。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)年龄6~12岁;(2)小儿哮喘、过敏性鼻炎及过敏性鼻炎-哮喘综合征的诊断符合文献[6-8]中的标准。
1.2.2 排除标准 (1)肝、肾功能不全患儿;(2)合并内分泌系统疾病或肾病等可能影响血清25(OH)D水平疾病患儿;(3)营养不良或消耗性疾病患儿;(4)恶性肿瘤患儿;(5)额外补充25(OH)D者;(6)临床信息不全者。
1.3 方法
1.3.1 肺功能测定 采用CHESTAC-8900D肺功能检测系统(日本捷斯特株式会社)测定所有对象的肺功能,包括用力肺活量(forced vital capacity,FVC)、一秒用力呼气容积(forced expiratory volume in one second,FEV1)、中期呼气流速(forced expiratory flow rate 25%-75%,FEF25%~75%)、最大呼吸流量(peak expiratory flow,PEF)。
1.3.2 病情控制评估 采用改良英国医学研究会呼吸困难指数(modified British medical research council,mMRC)评分[9]评估哮喘和过敏性鼻炎-哮喘综合征患儿呼吸困难的严重程度,总分为0~4分,得分越高说明呼吸困难越严重。使用过敏性鼻炎评分量表(score for allergic rhinitis,SFAR)[10]评估过敏性鼻炎和过敏性鼻炎-哮喘综合征患儿的病情控制情况,总分为0~16分,得分越高说明患儿病情控制越差。使用哮喘控制测试(asthma control test,ACT)[11]评估哮喘和过敏性鼻炎-哮喘综合征患者的病情控制情况,总分为5~25分,得分越高说明病情控制越好。
1.3.3 临床信息采集 收集所有对象年龄、性别、体质量指数(body mass index,BMI)等临床资料。根据激素使用情况,将吸入糖皮质激素200~400 μg/d作为低剂量激素组,400~800 μg/d为中剂量激素组,>800 μg/d为高剂量激素组。
1.3.4 血清25(OH)D测定 采集所有对象空腹静脉血5 mL,离心分离血清。采用酶联免疫吸附试验检测血清25(OH)D水平,试剂盒购自北京荣志海达生物科技有限公司。以血清25(OH)D<20 ng/mL为维生素D缺乏[12]。
1.4 统计学方法
采用SPSS 26.0软件进行统计分析。呈正态分布的数据以±s表示,多组间比较采用方差分析。计数资料以例或率表示,组间比较采用χ2检验。采用线性回归分析评估血清25(OH)D水平对肺功能及病情控制情况的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 各组之间血清25(OH)D水平比较
哮喘组、过敏性鼻炎组、过敏性鼻炎-哮喘综合征组血清25(OH)D水平均低于正常对照组(P<0.01),且哮喘组、过敏性鼻炎组、过敏性鼻炎-哮喘综合征组之间差异均有统计学意义(P<0.01)。见表1。
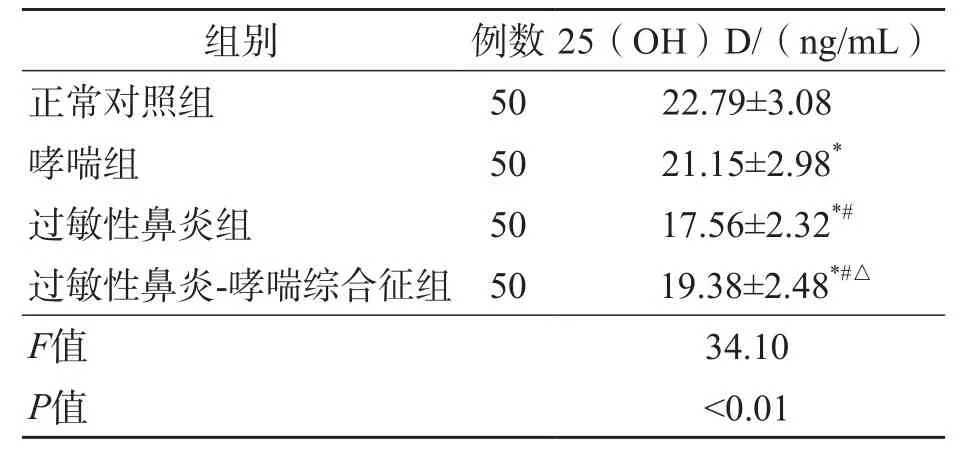
表1 各组血清25(OH)D水平比较
2.2 不同激素使用剂量组血清25(OH)D水平的比较
低剂量激素组、中剂量激素组、高剂量激素组之间血清25(OH)D水平差异均有统计学(P<0.01)。见表2。
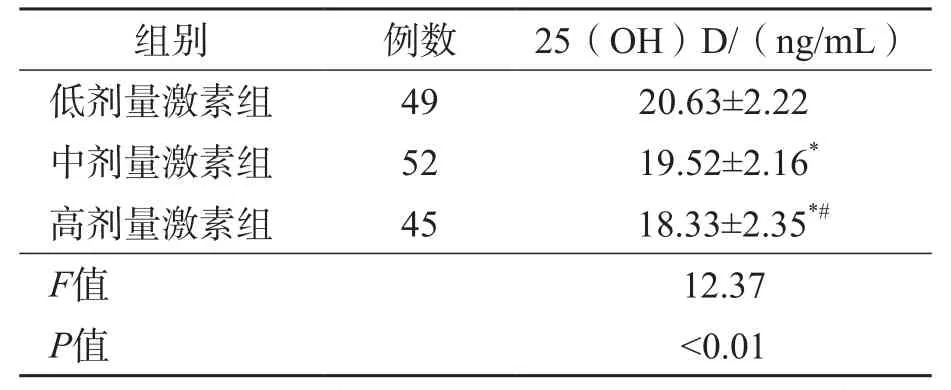
表2 不同激素使用剂量各组血清25(OH)D水平比较
2.3 血清25(OH)D水平对肺功能的影响
线性回归分析结果显示,过敏性鼻炎-哮喘综合征患儿25(OH)D对FEV1、FVC、FEF25%~75%、PEF均有明显影响(P<0.01)。线性回归方程分别为:FEV1=0.57×25(OH)D-9.12;FVC=0.53×25(OH)D-6.84;FEF25%~75%=0.55×25(OH)D-7.16;PEF=0.58×25(OH)D-3.80。血清25(OH)D水平每升高1 ng/mL,FEV1、FVC、FEF25%~75%、PEF水平分别增加0.57 L、0.53 L、0.55 L/s、0.58 L/s。
2.4 血清25(OH)D水平对病情控制相关评分的影响
线性回归分析结果显示,过敏性鼻炎-哮喘综合征患儿25(OH)D对ACT评分、mMRC评分、SFAR评分均有明显影响(P<0.01)。线性回归方程分别为:ACT评分=0.59×25(OH)D+6.78;mMRC评分=0.51×25(OH)D-6.11;SFAR评分=0.54×25(OH)D+2.41。血清25(OH)D水平每升高1 ng/mL,ACT评分升高0.59分、mMRC评分降低0.51 分、SFAR评分降低0.54 分。
3 讨论
过敏性鼻炎和支气管哮喘是儿童的常见病和多发病。过敏性鼻炎是一种鼻腔黏膜的变应性疾病,临床以发作性鼻痒、鼻塞、打喷嚏、流清涕为主要表现。支气管哮喘也是一种气道慢性炎症性疾病,其特征是症状多变,反复发作,可逆性气流阻塞和支气管痉挛。过敏性鼻炎-哮喘综合征是过敏性鼻炎与哮喘并存的病理状态。有研究结果显示,血清IgE、IgG4、辅助性T细胞(helper T cell,Th)1和Th2水平可作为评价过敏性鼻炎-哮喘综合征病情的指标[13-14]。还有研究结果显示,血清25(OH)D水平与患儿哮喘控制情况相关[3]。代谢组学研究结果显示,高白三烯B4水平与低25(OH)D水平相关,这可能是25(OH)D参与哮喘病情控制的机制之一[3,15]。提示血清25(OH)D水平或可作为过敏性鼻炎-哮喘综合征患儿病情控制的标志物。为此,本研究对哮喘患儿、过敏性鼻炎患儿、过敏性鼻炎-哮喘综合征患儿的血清25(OH)D水平进行了分析。
本研究结果显示,过敏性鼻炎-哮喘综合征组血清25(OH)D水平低于过敏性鼻炎组、哮喘组及正常对照组(P<0.01)。有研究结果显示,低氧环境下人体的糖异生增强,谷氨酸和天冬酰胺可以转化为α-酮戊二酸,从而降低生酮氨基酸的水平,进而导致脂质合成受阻[16]。作为固醇类激素的25(OH)D合成也可能受此通路调节,由此可推测过敏性鼻炎-哮喘综合征患者的低氧状态可能是其血清25(OH)D水平降低的原因。本研究结果还显示,低剂量激素组、中剂量激素组、高剂量激素组之间血清25(OH)D水平差异均有统计学意义(P<0.01)。25(OH)D与糖皮质激素之间存在信号转导通路相互作用,糖皮质激素直接下调并抑制25(OH)D受体表达及向细胞核移位[17]。SARINHO等[18]的研究结果显示,类固醇抵抗性哮喘患者服用25(OH)D可明显改善其对糖皮质激素的临床反应性。因此,激素的使用与血清25(OH)D水平下降有关,且呈剂量依赖性。
本研究结果显示,过敏性鼻炎-哮喘综合征患儿25(OH)D对FEV1、FVC、FEF25%~75%、PEF均有明显影响,血清25(OH)D水平每增加1 ng/mL,FEV1、FVC、FEF25%~75%、PEF水平分别增加0.57 L、0.53 L、0.55 L/s、0.58 L/s。这可能是由于肺功能下降影响了患儿室外活动的积极性,导致日照不足,使25(OH)D合成受阻[19]造成的。本研究结果还显示,过敏性鼻炎-哮喘综合征患儿25(OH)D对ACT、mMRC、SFAR评分均有明显影响,血清25(OH)D水平每增加1 ng/mL,ACT评分升高0.59分,mMRC评分、SFAR评分分别降低0.51 分、0.54 分。提示随着患儿病情的好转,血清25(OH)D水平逐渐升高。由此可见,血清25(OH)D水平与过敏性鼻炎-哮喘综合征患儿的病情控制情况也有一定的关系,但其机制尚未被完全阐明。WU等[20]的研究结果显示,25(OH)D可调节外周血嗜酸性粒细胞水平,抑制局部组胺释放,从而控制过敏性疾病的病情。25(OH)D还可通过下调血清IgE水平来抑制机体的超敏反应[21]。
综上所述,血清25(OH)D水平与肺功能及病情控制有关,随着患者肺功能的恢复,病情的好转,血清25(OH)D水平会上升。

