河流铊污染应急处置方法探究与应用
王盼新,吴昌永,胡映明,3,付丽亚,宋玉栋*,席宏波,于茵,赵檬
1.环境基准与风险评估国家重点实验室,中国环境科学研究院
2.中国环境科学研究院环境污染控制工程技术研究中心
3.西北大学城市与环境学院
铊是一种剧毒的重金属元素,可通过水循环、食物、呼吸等途径进入人体并富集,其对人体的毒性远高于镉、铅、铜、锌等,近似于汞[1],是美国国家环境保护局(US EPA)和欧盟水环境委员会优先控制污染物之一[2-3],也被我国列入《优先控制化学品名录(第二批)》[4]。据报道,成人口服铊盐的平均致死剂量为10~15 mg/kg[3]。铊广泛用于电子、军工、航天、化工、冶金、通信、卫生等领域[5],矿山开采、金属冶炼及含铊原料生产加工等过程极易引起水环境铊污染。我国对铊污染有着较为严格的防控,GB 3838—2002《地表水环境质量标准》中规定集中式生活饮用水地表水源地铊浓度限值为0.1 µg/L。
近年来,由于企业生产废水非法外排引发的铊污染事件屡屡发生,如2010 年广东北江铊污染事件,2013 年广西贺江重金属镉、铊超标事件,2018 年湘赣两省交界区域渌江河水质铊浓度超标事件等。在很长一段时期,由于很多涉铊工业的污染物排放标准中并没有关于铊浓度的排放限值,相关行业的污水处理设施并没有针对铊的处理设施,因此,出水即使达到当时的排放标准也可能含有高浓度的铊。重金属污染不仅对河流、湖泊的生态系统和渔业安全造成严重的负面影响,也会对人民群众的饮水安全造成影响。为此,生态环境部于2020 年发布的铅、锌、锡、锑、汞、硫酸、磷肥、钢铁等行业排放标准的修改单中也增加了总铊浓度排放限值要求[6],进一步提高了对铊污染的防控。因此,开发实用且高效的除铊方法,尤其是针对开放水环境中突发性铊污染的应急处置方法,是防范生态环境风险、保障饮水安全和人民身体健康的迫切需求。
铊有Tl(Ⅰ)和Tl(Ⅲ)2 种氧化态,在天然水环境中主要以溶解度更高、迁移能力更强、更难去除的Tl(Ⅰ)(Tl+或TlOH)形式存在[7]。由于Tl(Ⅰ)的氢氧化物(TlOH)水溶性较强,所以很难通过常规的石灰沉淀法去除,粉末活性炭吸附法等对铊的去除能力也有限[8],而US EPA 推荐的活性铝净化法和离子交换法成本过高,并不适用于自来水厂及河流铊污染的应急处理[9-10]。Huangfu 等[11]制备的纳米级二氧化锰(nMnO2)对Tl(Ⅰ)的最大吸附容量为672 mg/g,结合nMnO2良好的团聚和沉降性能[12],该方法有很好的实际应用前景。由于铊在还原环境中可以形成Tl2S 沉淀或者在氧化环境下可以生成Tl(Ⅲ)(氢)氧化物沉淀[13],因此在实际工程中可以直接通过投加Na2S 方式去除铊污染,或者通过KMnO4等氧化剂将Tl(Ⅰ)氧化成Tl(Ⅲ),然后经过吸附或沉淀将Tl2S 颗粒和Tl(Ⅲ)(氢)氧化物从水相分离去除[14]。这2 种方法具有成本较低、所需药剂易于获取、操作简单、实用性强等特点,成为铊污染应急处置中最常用的2 种方法。
本研究结合长江流域某河流断面铊浓度异常事件的应急处置,对比分析了直接混凝、氧化+混凝、氧化+吸附及硫化物沉淀法4 种方法对实际水体中铊污染的去除效果和可行性,并结合试验结果成功对该次事件进行了有效的应急处置,可为今后铊污染的防范和应急处置提供借鉴。
1 材料与方法
1.1 河流及铊污染事件概况
铊浓度异常事件发生河流位于长江流域,该河流下游为集中式生活饮用水地表水源地,因此对铊浓度有严格的控制要求。受污染河水铊浓度高达0.2~0.8 µg/L,超过GB 3838—2002 规定的集中式生活饮用水地表水源地铊浓度限值(0.1 µg/L)1~7 倍,直接影响下游居民饮水安全。
1.2 试验方法
1.2.1试验材料
应急现场和当地紧急调配的药剂:水处理用KMnO4,99.3%;工业级Na2S,≥60%;水处理用聚合硫酸铁(PFS),Fe 浓度≥21%;水处理用聚合氯化铝(PAC),Al2O3浓度≥30%;水处理用次氯酸钠,氯浓度≥10%(以有效氯计);NaOH,≥98%。试验用水为受铊污染的河水。小试试验中配置KMnO4母液(500 mg/L)、NaOH 母 液(40 g/L)、PAC 母 液(10 g/L)、聚合硫酸铁母液(10 g/L)、次氯酸钠溶液(250 mg/L),以方便药剂精准投加。
1.2.2除铊方法及药剂投加量计算
结合现场药剂现状,紧急制定了直接混凝、氧化+混凝、氧化+吸附及硫化物沉淀法4 种方案,对受污染河水进行除铊小试试验,药剂投加量按照式(1)~式(3)计算。

1.2.3除铊试验设计
1.2.3.1实验室小试
实验室小试主要是通过雷磁JB-10 型磁力搅拌器在烧杯中完成。
(1)直接混凝法
在2 组烧杯中分别加入255 mL 上游受污染河水(铊浓度为0.2 µg/L 左右,平均pH 为8.0),将其中1 组pH 调至9.0,分别取出5 mL 河水过0.22 µm滤膜后,置于10 mL 离心管中,待测。向2 组烧杯中分别加入50 mg/L 的混凝剂PFS、PAC,搅拌15 min,静沉30 min,取上清液5 mL 过膜待测。
(2)氧化+混凝法
分别进行直接氧化法、氧化+混凝法试验:1)直接氧化法。在2 组烧杯中分别加入255 mL 上游受污染河水,将其中1 组pH 调至9.5,分别取5 mL 河水过膜后待测。向2 组烧杯中分别加入2 mg/L KMnO4、1.414 mg/L 次氯酸钠作为氧化剂,氧化10 min,静沉30 min,取上清液5 mL 过膜后待测。2)氧化+混凝法。氧化部分的操作与直接氧化法相同,不同之处是氧化后加入50 mg/L 混凝剂PFS,反应10 min,静沉30 min,取上清液5 mL过膜后待测。
(3)氧化+吸附法
在2 组烧杯中分别加入255 mL 上游受污染河水,将其中1 组pH 调至9.5,分别取5 mL 河水过膜后待测;向2 组烧杯中分别加入2 mg/L KMnO4,预氧化不同时间(<10 s 和10 min)后,加入等当量的Na2S(浓度为1.48 mg/L),反应10 min,静沉30 min,取上清液5 mL 过膜后待测。
(4)硫化物沉淀法
在烧杯中加入255 mL 下游铊浓度为0.56 µg/L受污染河水,取出5 mL 河水过膜后,置于10 mL 离心管中待测;向烧杯中1 次或分4 次(间隔2 min)投加不同浓度的Na2S(10、20、30、40 mg/L),过程中通过投加NaOH 维持河水pH 为8~9,搅拌15 min,静沉30 min,取上清液5 mL 过膜后待测。
1.2.3.2现场应急处置试验
根据河道河面宽窄及周边环境情况,在河上加药位点和上下游断面进行采样监测,根据监测结果及时调整和优化各加药位点的投药量。根据上游及下游断面铊浓度的变化,确定NaOH 投加量为0.2~2.0 mg/L,Na2S 投加量为6~23 mg/L。
1.2.4指标检测
所有待测样品加入5 µL 浓硝酸酸化后,根据HJ 700—2014《水质 65 种元素的测定 电感耦合等离子体质谱法》用电感耦合等离子体质谱仪(ICP-MS)测定水样中铊浓度。采用雷磁DZB-712 型便携式多参数分析仪测定水样pH 和溶解氧浓度。
2 结果与讨论
2.1 直接混凝法除铊效果
混凝法对河水中铊的去除效果如图1 所示。由图1 可知,单独投加PFS、PAC 混凝剂对河水中铊的去除能力较弱,调高pH 并没有促进混凝剂对铊的去除。这主要是因为铊在较宽的pH 范围内一般均以溶解性极高的Tl(Ⅰ)形式存在[15],很难通过直接混凝去除,因此直接混凝法并不适用于该事件河水中铊污染的去除。

图1 混凝法对河水中铊的去除效果Fig.1 Removal effects of thallium from river water by coagulation
2.2 氧化+混凝法除铊效果
相比于直接混凝法,氧化+混凝法(氧化后混凝)在去除水中铊污染方面较为常用,因为Tl(Ⅲ) 溶解度较低,易形成固体颗粒从水相分离,常用的氧化剂有KMnO4、NaClO、H2O2、过硫酸盐等[16-17]。KMnO4和NaClO 氧化及混凝后对铊的去除效果如图2所示。

图2 KMnO4 和NaClO 氧化及氧化+混凝对铊的去除效果Fig.2 Removal effects of thallium from river water by KMnO4 and NaClO oxidation and coagulation after oxidation
由图2 可知,KMnO4氧化能够去除河水中部分铊污染,调高pH 有助于KMnO4对铊的去除。这主要是因为KMnO4对Tl(Ⅰ)的氧化在碱性条件下(pH 为8~10)呈二级动力学,且随着pH 升高,KMnO4对Tl(Ⅰ)的氧化能力增强[16],对Tl(Ⅰ)的去除率提高。但氧化后投加混凝剂对铊的去除效果无明显提升,这可能是因为部分Tl(Ⅰ)没有被氧化,且部分溶解的Tl(Ⅲ)氧化产物在pH 为5~11 时主要以不带电荷的Tl(OH)3形式存在[18],很难通过静电引力被絮体颗粒吸附共沉降。胡小芳等[9]在KMnO4氧化含铊废水后投加PAC,发现PAC 投加量对铊的去除效果无明显影响,这与本研究结果一致。NaClO 对Tl(Ⅰ)的氧化能力与HOCl 浓度有关,随着pH 升高,HOCl 占比逐渐降低,氧化能力逐渐减弱。而水体背景pH 为8 左右,NaClO 能够发挥氧化作用的部分很少,因此在pH 为8.0~9.5 时,只有少量的Tl(Ⅰ)被去除。将河水铊浓度降到0.1 µg/L 以下需要大大提高NaClO 的投加量,非常不经济,也不环保;KMnO4虽然对铊有一定的去除能力,但KMnO4会使河水变成紫红色,不能单独使用。因此,通过KMnO4和NaClO 氧化然后投加混凝剂的方法并不适用于直接去除河水中的铊。
2.3 氧化+吸附法除铊效果
常用废水处理药剂Na2S 可作为KMnO4的还原剂,将剩余的KMnO4还原成MnO2。氧化+吸附法可通过KMnO4对铊的氧化、MnO2对铊的吸附[9,19],共同实现对铊的去除,其对河水中铊的去除效果如图3 所示。由图3 可知,KMnO4预氧化不同时间后,加入Na2S 将反应溶液调节到无色,静沉后水中铊的剩余浓度可以达到0.1 µg/L 的标准限值以下。预氧化10 min 对铊的去除效果略有提高,考虑到该事件中河水流速(0.4~0.7 m/s),预氧化时间越长,则河水颜色呈紫红色段越长,在能够达标的前提下,应尽可能缩短河水颜色变化段。因此在实际操作中可在拦截坝加药口上游1~2 m 处投加KMnO4,在间隔2~4 m 的加药口下游处投加Na2S。由于提高河水pH 有助于提高铊的去除率,为了尽可能减小对河水生态环境的破坏,实际应急过程中,NaOH的投加量以维持河水pH 处于8~9 为宜。该方法所需的药剂投加量少,产生的MnO2具有良好的吸附性能和助凝作用[20-21],且处理后河水清澈。此外,Na2S 投加量不需要严格控制,稍过量的Na2S 可以与铊形成固体Tl2S,促进铊的去除。因此,氧化+吸附法是一种很有前景的除铊方法。但由于KMnO4溶于水后会明显改变河水的颜色,在河水中直接使用KMnO4的报道并不是很多,KMnO4氧化+吸附法被更多地应用在自来水厂铊污染应急中[9,22],因此氧化+吸附法只作为此次事件河水铊污染应急处置的备选方案。
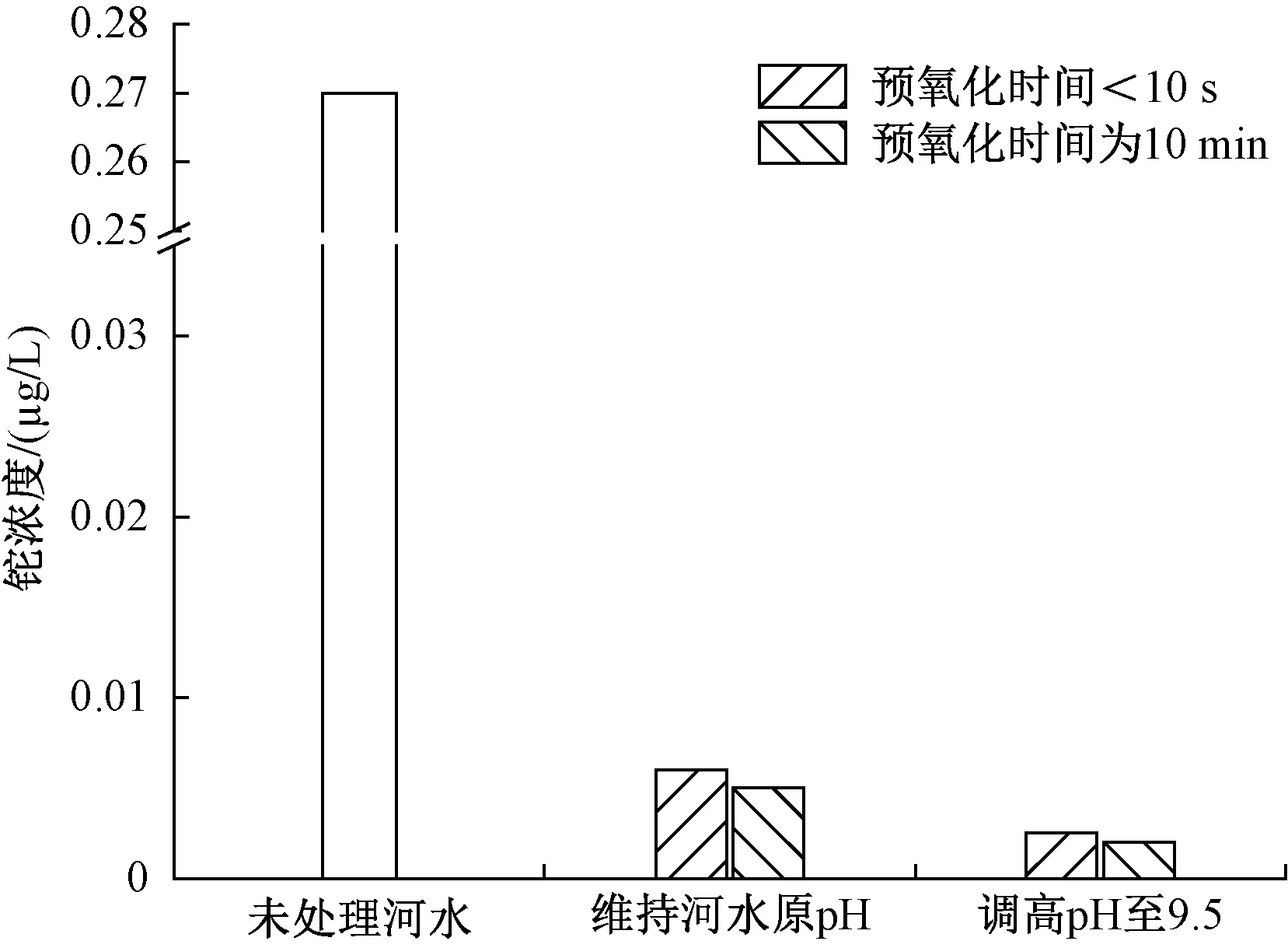
图3 氧化+吸附法对河水中铊的去除效果Fig.3 Removal effects of thallium from river water by oxidation+adsorption
2.4 硫化物沉淀法除铊效果
由于S2-能与Tl(Ⅰ)或者Tl(Ⅲ)形成溶解度(Ksp)非常低的Tl2S 固体〔Ksp(Tl2S)=9.0×10-23mol/L[23],298 K〕,而且此方法操作方便,在较宽的溶液pH、温度、初始铊浓度范围内及硫化物投加量下,都能较好地实现对铊的去除[15]。不同Na2S 投加量及不同投加模式对河水中铊的去除效果如图4 所示。由图4可知,10 mg/L的Na2S 可以将河水中的铊浓度降至0.1 µg/L 的标准限值以下;继续提高Na2S 的投加量,对铊的去除效果略有提高,但不太明显。相同Na2S 投加量下,分批次投加的除铊效果稍优于单次投加,这可能是因为分批次投加时,以H2S 形式挥发的部分较少,发挥除铊作用的部分更多。该方法在去除铊污染的同时,对可能存在的其他重金属如镉、铅、铜、锌等也有较好的去除效果[23]。

图4 不同Na2S 投加量及不同投加模式下河水中铊的去除效果Fig.4 Removal effects of thallium from river water by different dosages of Na2S with different dosing modes
该除铊方法可能的负面影响包括河水中硫化物和化学需氧量升高、河水缺氧、生成硫化铊沉淀、Na2S 过量投加导致H2S 气体生成、河水溶解H2S 后毒性增加、河水pH 升高等。尽管Na2S 的投加会提高水中硫化物的浓度,甚至超过GB 3838—2002 中V 类水质标准限值(1.0 mg/L),但由于H2S 常温下的电离常数pKa1和pKa2分别为7.0 和13.5,在pH 为8~9 的水中,硫化物主要以HS-的形态存在,且HS-对水生动物的毒性作用远低于分子态H2S[24],因此通过控制Na2S 投加量和河水pH,不会对鱼类等水生动物产生明显的毒害作用。投加NaOH 会造成河水pH 升高,但可通过与其他河流融汇稀释及空气中CO2的溶入得到缓解。Na2S 的投加会导致河水中硫化物和化学需氧量升高,在投药局部会造成溶解氧浓度下降,但在流速较快的清洁河水中,被少量硫化物缓慢氧化消耗的氧可通过大气复氧及时得到补充,不会导致河水中因溶解氧浓度过低而造成水生动物死亡的现象。另外,集中投药过程中会产生H2S 气体,可通过佩戴防护口罩等措施降低危害。Tl2S 沉淀在天然水体中性质稳定[25],在受污染河水铊浓度较低的情况下,如无特殊要求,可不做处理。因此,硫化物沉淀法是此次事件河水铊污染应急处置的首选方案。
2.5 现场应急处置试验效果
此次事件中硫化物沉淀法应急除铊实施效果明显,投加NaOH 和Na2S 后一段时间内,河水中铊浓度从投药前的0.7 µg/L 左右降低到了下游监测断面的0.2 µg/L 左右,去除率约为71.4%。进一步优化投加量后,下游监测断面铊浓度稳定在0.1 µg/L 以下,满足GB 3838—2002 中集中式生活饮用水地表水源地铊浓度的标准限值。技术应用期间,加药位点下游溶解氧浓度保持在7 mg/L 以上,空气中H2S 气味较轻,未发现大量鱼类死亡现象。
3 结论
(1)综合考虑除铊效果和水生态安全,在直接混凝、氧化+混凝、氧化+吸附及硫化物沉淀法4 种方案中,硫化物沉淀法表现出铊去除率高、操作简单、负面影响可控等优势,更适合河水中铊污染的应急去除。
(2)此次现场应急处置过程中采取了硫化物沉淀法进行河流应急除铊,投加的药剂包括NaOH 和Na2S,该工艺见效快,除铊效果显著。药剂投加过程中,河水pH 保持在8~9,有效减少H2S 气体的产生;河水中铊被转化成硫化铊,沉降至底质中,硫化铊性质稳定,无特殊要求底质可不做处理。该方法在去除铊污染的同时,对河水中可能存在的其他重金属如镉、铅、汞等也有较高的去除率。
(3)通过控制药剂投加量和做好防护,可有效降低硫化物沉淀法带来的负面影响。因此,该方法可作为今后河流铊污染应急处置的首选方案。

