液液萃取-高效液相色谱法同时测定植物油中的毒黄素、路霉素和热诚菌素
王朝霞, 尹芳平, 汪 辉, 周 鹏, 邓 楠, 曾 辉, 胡宇格
(食品安全监测与预警湖南省重点实验室1, 长沙 410111) (长沙市食品药品检验所;国家酒类产品质量监督检验中心2,长沙 410000)
细菌毒素是由细菌合成产生的,按其毒素的分子性质和结构特征可分为内毒素和外毒素。研究表明内毒素是在革兰氏阴性菌死亡之后才会产生,且能够在植物中产生具有毒害性的代谢产物,影响植物的正常生长从而降低植物如水稻这一类农作物的产量[1-3]。由于革兰氏阴性菌死亡之后产生的具有毒害性的代谢产物极易被人体吸收和利用,若人们摄取吸收富集这类物质达到一定程度就会有不同程度的中毒迹象,轻者会出现呕吐、全身无力、头晕等现象;重者会出现内脏肿大、休克等多种严重疾病[4-6]。吴小林等[7]研究了细菌毒素对癌症的潜在作用,明确指出革兰氏阴性菌具有致癌性。赵乃欣等[4]研究也表明,近年来中国不少地区经常出现由玉米粉、米粉等变质产生革兰氏阴性菌死亡后产生内毒素进而引起的食物中毒事件,其中报道较多的是由革兰氏阴性菌死亡产生的毒黄素。毒黄素溶于水,同时也溶于甲醇、乙醇、氯仿、乙酸乙酯等有机溶剂,静脉注射毒黄素的LD50为1.7 mg/kg,口服的为8.39 mg/kg[8]。龙海等[9]研究发现水稻细菌性谷枯病病菌会产生3种毒素:毒黄素、热诚菌素和路霉素,其中毒黄素对水稻有极大的毒害作用。热诚菌素、路霉素与毒黄素分子结构相似,可能存在与之相当的生物活性和毒性。革兰氏阴性菌产生的某些细菌物质不仅会影响农作物的产量,还对人类身体健康产生不同程度的危害。Zhu 等[10]报道在酿酒大曲中检出的毒黄素含量高达8.33 mg/kg。因此,植物油相关的原材料如果受到细菌污染,可能会产生毒素,影响植物油的安全。目前,国内外主要以植物油[11]为食用油,关于植物油中真菌毒素的测定报道较多[12,13],而食用植物油中细菌毒素的检测方法研究却是处于空白阶段,消费者在食用植物油环节存在一定的安全隐患,因此该项研究十分必要。我国食用植物油种类丰富、工艺复杂。常见的食用植物油[14]有菜籽油、玉米油、稻米油、花生油以及大豆油等。根据我国目前因细菌毒素中毒案例[5,6]来分析,本研究选择了市面上主要流通的几类食用植物油进行分析检测,因水稻中产生的细菌毒素诱发的疾病数量最多[15,16],着重以稻米油为研究对象进行展开。
有关毒黄素的分析方法有薄层色谱法[17-19]、高效液相色谱法[8, 10, 20]、高效液相-质谱联用法[21,22]、分光光度法[23,24]、生物传感法[25],而对路霉素和热诚菌素的分析方法报道较少,且鲜有关于植物油中毒黄素、热诚菌素和路霉素的报道。本研究考察了5种不同前处理条件来提取净化目标物,采用甲醇液液萃取,高效液相色谱分析检测,建立了一种快速测定食用植物油中毒黄素、路霉素和热诚菌素的分析方法。以期填补食用植物油中毒黄素、路霉素和热诚菌素检测方法研究的空缺,为今后对细菌毒素的研究提供技术参考。
1 材料与方法
1.1 材料与试剂
毒黄素(Toxoflavin)标准品(纯度>95%):CAS号:84-82-2;热诚菌素(Fervenulin)标准品(纯度>99.2%):CAS号:483-57-8;路霉素(reumycin)标准品(纯度>99.9%),CAS号:5016-18-2;甲醇、乙腈、乙酸乙酯、环己烷和甲酸均为色谱纯;正己烷、三氧化二铝和无水硫酸钠为分析纯;Al2O3固相萃取柱(22 g/60 mL);植物油均为市售样品。
1.2 仪器与设备
Agilent1260高效液相色谱仪,SK-I振荡器;CT14D-高速离心机,Visiprep-DL24固相萃取真空装置,AS3120超声波清洗器,超纯水仪,N-EVAP116型氮吹仪-34位。
1.3 方法
1.3.1 色谱条件
色谱柱:Ultimate AQ-C18色谱柱(4.6 mm×25 mm,5 μm);流动相:0.1%甲酸-甲醇(90∶10),等度洗脱;柱温:35 ℃;流速:1.0 mL/min;进样量:5 μL;检测波长:240 nm。
1.3.2 标准溶液配制
称取适量的毒黄素、路霉素和热诚菌素标准品于烧杯中,加入甲醇溶解并转移至50 mL容量瓶,再用甲醇定容至刻度,配成质量浓度为0.5 mg/mL的混合标准储备液,-18 ℃避光保存,用流动相逐级稀释,配制成0、4、8、10、20、40 μg/mL的标准系列工作溶液,供高效液相色谱仪分析测定。
1.3.3 样品处理1.3.3.1 液液萃取法1.3.3.1.1 液液萃取-乙腈饱和正己烷[26]
称取混匀的稻米油样品0.8 g置于50 mL聚丙烯离心管中,加入0.2 mL由标准母液配制的质量浓度为100 μg/mL的溶液,加入10 mL乙腈的饱和正己烷,混匀超声15 min,取出下层溶液,加入5 mL乙腈饱和正己烷复提,合并提取液,混匀于45 ℃氮吹浓缩至近干,用流动相定容至2.0 mL,涡旋混匀,溶液经0.45 μm有机膜过滤,并做空白实验,供液相色谱测定。
1.3.3.1.2 液液萃取-甲醇[27]
称取混匀后的稻米油样品4.0 g于50 mL聚丙烯离心管中,样品加入0.2 mL标准母液,加入10 mL甲醇,室温振荡提取15 min,于10 000r/min离心5 min,取出溶剂,再加入6 mL甲醇重复提取,合并提取液并定容至20 mL。准确移取5.0 mL样液于45 ℃氮吹浓缩至近干,流动相定容至1.0 mL,涡旋混匀,溶液经0.45 μm有机膜过滤,并做空白实验,供液相色谱测定。
1.3.3.2 固相萃取法
1.3.3.2.1 Al2O3固相萃取柱(30 mL正己烷活化)[28]
称取混匀的稻米油样品0.4 g置于50 mL聚丙烯离心管,加入0.1 mL由标准母液配制的质量浓度为100 μg/mL的溶液,加入5 mL正己烷,涡旋混匀,待净化。采用中性氧化铝固相萃取柱,用30 mL正己烷活化柱子,将待净化样液全部加入固相柱,再加入50 mL正己烷进行洗脱,收集洗脱液于45 ℃氮吹浓缩至近干,用流动相定容至1.0 mL,涡旋混匀,溶液经0.45 μm有机膜过滤,并做空白实验,供液相色谱测定。
1.3.3.2.2 自填中性氧化铝固相萃取柱(30 mL石油醚活化)[29]
三氧化二铝的活化:称取120 g三氧化二铝置于坩埚并放入马弗炉中,用450 ℃进行灼烧,设置程序使其灼烧12 h,降至室温后取出坩埚,将三氧化二铝迅速转入黑色的试剂瓶并加入10 mL水,剧烈振荡15 min,将其避光静置24 h。
样品的处理:称取0.4 g稻米油样品,加入0.1 mL由标准母液配制的质量浓度为100 μg/mL的溶液,加入2 mL石油醚,涡旋混匀,待净化。
三氧化二铝的填柱:将玻璃层析柱用超纯水洗涤3次后,再用无水乙醇洗涤3次,自然晾干。加入40 mL石油醚,打开活塞,放出石油醚至管身的1/2处,旋紧活塞,加入22 g活化的三氧化二铝和2 g无水硫酸钠,再次打开活塞,将石油醚放至无水硫酸钠处旋紧活塞。上样:将待净化液全部转入玻璃层析柱中,分离,纯化。收集:加入80 mL石油醚进行洗脱,弃去前20 mL石油醚,收集剩余的石油醚于45 ℃氮吹浓缩至近干,用流动相定容至1.0 mL,涡旋混匀,溶液经0.45 μm有机膜过滤,并做空白实验,供液相色谱测定。
1.3.3.3 GPC体积排阻法[27, 30]
称取混匀后的稻米油4.0 g置于50 mL聚丙烯离心管中,加入0.2 mL标准母液,加入20 mL乙酸乙酯+环己烷(1+1),混匀振荡提取15 min,取出5 mL样液,供GPC色谱分离,收集样液于45 ℃氮吹浓缩至近干,用流动相定容至1.0 mL,涡旋混匀,溶液经0.45μm有机滤膜过滤,并做空白实验,供液相色谱测定。前处理过程比对如表1所示。
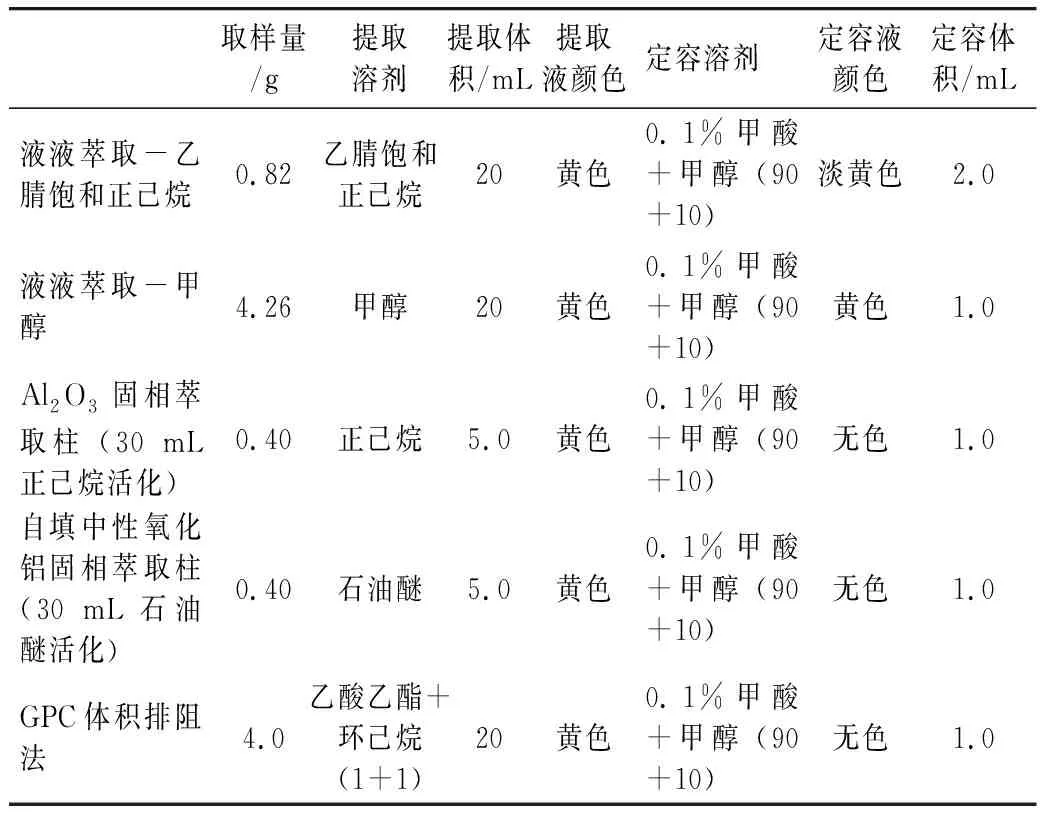
表1 同一样品的不同前处理过程
2 结果与讨论
2.1 色谱条件的优化
毒黄素在258 nm处有最大吸收峰,路霉素在232 nm处有最大吸收峰,热诚菌素在238 nm处有最大吸收峰,通过对这3种目标物质进行全波长扫描来选择最佳吸收波长,如图1所示,当波长为240 nm时,毒黄素、路霉素和热诚菌素有相对较高的吸光度,因此检测波长选为240 nm;使用甲醇甲酸为流动相时,可以使路霉素和毒黄素这两个同时出峰的物质达到相应分离度要求,因此本研究选用0.1%甲酸-甲醇(90∶10)为流动相。
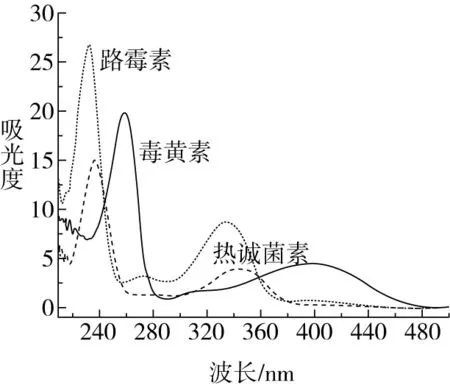
图1 毒黄素、路霉素和热诚菌素全波长扫描图
2.2 前处理条件的选择
根据食用植物油的大分子特征和目标化合物的性质,采用了5种不同的的前处理提取方法。液液萃取法是利用不同目标物质在试剂中分配系数的差异来实现分离目的。采用有机试剂直接提取目标物质[31],可以节省成本,同时降低其他杂质干扰的风险。考虑到食用植物油不溶于甲醇和乙腈,本研究结合油脂中化合物测定的相关国家检测方法标准,考察了几种主要前处理方式。采用了甲醇[27]和正己烷饱和的乙腈[26]进行实验,在实验过程中提取溶液出现明显颜色差异现象,经甲醇提取的溶液颜色是深黄色,而正己烷饱和的乙腈是淡黄色,实验结果显示2种试剂的基质干扰都很低,目标物质都能有效分离,区别在于甲醇溶液比正己烷饱和的乙腈溶液的回收率更高、更稳定;本研究中固相萃取法是利用物质在固定相和流动相的分配系数的不同来达到分离[31],采用极易溶解油脂的正己烷[28]和石油醚[29]溶液来进行实验,比较商用固相萃取和自填柱对物质分离效果的影响,除去植物油中其他杂质的干扰,获得更稳定的基线。实验过程中发现,两者填料柱里有明显的黄色物质。结果表明,洗脱液中未检出3种目标化合物,这可能是目标物不溶于正己烷和石油醚,无法从填料柱中洗脱下来;采用GPC体积排阻法[30]是根据溶液中各物质的分子质量不同,经过色谱柱后的停留时间各不一致来实现分离,可知毒黄素、路霉素和热诚菌素均是小分子化合物,而样品稻米油是大分子物质,利用这一特性结合GPC的技术原理[31],将杂质和目标化合物在柱前进行分离,得到较为纯净的样液,再进入液相色谱系统进行分析检测,可以减少样品杂质对目标化合物出峰时间和分离情况的干扰,同时,减少样品杂质对色谱柱和检测仪器的污染。实验结果表明该法的基质干扰较低,目标物质可以有效分离,但是回收率效果不理想,可能是由于目标物不易溶于流动相造成的。结果如表2和图2所示。最终选择用液液萃取法中甲醇溶液直接提取,实验的加标回收和稳定性均达到要求,相对其他前处理方法更为方便,能够节约前处理的时间和成本。

表2 不同前处理方法的回收率

注:1为空白样品,2为Al2O3固相萃取柱(30 mL正己烷活化),3为自填中性氧化铝固相萃取柱(30 mL石油醚活化),4为GPC体积排阻法,5为液液萃取-乙腈饱和正己烷,6为液液萃取-甲醇。图2 不同前处理方法的峰面积
2.3 方法学评价
2.3.1 方法的线性范围、检出限和定量限
分别以毒黄素、路霉素和热诚菌素标准溶液浓度为横坐标,峰面积为纵坐标绘制标准曲线。结果显示3种目标化合物在0~40.0 μg/mL质量浓度范围内具有良好的线性。以信噪比(S/N)为3计算方法检出限(LOD),以信噪比(S/N)为10计算方法定量限(LOQ),本方法中毒黄素、路霉素和热诚菌素的LOD与LOQ分别为0.8 mg/kg与3.2 mg/kg,检测灵敏度较高,结果见表3。

表3 毒黄素、路霉素和热诚菌素的线性方程和相关系数
2.3.2 回收率实验和精密度
称5.0 g空白稻米油样品于50 mL聚丙烯离心管中,分别添加3.2、6.4、32.0 mg/kg的毒黄素、路霉素和热诚菌素的混合标准品,充分混匀后,按照样品前处理方法进行提取,进高效液相色谱分析,将加标后样品中毒黄素、路霉素和热诚菌素的含量与加标量相比计算回收率,毒黄素为98.93%~109.44%,路霉素为102.85%~109.77%,热诚菌素为95.26%~101.54%,数据表明样品回收率良好,毒黄素方法精密度(RSD)小于6.81%,路霉素方法精密度(RSD)小于4.26%,热诚菌素方法精密度小于4.30%,结果显示该方法精密度良好,符合相关标准要求,表明本研究方法能准确检测食用植物油中的毒黄素、路霉素和热诚菌素,结果见表4。

表4 毒黄素、路霉素和热诚菌素方法回收率和精密度(n=6)
2.3.3 日内精密度和日间精密度
取40 μg/mL的毒黄素、路霉素和热诚菌素的混合标准溶液,重复进样6次,考察本方法的日内精密度;将该溶液连续3 d在相同的仪器条件下进行测定,以考察本方法的日间精密度。毒黄素的保留时间与峰面积的日内相对标准偏差(RSD,n=6)分别为0.068%与0.81%,其日间相对标准偏差(RSD,n=3)分别为0.19%与1.21%,路霉素的保留时间与峰面积的日内相对标准偏差(RSD,n=6)分别为0.13%与0.46%,,其日间相对标准偏差(RSD,n=3)分别为0.18%与1.76%,热诚菌素的保留时间与峰面积的日内相对标准偏差(RSD,n=6)分别为0.19%与0.42%,其日间相对标准偏差(RSD,n=3)分别为0.33%与2.00%,表明该方法具有较好的日内精密度与日间精密度,结果见表5和表6。

表5 毒黄素、路霉素和热诚菌素的日内精密度(n=6)
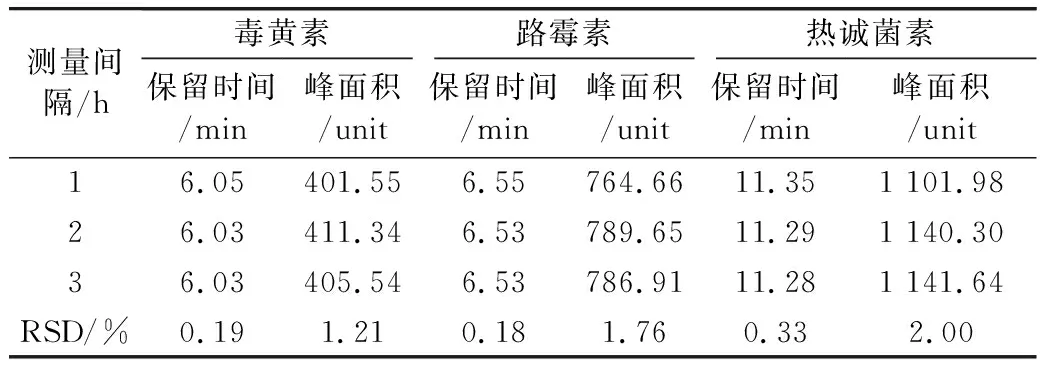
表6 毒黄素、路霉素和热诚菌素的日间精密度(n=3)
2.4 实际样品的测定
选取市场上主要流通的食用植物油有菜籽油、稻米油、玉米油、芝麻油、花生油和大豆油等11个样本,采用高效液相色谱分析测定植物油中的毒黄素、路霉素和热诚菌素含量,结果显示11种植物油均未检出毒黄素(<0.8 mg/kg),路霉素(<0.8 mg/kg)和热诚菌素(<0.8 mg/kg)。任意选取一稻米油称取10个平行随机添加3个试管中模拟盲样测试,添加水平分别为4、8、32 mg/kg,结果显示路霉素分别为4.02、7.74、31.18 mg/kg;毒黄素分别为4.13、7.84、30.22 mg/kg;热诚菌素分别为3.92、7.77、30.55 mg/kg,其他样品均未检出,说明该方法可以准确地定性和定量植物油中的毒黄素、路霉素和热诚菌素。
3 结论
通过对前处理条件和色谱条件的优化,建立一种食用植物油中毒黄素、路霉素和热诚菌素含量的高效液相色谱检测方法。该法在0~40 μg/mL范围内线性良好,毒黄素:y=19.184x-6.00×10-9(r2=0.999 6);路霉素:y=11.273x+3.12 (r2=0.999 4);热诚菌素:y=29.129x-2.00×10-8(r2=0.999 5)。灵敏度高,当取样量为5 g时,样品中的毒黄素、路霉素和热诚菌素经甲醇提取,以0.1甲酸∶甲醇(90∶10)为流动相,在240 nm波长下检测。方法的检出限均为0.8 mg/kg,定量限均为3.2 mg/kg;在食用植物油中进行范围为3.2~32 mg/kg加标回收实验,毒黄素的回收率(n=6)为102.85%~109.77%,方法精密度(RSD,n=6)小于6.81%;路霉素的回收率(n=6)为98.93%~109.44%, 方法精密度(RSD,n=6)小于4.26%;热诚菌素的回收率(n=6)为95.26%~101.54%, 方法的精密度(RSD,n=6)小于4.30%。本方法操作方便,准确度高,可用于植物油中毒黄素、路霉素和热诚菌素的含量测定,也为其他食品中可能产生的毒黄素、路霉素和热诚菌素含量测定提供检测依据。

