秦皇岛绿潮暴发区微观繁殖体的时空分布特征及影响因素
马晓君,李 艳,3,韩红宾,宋 伟,3,王宗灵,3*
(1.自然资源部 第一海洋研究所,山东 青岛 266061;2.自然资源部 海洋生态环境科学与技术重点实验室,山东 青岛 266061;3.青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237)
绿潮是由机会型大型绿藻过度增殖和生长而导致的一种生态灾害[1-2],常发生在水体富营养化的海域[3-4]。20世纪60年代以来,绿潮在世界许多沿海地区频繁暴发[5-8]。2007年开始在中国黄海海域暴发的浒苔绿潮被认为是世界上最大规模的绿潮[9-10]。该绿潮暴发时,大量绿藻堆积在岸滩上及水体中,腐烂时消耗氧气并产生硫化物[11],使得浮游生物和鱼类难以生存,并严重破坏当地的生态环境[12],造成极大的经济损失[10,13]。2015年,秦皇岛近岸海域出现了一种异于黄海绿潮的本地起源型绿潮。此后,每年4月至9月,绿潮在秦皇岛鸽子窝至汤河口近岸海域暴发,其中金梦海湾受灾最为严重。绿潮暴发期间,大型绿藻大量悬浮在距岸0~10 m的潮间带以及潮下带的浅水区域中,种类主要包括孔石莼(Ulva pertusa)、羽藻(Bryopsis plumosa)和浒苔(Ulva prolifera)[14]。Song等[15]于2019年对比悬浮海藻和该海域定生海藻的种类,基本确定秦皇岛绿潮的藻源为海藻床中定生绿藻。但是,对于秦皇岛绿潮的种源基础和关键的发生过程,目前尚不清楚。
微观繁殖体常作为种源基础在绿潮连续暴发过程中发挥重要作用。绿藻微观繁殖体具有适应低温、低光照等生物学特性[16-17],当遭遇不利环境时,大型绿藻会释放出大量孢子和配子,与处于显微阶段的个体以及具有生长能力的藻体碎段共同形成微观繁殖体库,从而度过寒冬[18-19]。针对黄海海域的微观繁殖体,大量研究[3-4,17,20-24]表明,微观繁殖体在黄海海域的水体和沉积物中广泛分布,具有明显的时空分布特征[4,17,21-22]。在环境条件适宜时,绿藻微观繁殖体在苏北浅滩紫菜养殖筏架上附着生长为幼苗[22],成为定生绿藻的种源基础,从而影响黄海绿潮的形成及发生规模。
与黄海相比,有关秦皇岛海域绿藻微观繁殖体的研究较少。Han等[25]于2019年研究表明:水体中的绿藻微观繁殖体主要分布在近岸,外海丰度显著降低;每年7月和8月微观繁殖体丰度最高,冬季最低。除了水体中,绿潮发生海域的沉积物中被证实常分布有高丰度的绿潮微观繁殖体[17],但目前秦皇岛海域沉积物中的绿藻微观繁殖体尚未被报道。
为探索绿藻微观繁殖体在秦皇岛海域绿潮暴发中的作用,查明秦皇岛绿潮的发生原因,本文对秦皇岛绿潮暴发区水体和沉积物中的微观繁殖体时空特征及影响因素开展研究,以期为进一步阐明秦皇岛绿潮发生的关键过程及防灾减灾提供支撑。
1 材料与方法
1.1 样品的采集
在秦皇岛受绿潮影响最为严重的金梦海湾布设6个站位(站位号为1、2、3、4、5、6,图1)。站位1~3位于莲花岛与岸滩之间的近岸海域,该区域在绿潮暴发期间有悬浮浒苔分布;站位4和5位于莲花岛附近海域,此处有大型绿藻定生;站位6离岸较远,在现场调查时几乎没有大型绿藻分布。
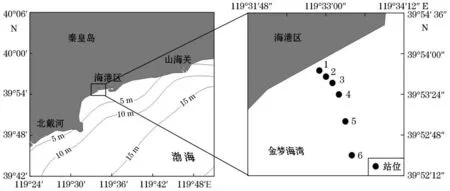
图1 采样区域和站位Fig.1 Sampling area and stations
于2020年5月至9月按照GB/T 12763.6—2007《海洋调查规范:第6部分 海洋生物调查》[26]中小型底栖生物调查所规定的采样方法进行逐月取样。由潜水员手执直径为30 cm的圆柱形取样器在每个取样站位取10 cm长的沉积物样,立刻置于4℃的冰箱中冷藏保存,然后将其运输至实验室。用分样铲将样品按照沉积物深度划分为[0,2)cm、[2,5)cm、[5,10)cm后进行后续处理。
1.2 环境参数测定
使用便携式环境参数仪(美国YSI公司,556MPS型号)现场测定调查海域的温度和盐度。溶解氧(dissolved oxygen,DO)的质量浓度按照Winkler法进行现场测定[27],根据氧溶解度方程式计算饱和溶解氧质量浓度并进一步得到溶解氧饱和度[28]。
将采集的水样经孔径为0.45μm混合纤维素酯滤膜(英国Whatman公司,直径47 mm)过滤后低温保存,然后带至自然资源部第一海洋研究所海洋生态环境科学与技术重点实验室等待测定。利用GB/T 17378.1—2007《海洋监测规范:第4部分 海水分析》[29]中锌-镉还原法和磷钼蓝法分别测定硝酸盐和磷酸盐的浓度。
1.3 沉积物与水体中绿藻微观繁殖体的培养与定量
将采集的沉积物样品中的除泥沙以外的附着基以及可见藻段挑除。首先,在[0,2)cm、[2,5)cm、[5,10)cm层分别取湿重为2 g的沉积物(设置3个平行,即每层取3次等质量的沉积物样品)加入到灭菌烧杯中。然后,向烧杯中加入1 L灭菌海水和20 m L PES培养液[30],再加入1 m L二氧化锗溶液(GeO2,终质量浓度为0.5 mg/L)以抑制硅藻生长。最后,将烧杯置于温度为20℃、光辐射为80~100μmol/(m2·s)、光周期为12 L:12 D的智能人工气候室(宁波江南仪器厂,202728-380型号)中培养。培养过程中,每5 d添加一次PES营养液。
采集的水样经孔径200μm的筛绢过滤后,加入到1 L的灭菌烧杯中(设3个平行)。培养条件与沉积物培养条件一致。
待沉积物样品和海水样品中培养出的绿藻幼苗生长至1~3 cm(培养时间约20 d)时,用消毒镊子取出幼苗,在放大镜下观察幼苗形态并计数。之后,随机挑选25株绿藻幼苗,对其用去离子水冲洗2~3次,置于1.5 m L灭菌离心管中冷冻保存,以备种类鉴定。
1.4 微观繁殖体的DNA提取和种类鉴定
将冻存的离心管取出,置于室温中。向离心管中加入500μL CSPL缓冲液,然后将离心管中的幼苗用高通量组织研磨器磨碎,以备提取DNA。
使用Omega植物基因提取试剂盒提取绿藻幼苗的全基因组DNA。选用ITS序列区分浒苔/缘管浒苔与其他绿藻常见种(如曲浒苔Ulva flexuosa等);以5S核糖体基因间隔区序列来区分浒苔和缘管浒苔。ITS和5S引物序列及PCR条件设置分别参考Leskinen和Pamilo[31]以及Hayden等[32]和Shimada[33]等。将所得产物送往上海生工生物工程股份有限公司进行双向测序,对测得序列进行比对,再与GenBank中的相似序列一起进行Clustal W多重比对分析[34],进而构建ML进化树[35]。
1.5 数据处理
利用SPSS 26.0软件分析微观繁殖体的数量差异,采用线性插值法补充缺失数据,利用双因素方差分析(two-way AVONA)方法分析不同季节和站位的绿藻微观繁殖体丰度的差异,P<0.05时,表示差异显著。同时,利用T-检验(T-test)比较2个月、2个站位以及沉积物的2个分层的绿藻微观繁殖体丰度差异性,P<0.05时,表明差异显著。
为了探究不同因素对绿藻微观繁殖体丰度的影响,利用Canoco 5软件对绿藻微观繁殖体丰度和大型海藻生物量及环境因子之间的相关关系进行冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 环境因子变化
2020年5月至9月,金梦海湾海域的温度、盐度、磷酸盐浓度、可溶性无机氮(dissolved inorganic nitrogen,DIN)浓度、溶解氧(DO)质量浓度、溶解氧饱和度变化趋势如图2所示。温度和磷酸盐浓度呈现先升高后降低的趋势,溶解氧(DO)质量浓度及溶解氧饱和度呈现先降低后升高的趋势,盐度和可溶性无机氮的浓度变化不显著。调查海域的温度变化范围为17.84~27.80℃,其中,6月至9月该海域的温度维持在20℃以上,适宜大型绿藻的生长和繁殖;PO4-P浓度维持在较低的水平,为0.07~0.42μmol/L;溶解氧质量浓度为6.03~11.08μg/L,其在7月最低(P<0.05);平均DO饱和度均高于100%,均值为129%~212%,最低值同样出现在7月;在调查期间盐度变化不显著;DIN的平均浓度范围为22.64~30.51μmol/L,各月之间差异不显著(P>0.05)。该海域在调查期间的DIN含量较高,可以为大型绿藻的生长和微观繁殖体的释放提供充足的氮源。
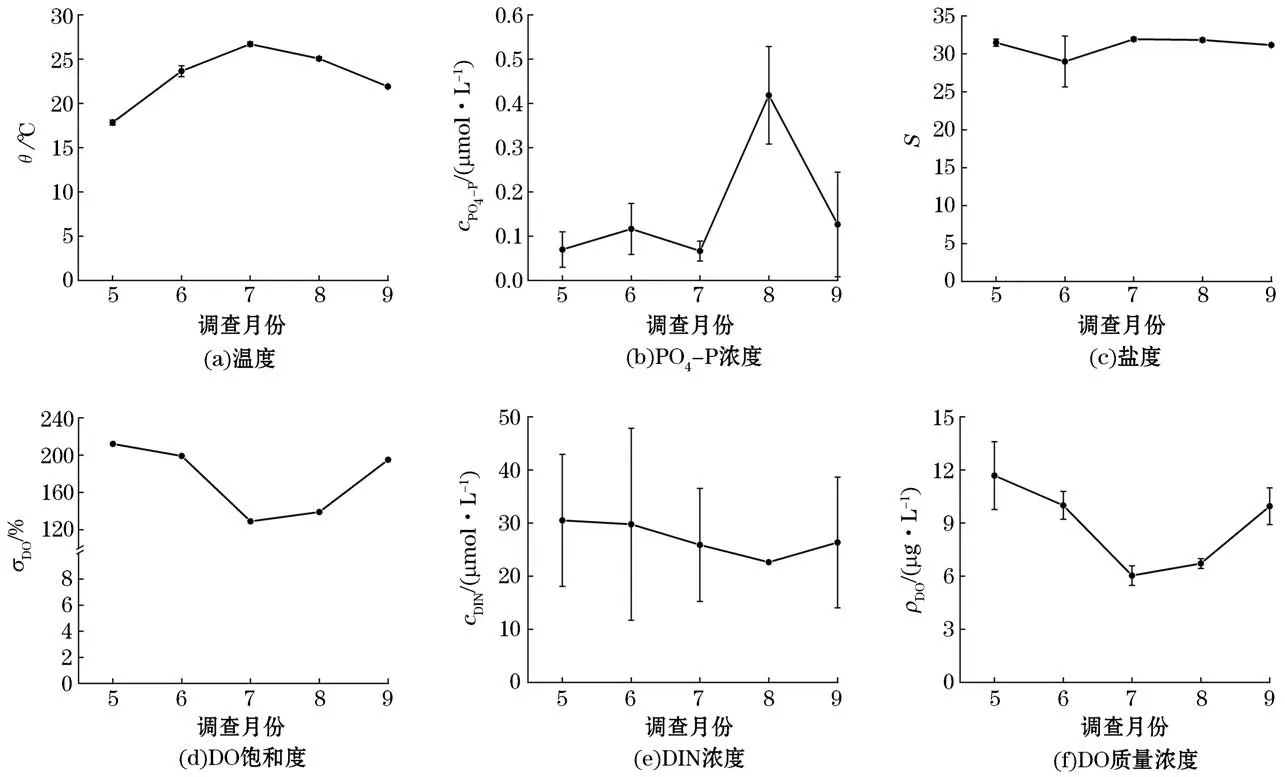
图2 2020年5月至9月秦皇岛金梦海湾海域环境因子变化Fig.2 Temporal variation of environmental factors from May to September,2020
2.2 水体中微观繁殖体的时空分布特征
分析水体中绿藻微观繁殖体的丰度可知,各采样站位水体中绿藻微观繁殖体丰度均较低,为0~4株/L。绿藻微观繁殖体呈现随离岸距离增加而逐渐降低的空间分布特征,在金梦海湾海域离岸较近的站位(站位1~3)发现了较多的绿藻微观繁殖体,而在莲花岛以外离岸较远的水体中却少有绿藻微观繁殖体分布,除站位4在6月及站位5在9月的微观繁殖体丰度为1株/L外,其余各月站位4~6的微观繁殖体丰度均为0株/L(图3)。近岸不同采样站位(站位1~3)之间绿藻微观繁殖体丰度的差异不显著(P>0.05)。
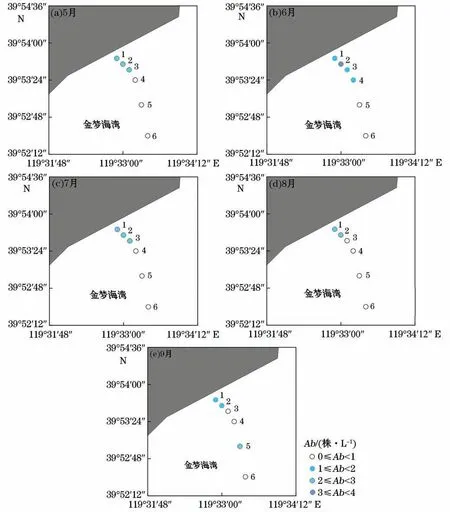
图3 水体中绿藻微观繁殖体丰度的空间分布Fig.3 Spatial distribution of micro-propagules in the sea water
在时间分布上,水体中绿藻微观繁殖体总丰度最高值出现在6月,为10.5株/L;最低值出现在7月和8月,均为3株/L(图4)。

图4 水体中绿藻微观繁殖体丰度的时间分布Fig.4 Temporal variation of micro-propagules in the surface water
2.3 沉积物中微观繁殖体的时空分布特征
在空间分布上,经对比各站位绿藻微观繁殖体的丰度可知,距离岸滩最近的采样站位(站位1~3)0~10 cm深度沉积物中的绿藻微观繁殖体丰度的总和显著高于其他采样站位(P<0.05),在离岸远的3个采样站位(站位4~6)的沉积物中的绿藻微观繁殖体的丰度却极小。所以,0~10 cm深度的沉积物中绿藻微观繁殖体的丰度总和在空间分布上也呈随离岸距离增加而逐渐降低的趋势(图5),这与水体中的绿藻微观繁殖体丰度的空间分布特征相似。深度为10 cm沉积物中微观繁殖体丰度总和的分布除了在各站位之间存在差异之外,在垂直方向上也存在分布上的差异(图6),深度为5 cm表层沉积物中绿藻微观繁殖体的丰度远远高于深于5 cm沉积物中的微观繁殖体丰度。在8月和9月,由于绿藻微观繁殖体分布较少,其丰度在垂直方向上没有显著的分布特征(P>0.05)。
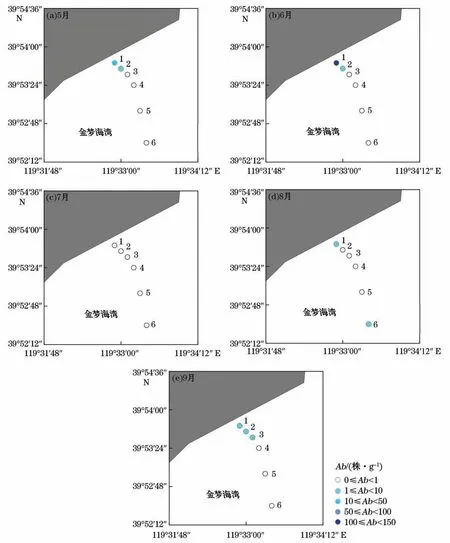
图5 沉积物中绿藻微观繁殖体丰度的空间分布Fig.5 Spatial distribution of micro-propagules in the sediment
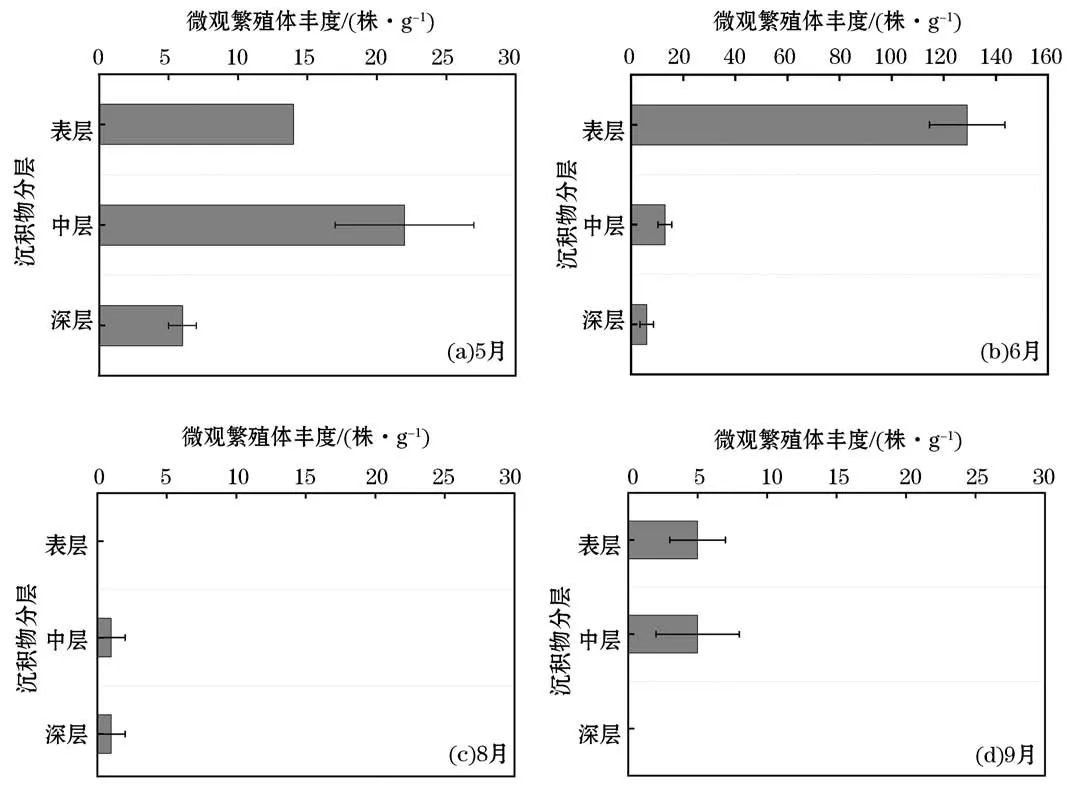
图6 绿藻微观繁殖体在沉积物中的垂直分布Fig.6 Virtical distribution of micro-propagules in the sediment
绿藻微观繁殖体的时间分布如图7所示。沉积物中绿藻微观繁殖体在6月的丰度最高(148株/g),在8月和9月的丰度较低(分别为2株/g和10株/g),而在7月的丰度为0。沉积物中绿藻微观繁殖体的丰度在不同月份之间存在较大差异,与水体中绿藻微观繁殖体丰度的时间分布不同。

图7 2020年5月至9月沉积物中绿藻微观繁殖体丰度变化Fig.7 Temporal variation of micro-propagules in the sediment
2.4 绿藻微观繁殖体的种类组成
经水体及沉积物培养出的幼苗的分子鉴定结果如图8所示。其中,5月、6月、8月和9月培养得到的沉积物中的绿藻微观繁殖体的种类组成分别用S-5、S-6、S-8、S-9表示,水体中绿藻微观繁殖体的种类组成用SW表示。

图8 沉积物及水体中绿藻微观繁殖体的种类组成Fig.8 Species compositions of the micro-propagules in the sediment and water
沉积物及水体中有孔石莼(Ulva pertusa)、浒苔(Ulva prolifera)、缘管浒苔(Ulva linza)以及一种石莼属的未知种(Ulvaspp.)[36]等大型绿藻的微观繁殖体。检测得出的绿藻微观繁殖体种类组成与之前的调查中该海域大型海藻的种类组成相一致[25],也与现场调查中观测到的大型海藻种类一致。秦皇岛绿潮的主要致灾种浒苔微观繁殖体在5月、6月和8月均有出现,其中,在6月浒苔占比最高,达到40%;缘管浒苔仅在9月的沉积物中发现,占比为20%;孔石莼在6月的沉积物中和水体中均有分布。
2.5 绿藻微观繁殖体丰度与环境因子及大型海藻的关系
绿藻微观繁殖体的丰度与可溶性无机氮(DIN)浓度、磷酸盐(PO4-P)浓度、溶解氧(DO)质量浓度、盐度(S)、温度(t)以及该海域悬浮海藻(suspended macroalgae,SMA)和定生海藻(attached macroalgae,AMA)的生物量之间的冗余分析(redundancy analysis,RDA)结果如图9所示。水体中绿藻微观繁殖体(micro-propagules in water,MW)丰度与悬浮海藻生物量、可溶性无机氮浓度呈正相关性,相关性较大;此外,其与溶解氧质量浓度、定生海藻生物量、磷酸盐浓度也呈正相关性,而与盐度、温度呈负相关性。沉积物中的微观繁殖体(micro-propagules in sediment,MS)丰度与环境因子的相关关系基本与水体中绿藻微观繁殖体的相关关系一致,与可溶性无机氮浓度、定生海藻生物量及悬浮海藻生物量有较高的正相关性,但与磷酸盐浓度的相关性较低。
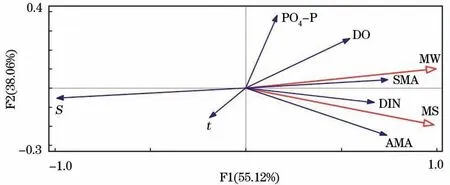
图9 绿藻微观繁殖体丰度分布与环境因子的RDA分析Fig.9 The RDA analysis between environmental factors and the abundance of micro-propagules
3 讨 论
3.1 绿藻微观繁殖体的丰度分布及其影响因素
2020年5至9月,秦皇岛金梦海湾海域的水体中存在少量的绿藻微观繁殖体。其中,6月微观繁殖体的总丰度最高,而7月和8月最低。这些微观繁殖体主要分布在离岸较近的水体中,其丰度随着离岸距离的增加而降低。
沉积物中存在着丰富的绿藻微观繁殖体,在6月微观繁殖体数量最多时,其丰度可以达到148株/g。但在7月,沉积物中的绿藻微观繁殖体丰度为0,在8月和9月也只有少量的绿藻微观繁殖体存在。在空间上,沉积物中的绿藻微观繁殖体在不同采样站位之间的分布与水体一致:近岸多、远岸少。除此之外,沉积物中的绿藻微观繁殖体存在垂直分布特征,沉积物中的微观繁殖体在垂直分布上呈现5 cm以浅丰度高、5 cm以深丰度低的特征,这与黄海沉积物中微观繁殖体丰度的垂直分布特征[37]一致,原因可能是:石莼属绿藻产生的孢子不具备孢囊,其对环境的耐受程度以及存活时间有限;该海域沉积物的沉积作用较强,水体和沉积物交换比较频繁。
水体和沉积物中的绿藻微观繁殖体的时间和空间分布主要受到以下因素的影响:
1)依据微观繁殖体丰度与环境因子之间的相关关系分析,秦皇岛绿藻微观繁殖体的分布与大型海藻的分布密切相关。在有悬浮大型海藻的近岸,水体和沉积物中的绿藻微观繁殖体丰度均较高。这是因为秦皇岛近岸海藻床的定生绿藻生长成熟后,脱离附着基悬浮生长。成熟绿藻释放微观繁殖体,释放的微观繁殖体由于运动能力差通常聚集在源头区域[38],即微观繁殖体丰度随离岸距离的增加而逐渐降低,原因是被海流输送至外海的过程中,其丰度会因海水稀释[22]。
2)在时间分布方面,悬浮海藻和定生海藻生物量的变化趋势与水体和沉积物中绿藻微观繁殖体丰度的变化趋势总体一致,均在6月出现最高值而在7月出现低值。这可能是由该海域发生了异常风暴潮天气(2020年7月18日秦皇岛发布了风暴潮Ⅳ级警报)所致。风暴潮引发的波浪会影响近岸生物群落的结构、分布和生物量,尤其对潮间带以及潮下带的浅水区域中的生物群落[39]影响较大。而且,风暴潮对大型海藻具有移除作用[40]。7月,近岸的悬浮海藻急剧减少,微观繁殖体的释放源头被破坏,造成了微观繁殖体丰度的显著降低。
3)温度、盐度、溶解氧和营养盐等环境要素也会影响水体中微观繁殖体的丰度。当温度、盐度、溶解氧和营养盐均处于较高水平时,大型绿藻会持续释放微观繁殖体,水体和沉积物中的微观繁殖体丰度都会增加[3,41-42]。调查期间,秦皇岛金梦海湾海域的温度和盐度基本处于大型绿藻生长和微观繁殖体释放的适应范围内,但可能由于突发风暴潮的影响,调查期间该海域的温度和盐度与绿藻微观繁殖体的丰度均表现出负相关性。
4)DIN和PO4-P是大型绿藻生长繁殖的重要营养物质[43-44],其浓度和质量浓度与微观繁殖体丰度呈现正相关关系。在调查期间,海域中丰富的DIN为大型绿藻的生长和微观繁殖体的释放提供了充足的氮源,使得绿藻微观繁殖体在金梦海湾海域广泛存在。
3.2 绿藻微观繁殖体在绿潮暴发中的作用
调查中发现:悬浮海藻释放的微观繁殖体广泛分布在秦皇岛金梦海湾海域的水体和沉积物中,在条件适宜时,这些微观繁殖体可以附着在泥沙颗粒等基质上萌发成幼苗,使绿藻的生物量在短时间内大量增加[22]。
大型绿藻释放的孢子由于不具有趋光性而更多地分布在沉积物中,孢子存活的时间比配子更长[45],在黑暗等不利条件下,水体中的绿藻微观繁殖体减少时,沉积物中的孢子仍能萌发,并在水体与沉积物交换时对水体中的微观繁殖体进行补充。
4 结 论
本文采用了现场调查与室内实验相结合的方法,调查了秦皇岛金梦海湾海域的绿藻微观繁殖体,并分析了影响该丰度分布的因素,得出结论:2020年5月至9月,绿藻微观繁殖体在秦皇岛金梦海湾海域的水体和沉积物中广泛存在。在时间上,微观繁殖体丰度在6月丰度最高,在7月和8月丰度较低。在空间上,绿藻微观繁殖体主要分布在金梦海湾近岸幼大型海藻分布的海域;在沉积物中微观繁殖体存在垂直分布规律,主要分布在5 cm以浅的沉积物中。绿藻微观繁殖体丰度的时空分布主要受到大型绿藻的影响,也受该海域温度、盐度、DIN、PO4-P等环境因子的影响。
秦皇岛位于中纬度地区,冬季气温低、持续时间长。大型绿藻往往通过释放微观繁殖体,形成“种子库”来耐受冬季的恶劣条件[45-47],为第二年绿潮的暴发提供物质基础。因此,研究绿藻微观繁殖体的时空分布特征及影响因素将有助于判别绿藻的来源,研究绿藻微观繁殖体的越冬机制,以及为防治措施的制定等提供科学依据。

