慢性肾脏病合并心功能不全患者微炎症因子、钙磷代谢水平变化及临床意义
沈裕欣 王扬扬 邓文艳 张 璟
安徽医科大学第四附属医院肾内风湿科,安徽合肥 230001
慢性肾脏病发病较为隐匿,临床无特异性表现和症状,大部分患者出现胃肠道症状就诊时已经为中晚期,且合并营养不良、贫血、炎症、心功能不全等并发症,严重影响患者生存质量和生命健康[1-2]。钙磷代谢紊乱作为慢性肾脏病常见的一种并发症,主要表现为低钙血症、高磷血症、继发性甲状旁腺功能亢进等[3-4]。有研究结果显示,慢性肾脏病患者多存在微炎症状态,该状态不仅参与其疾病的发生、发展,还与并发症发生存在一定关系[5-6]。也有研究结果显示,慢性肾脏病患者炎症反应与钙磷代谢存在一定相关性[7]。因此,为进一步研究微炎症因子与钙磷代谢紊乱之间的相关性,本研究选取安徽医科大学第四附属医院(以下简称“我院”)收治的85 例慢性肾脏病合并心功能不全患者进行研究,总结并分析患者微炎症因子、钙磷代谢水平变化及临床意义。
1 资料与方法
1.1 一般资料
选取我院于2018 年3 月至2020 年3 月收治的85 例慢性肾脏病合并心功能不全患者进行研究。纳入标准:①年龄≥18 周岁;②符合改善全球肾脏病预后组织[8]2012 年规定的关于慢性肾脏病标准及分级;③病情稳定的规律透析。排除标准:①合并急性肾损伤;②纳入研究前7 d 发生显性、隐形感染;③合并恶性、良性肿瘤;④纳入研究前1 个月接受过免疫抑制治疗,规律服用过维生素D、磷结合剂、钙剂等药物。所有患者中男50 例,女35 例,根据患者估算肾小球滤过率(estimated glomerular filtration rate,eGFR)水平分为慢性肾脏病1~2 期组(14 例)、慢性肾脏病3 期组(22 例)、慢性肾脏病4 期组(23 例)、慢性肾脏病5 期组(26 例)。另选取同期我院的健康体检者30 名作为对照组进行研究。本研究经我院医学伦理委员会批准后实施。
1.2 观察指标及检测方法
实验室指标:所有患者常规抽取外周静脉血4 ml离心(转速:3000 r/min,时间:10 min,离心半径:8 cm),分离血清后静置待检,采用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)及免疫比浊法检测各组血清纤维蛋白原(fibrinogen,FIB)、降钙素原(procalcitonin,PCT)、超敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平,试剂盒购自上海恒远生物科技有限公司。应用美国贝克曼库尔特公司生产型号为AU680 的全自动生化分析仪检测血磷(phosphorus,P)、血钙(calcium,Ca)、甲状旁腺激素(parathyroid hormone,PTH)、血肌酐(serum creatinine,Scr)水平。操作完全按照试剂盒说明书进行。
eGFR 测定:根据2009 年美国肾脏病流行病合作组(CKD-EPI)提出的CKD-EPI 方程[9],应用eGFR 相关计算软件,输入患者性别、Scr、年龄,计算eGFR。
5 期:0~<10 ml/(min·1.73m2);4 期:10~30 ml/(min·1.73m2);3 期:>30~60 ml/(min·1.73m2);2期:>60~90 ml/(min·1.73m2);1 期:>90 ml/(min·1.73m2)。
1.3 统计学方法
应用SPSS 19.0 软件包进行统计学分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两组间比较采用q 检验(Newman-Keuls法);计数资料采用例数和百分比表示,组间比较采用χ2检验;采用Pearson 相关分析对患者微炎症状态与钙磷代谢的相关性进行分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 各组血清FIB、PCT、hs-CRP 水平比较
慢性肾脏病1~2 期、3 期、4 期、5 期组FIB、PCT及hs-CRP 水平高于对照组,差异有统计学意义(P <0.05)。慢性肾脏病4 期组PCT 水平明显高于慢性肾脏病1~2 期、3 期组,慢性肾脏病5 期组PCT、hs-CRP水平明显高于慢性肾脏病1~2 期、3 期、4 期组,差异有统计学意义(P <0.05)。见表1。
表1 四组患者血清FIB、PCT、hs-CRP 水平比较()

表1 四组患者血清FIB、PCT、hs-CRP 水平比较()
注 与慢性肾脏病1~2 期组比较,aP <0.05;与慢性肾脏病3 期组比较,bP <0.05;与慢性肾脏病4 期组比较,cP <0.05;与对照组比较,dP <0.05。FIB:纤维蛋白原;PCT:降钙素原;hs-CRP:超敏C 反应蛋白
2.2 各组P、Ca、PTH 水平比较
慢性肾脏病1~2 期、3 期、4 期、5 期组P、PTH 水平高于对照组,慢性肾脏病1~2 期、3 期Ca 水平低于对照组,4 期、5 期组高于对照组,且慢性肾脏病3 期组PTH 水平显著高于慢性肾脏病1~2 期组,慢性肾脏病4 期组PTH、Ca 水平显著高于慢性肾脏病1~2 期、3 期组,慢性肾脏病5 期组P、PTH 水平显著高于慢性肾脏病1~2 期、3 期、4 期组,慢性肾脏病5 期组Ca 水平显著高于慢性肾脏病3 期、4 期组,差异有统计学意义(P <0.05)。见表2。
表2 各组P、Ca、PTH 水平比较()

表2 各组P、Ca、PTH 水平比较()
注 与慢性肾脏病1~2 期组比较,aP <0.05;与慢性肾脏病3 期组比较,bP <0.05;与慢性肾脏病4 期组比较,cP <0.05;与对照组比较,dP <0.05。P:磷;Ca:钙;PTH:甲状旁腺激素
2.3 患者PCT、hs-CRP 水平与P、Ca、PTH 水平的相关性分析
患者PCT 水平与P、PTH 水平呈正相关,与Ca 水平呈负相关;hs-CRP 与P、PTH 水平呈正相关,与Ca 水平呈负相关(P <0.05)。见表3。
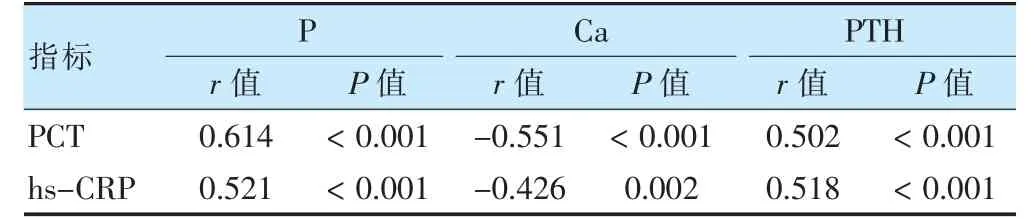
表3 患者PCT、hs-CRP 水平与P、Ca、PTH 水平的相关性分析
3 讨论
微炎症状态是一种免疫炎症,其在慢性肾脏病中可引发血脂代谢异常、心血管并发症、骨营养不良、内皮功能障碍等[10],引发该状态的原因主要有氧化应激、肾脏透析相关因素及本身清除率下降、肥胖及血脂代谢异常、肠道菌群失调、营养不良等。机体炎症指标分为单核细胞衍生的细胞因子和急性时相反应蛋白,前者包含白细胞介素、肿瘤坏死因子等,后者包含血清淀粉样蛋白A 和C 反应蛋白、纤维蛋白原等。其中PCT、hs-CRP 是目前反映微炎症状态的重要指标[11-12]。两者水平与心血管事件严重程度密切相关,且对于心血管风险预测具有重要价值[13~14]。因此,本研究将PCT、hs-CRP 指标纳入以探讨微炎症状态与钙磷代谢的关系。
本研究结果显示,慢性肾脏病5 期患者PCT、hs-CRP 水平明显高于其他各期患者,慢性肾脏病4 期患者PCT 水平明显高于其他各期患者。提示慢性肾脏病患者微炎症状态主要存在于5 期患者,与既往研究结果一致[15-16]。动脉粥样硬化性心血管是导致慢性肾脏病患者死亡的主要并发症,有研究指出,肝脏产生的具有凝血功能的纤维蛋白原水平与心肌梗死发生率呈正相关,因此其作为监测冠状动脉病变程度对于了解血管硬化具有重要意义[17-18]。虽然各期慢性肾脏病患者纤维蛋白原水平相当,但较正常范围明显偏高,说明慢性肾脏病患者发生动脉粥样硬化的概率明显更高。
钙磷代谢紊乱主要表现为骨代谢异常、钙磷代谢异常等,其中钙磷代谢异常是钙磷代谢紊乱的基础,其导致的血管钙化与心血管疾病关系密切,是引发慢性肾脏病患者心功能不全时间增加的独立危险因素[19-20]。相关研究结果显示,慢性肾脏病各阶段均会发生血管钙化,但主要集中在3 期和4 期,在进入透析治疗阶段后,血管钙化发生率甚至高达50%[21-23]。本研究结果显示,慢性肾脏病4 期患者Ca 水平较1、2 期患者显著上升,分析原因可能是患者在确诊后积极摄入骨化醇、钙剂、高钙食品等。PTH 水平则随疾病分期增加而升高,与以往研究一致[24-25]。
同时,进一步研究显示,患者PCT 水平与P、PTH水平呈正相关,与Ca 水平呈负相关;hs-CRP 与P、PTH水平呈正相关,与Ca 水平呈负相关。提示患者存在微炎症状态,钙磷代谢水平异常,两者之间存在一定相关性[26-28]。因此,想要改善钙磷代谢水平,首先应当降低炎症介质水平,改善微炎症状态,从而避免钙磷代谢紊乱。
综上所述,慢性肾脏病合并心功能不全患者存在微炎症状态,钙磷代谢水平异常,其微炎症状态与钙磷代谢可能具有一定相关性。

