G-四链体探针在病毒基因检测和成像中的应用进展
张家恒,雷春阳,聂 舟
(化学生物传感与计量学国家重点实验室,生物大分子化学生物学湖南重点实验室,湖南大学 化学化工学院,湖南 长沙 410082)
病毒依赖宿主细胞完成其生命周期,是地球上数量最丰富的生物实体,影响着包括动物、植物、寄生虫、真菌和细菌在内的所有生物[1]。病毒感染引发的传染病通常在广泛的地理区域突然传播而导致大面积暴发,严重影响着人类健康、国民经济以及社会的整体福祉[2]。除急性疾病外,病毒感染至少导致15%~20%的癌症,并与神经系统和其他慢性疾病相关[3],因此开发检测病毒的工具对防治病毒感染和预防病毒疾病具有重要意义。大多数病毒主要由病毒基因组(RNA 或DNA)、结构蛋白(如衣壳)以及脂质膜(包膜病毒)组成,病毒通过表面受体或蛋白质附着在宿主细胞上,进入细胞后病毒基因组被剥去包膜并释放到细胞质中,在相应的位置通过不同的策略复制、转录并合成新的基因组以及蛋白质,进而组装成新的病毒颗粒并释放到细胞外(图1)[4]。病毒基因组在病毒的生命周期中发挥着至关重要的作用,并为病毒的检测提供了有效靶点,发展基因组的检测方法对于了解病毒的机制以及实现病毒的示踪至关重要。

图1 病毒生命周期的示意图[4]Fig.1 Cartoon representation of virus life cycle[4]
G-四链体(G4)是由富含鸟嘌呤的核酸折叠形成的一种稳定的核酸二级结构。其中,4个鸟嘌呤通过Hoogsteen氢键作用形成G-quartet平面结构,两个以上的G-quartet通过π-π堆叠构建稳定的G4结构[5]。基因组中存在大量的G4潜在位点,因此其生物功能得到了广泛关注[6]。近年随着G4相关结合蛋白的发现,G4结构的生物功能得到进一步挖掘,其被认为参与多种生物功能的调节,在重要的细胞生理过程中起到关键作用(图2)[7-8]。此外,G4结构本身的特点以及功能性也得到越来越多的关注,基于G4的核酸纳米结构以及生物传感方法也得到了快速发展[9],被广泛用于目标物的识别以及信号转换放大。

图2 G-四链体的生物调节功能[8]Fig.2 Biological regulation function of G-quadruplexes[8]
鉴于G4 在生理过程中至关重要的作用,以及G4 结构中特殊的G 平面为其与有机探针的结合提供了有效的平台,G4 特异性探针得到迅速发展。G4 探针一般以苯并噻唑类、花青类、方酸类、蛋白生色团类、萘二酰亚胺类以及卟啉类等结构骨架为基础[10],进行适当的修饰以满足不同的需求。不同探针所具有的独有性质以及优势,被广泛用于G4生物传感方法的构建以及G4结构的检测和细胞成像[11]。此外,G4被认为是癌症等多种疾病的潜在治疗靶点,大量G4配体通过与生物体内G4相互作用,展现出优异的治疗活性,有望成为相关疾病的有效药物[12-16]。
G4探针构建的生物传感方法实现了对多种病毒基因序列的免标记检测,在病毒相关疾病的诊断和临床分析领域显示出巨大的潜力。此外,研究证明G4存在于在一些病毒基因组中,参与基因调控以及病毒关键过程,成为病毒基因中的潜在成像靶点,为病毒的可视化提供了新的思路。因此,本文综述了基于G4 探针的生物传感方法在病毒基因检测中的研究进展,并总结了G4 结构在多种病毒中的生理作用以及G4 探针在病毒基因组成像中的应用,最后对病毒检测存在的问题及发展趋势进行了总结和展望。
1 基于G4探针的生物传感方法用于病毒基因的检测
1.1 基于荧光信号的G4生物传感方法
G4荧光探针与G4结合后荧光将会出现明显的变化,因此G4/探针复合物作为信号输出的生物传感方法已被用于多种病毒基因的检测。郭良洽课题组[17]利用等温杂交链式反应(HCR)构建了一种G4荧光生物传感方法,实现了HIV DNA 的免标记无酶荧光检测。作者将G4 结构整合到两个发夹结构中,目标物HIV DNA 存在时,大量G4 沿着DNA 纳米线通过HCR 自组装而成,以G4 染料N-甲基卟啉二丙酸IX(NMM)作为荧光响应元件,完成对HIV DNA 的检测,检出限低至0.5 nmol/L。该方法在病毒诊断和临床分析领域显示出巨大潜力。2020年,蔡昌群课题组[18]以染料硫黄素T(ThT)为检测信号源,建立了一种简便快速的HIV DNA 荧光检测方法。该策略使用发夹DNA 序列(H1)和两条辅助链,目标DNA 与H1杂交形成G4结构,辅助探针与未折叠的H1杂交形成稳定的DNA双链,导致目标物发生位移,参与另一个反应循环进而产生大量G4结构,导致ThT的荧光信号明显增强,线性范围为0.1~50.0 nmol/L,检出限为13 pmol/L。
鼻咽癌与孢疹病毒(EBV)感染有关,EBV 潜伏膜蛋白1(LMP1)是可能参与上皮转化的候选病毒基因,LMP1的基因缺失与鼻咽癌之间存在潜在关联。因此开发灵敏、高效检测LMP1基因缺失的方法至关重要。Ma课题组[19]筛选了7个发光铱(Ⅲ)配合物,探究其与分裂型G4的结合能力,并建立了一种检测LMP1基因缺失的无标记发光开关方法。两个短的寡核苷酸P1和P2含有互补区域,可用于识别靶标基因缺失位点旁边的DNA序列,另一端含有富G序列,距离拉近时形成分裂的G4。野生型DNA(LMP1基因无缺失)存在时,两个寡核苷酸不能形成分裂G4;突变型DNA(del-LMP1,缺失30 nt 的基因)存在时,较短的靶序列使两个G4形成序列接近,形成分裂G4进而使荧光信号增强,实现对LMP1基因缺失的灵敏检测。该基因缺失检测方法将有望成为生物化学和生物医学研究中的新型诊断工具,并应用于鼻咽癌疾病的检测。2021 年,该课题组基于聚合酶链反应,选择性识别G4 的铱(Ⅲ)配合物发光探针,开发了一种超灵敏检测乙型肝炎病毒(HBV)DNA 的无标记荧光传感方法[20]。该方法采用含有氧乙二醇醚的两个发夹结构引物进行PCR 扩增,在两端产生多个带有游离G4 序列的特异性PCR 产物,与铱(Ⅲ)配合物结合后增强荧光强度,实现HBV 基因的灵敏检测。该方法能够实现正常和患者血清样本中HBV DNA的检测,在生物分析方面展现出潜在的应用价值。
蔡昌群课题组[21]利用Mg(Ⅱ)依赖的DNAzyme和G4开发了一种免标记检测H5N1 DNA的传感方法。无分析物时分裂的DNAzymes 与底物杂交,形成无活性的DNAzyme。加入目标物后,裂解的DNA 酶的每条链末端与分析物结合,激活DNAzyme的活性裂解底物链并释放G4,进而激活ThT的荧光。除了单一目标物的检测,多目标的同时检测也备受关注,该课题组基于G4和DNA模板银纳米簇(AgNCs),制备了一种快速、无标记、多功能同时检测多个目标的荧光工具[22]。作者将两端均设计为识别区域,只加入病毒亚型H5N1 基因或microRNA-141 时,释放G4 与ThT 结合,产生特异性荧光响应;只加入流感病毒亚型H1N1 基因或microRNA-21 时,两个分裂的AgNC 靠近产生纳米簇二聚体进而增强荧光强度;多靶点加入时,G4 和AgNCs 均产生荧光信号。该策略实现了对病毒DNA 和microRNA 的单一以及双重检测,为不同靶点检测提供了一个多功能的平台。
1.2 基于过氧化物酶的G4生物传感方法
G4 平面能与Hemin 发生π-π 堆叠作用稳定其结构,并增强Hemin 的类过氧化物酶活性[23]。Hemin/G4 DNAzyme 能够模拟HRP 对一些无色底物(如ABTS 和四甲基联苯胺)进行氧化,产生颜色变化,另外也能产生电化学、化学发光以及荧光信号。因此,Hemin/G4 DNA zyme 的优异催化性能为G4生物传感方法的构建提供了新的思路以及强有力的工具。
Connelly 等[24]设计了一种可提供视觉输出信号的分裂G4 探针(图3A)。其中,两条DNA 链杂交到目标物的对接位置,在Hemin辅因子存在下形成G4结构,催化过氧化氢将ABTS2-氧化为有色氧化产物ABTS-·,进而实现颜色的变化,从而成功检测甲型流感病毒基因组(H1N1 亚型)片段。Wang 等[25]基于末端脱氧核苷酸转移酶(TdT)的模板聚合活性,结合Mg2+依赖的DNAzyme 和Hemin/G4 DNA zyme 的级联扩增,报道了一种简单、快速、灵敏的黄瓜绿斑驳花叶病毒的视觉检测方法。如图3B 所示,T1/P1的杂交dsDNA 被限制性内切酶AcⅡ切成两部分,在TdT 和dCTP 存在下,4 条ssDNA 片段生成完整的Mg2+依赖的DNAzyme酶序列,将HP裂解为两部分,释放出HP茎段G4序列。Mg2+依赖的DNAzyme的回收酶序列启动另一轮杂交/裂解/分离反应,释放出更多的G4,结合Hemin 能够催化H2O2氧化ABTS2-,导致溶液变成绿色,从而为病毒检测和植物保护提供了快速高效的平台。

图3 基于分裂G4用于甲型流感病毒基因组片段(H1N1)的视觉检测[24](A),以及黄瓜绿斑驳花叶病毒视觉检测的脱氧核苷酸转移酶(TdT)辅助扩增策略示意图[25](B)Fig.3 Visual detection of a fragment of the Influenza A virus genome(subtype H1N1)based on the split G-quadruplex[24](A),schematic illustration of terminal deoxynucleotidyl transferase(TdT)-assisted amplification strategy for visual detection of cucumber green mottle mosaic virus[25](B)
2 基于G4探针的病毒基因组成像研究
2.1 病毒基因组中的G4结构成为潜在的成像靶点
大量研究表明病毒基因组中部分富G序列能够形成稳定的G4结构,在病毒的生理周期中起到关键的调控作用[26]。人类免疫缺陷病毒(HIV)是人类获得性免疫缺陷综合征的病原[27],分子生物学分析表明HIV-1 病毒序列存在高度保守的G4 结构,G4 特异性配体BRACO-1 能够结合HIV-1 基因组中G4结构而抑制病毒的转录及逆转录过程[28]。全基因组生物信息学分析显示疱疹病毒基因组含有大量的潜在G4 结构[29-30];G4 配体PDS 能够增强EBV 病毒(疱疹病毒的一种亚型)基因组中G4 结构的稳定性,抑制负责免疫逃逸的关键蛋白EBNA1 的合成。周翔课题组[31]的研究表明丙肝病毒(HCV)RNA 基因组中具有高度保守的正平行G4 结构;G4 配体TMPyP4 特异性结合G4 并有效稳定其结构,进而降低RNA复制,抑制相关蛋白转录。此外,乙肝病毒的preS2/S基因启动区域也存在潜在的G4序列[32]。
2020 年,SARS-CoV-2 引起的冠状病毒肺炎疫情席卷了全球200 多个国家,对世界公共卫生安全产生了严重影响。生物信息学研究表明SARS-CoV-2 的开放阅读框区域内存在25 条潜在的G4 折叠序列[33]。曲晓刚课题组[34]采用多种生物物理及分子生物学技术手段,对其中四条潜在G4 序列(RG-1、RG-2、RG-3 和RG-4)进行深入研究,首次证明RG-1 序列在活细胞中能够折叠为稳定的平行G4 结构。G4特异性配体PDP能够促进RG-1 G4结构的形成,降低SARS-CoV-2核衣壳磷酸化蛋白在体外和体内的表达水平。
综上所述,G4 结构存在于多种病毒的基因组中,并参与病毒的关键生理过程;小分子G4 配体已成为探索病毒生命周期复杂机制的重要工具。因此,病毒基因组中G4 结构是潜在的病毒生物成像靶点,发展G4结构特异性荧光分子探针有望为活细胞中病毒基因组的可视化成像分析提供支撑。
2.2 G4探针用于病毒基因组的成像
丙型肝炎病毒(HCV)是一种具有代表性的单链RNA 病毒,已感染全球1.7 亿多人,HCV 感染将导致肝炎、肝硬化以及肝癌等[35]。病毒的整个生命周期依赖于宿主细胞,因此对活细胞中的病毒RNA 进行检测和成像不仅对了解病毒RNA 翻译、复制和定位的时空动态至关重要,也对监测病毒感染的进展和应用治疗的疗效具有重要意义[36]。2019 年,本课题组基于荧光探针开发了一种免标记的病毒RNA 点亮系统用于活细胞内HCV 的可视化(图4A)[37]。相关文献报道HCV RNA 基因组中具有保守的G4 结构,选取HCV 2a 亚型感染病人中基因组+259 到+288 位点之间的序列作为研究对象并且命名为CG2a,该序列能够稳定形成正平行G4。以商业染料ThT 为基础设计了新型G4 特异性染料ThTNE,G4 通过π-π 堆叠与该探针结合并且限制N,N-二乙基苯胺以及苯并噻唑之间的旋转,进而抑制ThT-NE 的扭转分子内电荷转移过程使其荧光大幅增强。ThT-NE 与CG2a 结合后荧光增强1 693 倍,然而CG2a 突变序列以及其他类型构象的核酸结构均不能激活其荧光,表明ThT-NE 能特异性识别CG2 的G4 结构。
细胞实验证明ThT-NE能够特异性结合HCV RNA 中的G4进而实现活细胞中HCV 全长基因组的可视化,并且具有快速响应、高信背比以及优异的选择性。相对于商业探针ThT,ThT-NE 具有更高的脂水分配系数,有助于其更快进入细胞,更适用于细胞成像。该点亮方案具有免化学标记和基因修饰的优势,能够监测病毒RNA 基因组亚细胞分布(图4B),对分析HCV 感染以及丙肝病毒生命周期具有重要意义。此外,ThT-NE被用于监测实验室制备的病毒颗粒(图4C)以及临床分离的HCV病人血清的真实感染过程(图4D)。高浓度的ThT-NE 长时间孵育可有效抑制病毒RNA 水平以及Core 和NS3 蛋白的表达量,展现出抗病毒潜力。这种新型点亮方案将G4 特异性探针扩展到活细胞中与疾病相关的G4可视化,无需对病毒进行修饰或标记,也无需对宿主细胞进行固定、裂解或加工,从而为进一步理解G4结构在病毒中的功能提供了新型工具。
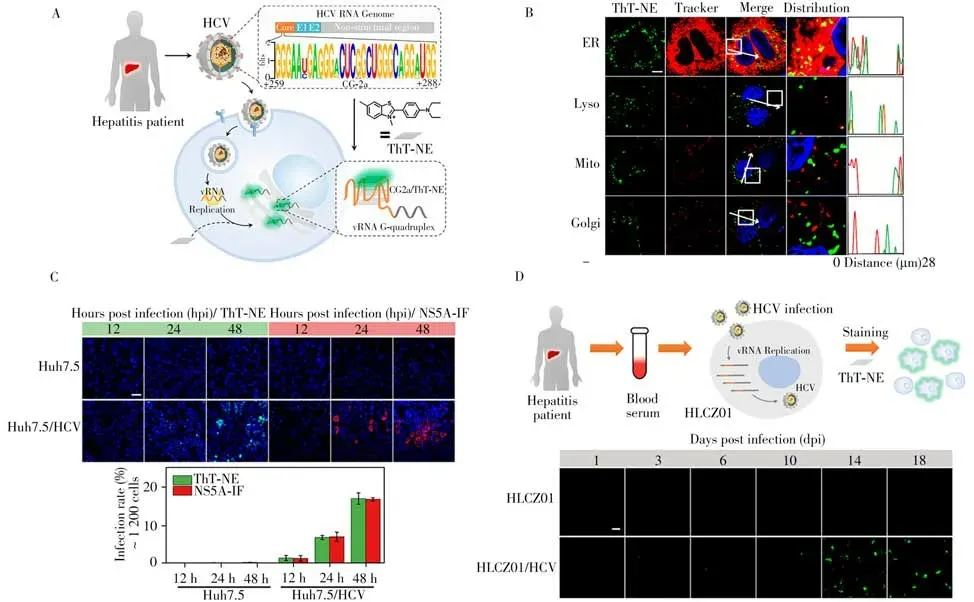
图4 利用G4特异性探针ThT-NE构建的点亮系统用于HCV RNA成像的示意图(A)及用于监测细胞中HCV 基因的亚细胞器分布(B);ThT-NE用于HCV病毒感染细胞的监测(C)及HCV病人血清感染细胞的监测(D)[37]Fig. 4 Principle of the HCV RNA light-up system using the G-Quadruplex probe ThT-NE(A),subcellular distribution of HCV RNA in living cells using ThT-NE(B),detection of virus infection by the laboratory prepared HCV virus(C)and the native virus in blood sera from HCV patients(D)using ThT-NE[37]
3 总结与展望
基于G4 结构本身的特点以及功能性,如识别功能、荧光激活以及催化活性等,G4 探针构建的生物传感方法被用于病毒基因的检测,为病毒相关疾病的早期诊断提供了不可或缺的工具。然而,现有的方法较少应用于真正病毒感染模型或实际样品,探究这些方法在病毒感染细胞或者病例中的检测效果,或者开发能够用于细胞内或活体内病毒基因组的成像工具,将会极大扩展G4染料构建的生物传感方法在病毒检测中的应用,为病毒的监测提供更多的有效平台。
G4存在于大量病毒基因组中,在病毒生命周期中起重要的调节作用,为开发探究病毒生命过程的可视化工具以及抗病毒活性的新型药物提供了新的思路。细胞内G4的可视化为探究其相关生物功能提供了极大的帮助,G4 抗体或者G4 染料通过成像病毒基因组中G4 实现了对细胞中病毒的实时可视化,可对病毒的感染以及生命周期进行监测[37]。然而,大多数配体以及染料仅能识别G4或者特定拓扑结构的G4,不能选择性结合病毒基因组中特定序列的G4,因此筛选出特异性识别特定病毒G4 的染料仍然是亟待解决的重要问题。除了G4结构中均有的G4平面,不同病毒G4中的不同Loop环以及沟槽为特异性染料的设计提供了结合位点,利用分子的侧链结合Loop 或者沟槽将有助于识别不同序列的病毒G4[38]。基于结构的虚拟筛选和优化已经得到了特异性结合PU22 的荧光探针,该策略为筛选得到病毒G4 序列的特异性探针提供了新思路[39]。目前用于病毒基因组成像的G4 探针较少,开发更多用于不同病原体的新型G4 探针将会为病理学研究和临床诊断提供方便易操作的有效工具。此外,现有的G4 探针大多聚焦在细胞中的成像,发展适用于活体中病毒G4 的近红外成像探针将扩展G4 探针在该领域更广阔的应用前景。

