苦荞FtC4H基因克隆与生物信息学分析
尹桂芳 段 迎 杨晓琳 蔡苏云 王艳青卢文洁 孙道旺 贺润丽 王莉花
(1云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,650205,云南昆明;2山西中医药大学中药与食品工程学院,030619,山西太原)
苦荞[Fagopyrum tataricum (L.) Gaertn],别名鞑靼荞麦,是一种药食兼用的传统作物。我国苦荞栽培面积约30万hm2,每年总产量约30万t,云南、贵州、四川和山西等省是苦荞的主产区,占全国产量的80%左右[1]。早在两千年以前的古书著作《诗经》、《神农书》和《齐民要术》中就有苦荞的栽培和食用记载[2]。苦荞有着极高的黄酮含量,含量远高于甜荞[3]。黄酮具有降血糖[4-5]、抗氧化[6]、防癌[7]、降血压[8]以及抗炎[9]的作用。
肉桂酸-4-羟基化酶(C4H)也称反式肉桂酸-4-单氧化酶,由Russell和Conn首次从豌豆芽中发现[10]。迄今为止,已从拟南芥[Arabidopsis thaliana(L.) Heynh.][11]、当归[Angelica sinensis (Oliv.)Diels][12]、茶花(Camellia japonica L.)[13]、桂花[Osmanthus fragrans (Thunb.) Lour.][14]和砀山酥梨(Pyrus bretschneideri Rehd.)[15]等植物中克隆了C4H基因。C4H被鉴定为P450单加氧酶类,属于CYP73亚家族,是苯丙素类化合物生物合成途径中继苯丙氨酸脱氨酶(PAL)之后的第2个关键酶。研究[16]表明,C4H在转录水平上的丰度以及蛋白质水平上的活性可以有效影响植物中黄酮类化合物和木质素的生物合成量。Baek等[17]通过对黑霉的研究发现,C4H表达量与黄酮积累量在果实发育不同时期的变化趋势一致。Liu等[18]发现,K+缺乏时菊花中黄酮含量的降低是由CmC4H等基因的表达量减少导致的。银杏中 C4H的表达水平与木质素的合成呈正相关[19]。黄利娜等[20]对莲雾果实的研究发现,在其贮藏期间,C4H基因的表达水平和木质素含量均逐渐上升,且二者呈极显著正相关。
目前,关于苦荞 C4H基因克隆及生物信息学分析的研究报道较少。陈鸿翰等[21]采用RT-PCR和RACE技术,从苦荞花蕾中克隆得到1个C4H基因的全长cDNA,发现UV-B胁迫显著提高了FtC4H的表达量与总黄酮含量。刘荣华等[22]通过RT-PCR技术从苦荞中克隆到2个FtC4H基因,系统进化分析发现FtC4H1与莴苣亲缘关系较近,FtC4H2与丹参亲缘关系较近。为进一步研究 C4H基因在苦荞苯丙烷合成途径中的调控作用,本研究以云荞1号和小米荞为试验材料,根据前期苦荞转录组数据,从中筛选克隆到1个苦荞FtC4H基因,对其进行生物信息学分析以及实时荧光定量 PCR验证,为探究FtC4H基因功能及遗传改良提供理论依据。
1 材料与方法
1.1 试验材料
试验材料云荞1号和小米荞种植于昆明市安宁市甸心村大田,自然生长。前期通过果壳转录组测序获得C4H基因的序列,为了克隆到相应的基因序列,2020年7月15日剥离果实授粉膨大期、灌浆前期、灌浆后期和成熟期4个发育时期的果壳,将剥离的果壳混合作为基因克隆的材料;同时采集云荞1号和小米荞开花15d时植株的叶、花、茎、果壳和种子样品,放入液氮中保存备用,用于荧光定量PCR分析,每个样品3次生物学重复。
1.2 试验方法
1.2.1 RNA提取与cDNA第1链合成 根据Trizol提取试剂盒的说明提取 RNA,提取的总 RNA用1.5%琼脂糖(1×TAE电泳缓冲液)电泳检测,在紫外透射光下观察。cDNA第1链合成:在0.2mL PCR管中加入5μL总RNA、1μL随机引物和1μL ddH2O,70°C温浴 5min,冰浴 2min;离心,加入2.0μL 5×第 1链缓冲液、0.5μL 10mmol/L dNTP、0.25μL RNA酶抑制剂和0.25μL反转录酶,总体系10.0μL,42°C温浴60min,72°C温浴10min。
1.2.2 苦荞FtC4H基因的克隆 从转录组数据库中检索筛选出苦荞肉桂酸-4-羟基化酶(FtC4H)基因,根据基因核苷酸序列设计2条特异引物(表1)。RT-PCR反应体系为:cDNA 模板 1μL、dNTPs(10mmol/L)0.2μL、2×GC Buffer I 12.5μL、TaqDNA聚合酶(5U/μL)0.2μL、ddH2O 10.1μL、FtC4H-F(10μmol/L)0.5μL、FtC4H-R(10μmol/L)0.5μL。PCR反应条件为:95°C预变性3min,94℃变性30s、58°C 退火 30s、72℃延伸 90s、72℃修复延伸 7min,循环33次。PCR产物用1%的琼脂糖凝胶进行电泳检测,按试剂盒 B518131说明回收符合要求的条带,送生工生物工程(上海)股份有限公司测序。
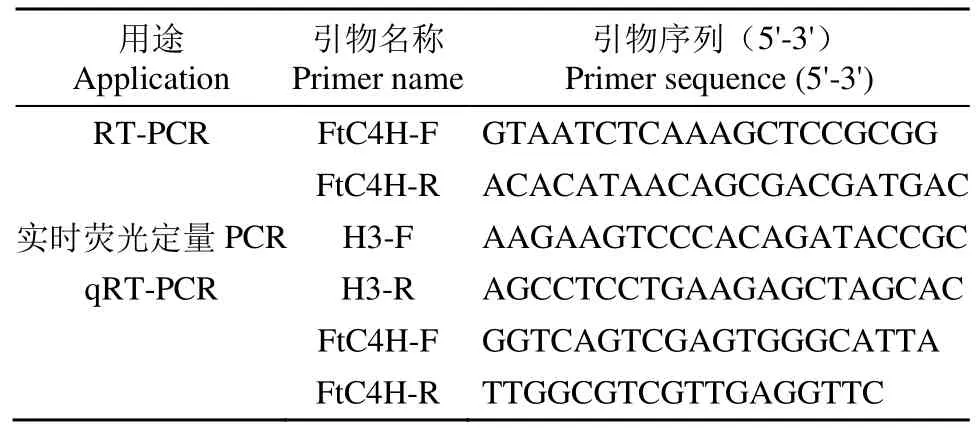
表1 引物序列及用途Table 1 Primer sequences and their applications
1.2.3 克隆基因的生物信息学分析 利用NCBI的ORF finder在线程序及Conserved domains数据库对测序获得的 cDNA序列的开放阅读框(open reading frame,ORF)及保守功能结构域进行分析。通过 ProtParam对蛋白理化性质进行分析;利用ProtScale分析蛋白的亲疏水性。采用 TMHMM Server v. 2.0分析编码氨基酸的跨膜结构域;利用SignalP 5.0 Server预测信号肽;利用 NetPhos 3.1 Server预测磷酸化位点;由 Psort分析亚细胞定位情况。通过SOPMA及SWISS-MODEL预测蛋白质的二级结构和三级结构;用DNAMAN软件比对编码蛋白多重序列;用 MEGA6.0构建 Neighborjoining系统进化树。
1.2.4 实时荧光定量PCR(qRT-PCR)分析 采用Trizol总RNA抽提试剂盒分别提取云荞1号和小米荞叶、花、茎、果壳和种子的总RNA,并反转录得到第1链cDNA,以其为模板,进行qRT-PCR分析,每个样品3次重复。荧光定量PCR总反应体系包含 10μL 的 2× SG Fast qPCR Master Mix、2μL的 cDNA模板、上、下引物各 0.4μL以及 ddH2O 7.2μL。扩增程序为 95°C 3min;95°C 5s,60°C 30s,循环45次。以内参基因H3(JF769134.1)为对照,采用 2-ΔΔCt法计算FtC4H的相对表达量,设计的qRT-PCR引物如表1所示。
1.3 数据处理
利用SPSS 23软件分析数据的显著性水平,用GraphPad Prism 8软件作图。
2 结果与分析
2.1 FtC4H基因的克隆
利用 RT-PCR克隆获得云荞 1号和小米荞的FtC4H基因(Genebank登录号:MZ020784),产物经1%琼脂糖凝胶电泳分析,结果如图1所示。对RT-PCR产物进行测序,序列比对发现从2种苦荞材料克隆得到的C4H基因序列完全一致,命名为FtC4H。ORF finder分析表明,FtC4H的ORF长度为1299bp,编码432个氨基酸。利用DNAMAN将该核苷酸序列翻译成氨基酸序列,如图2所示。
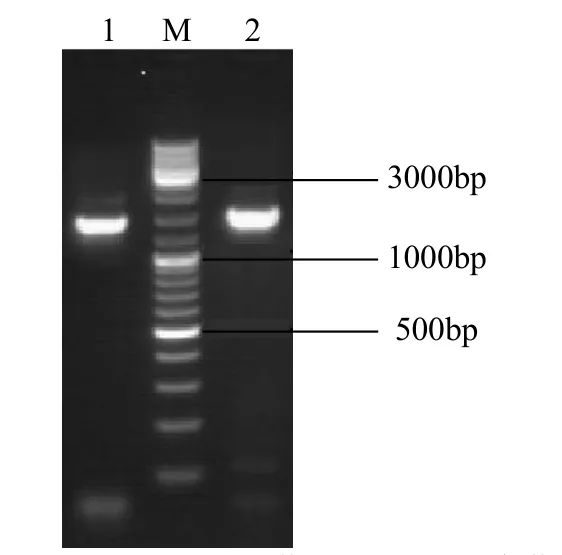
图1 FtC4H克隆片段的PCR电泳图Fig.1 The electrophoresis results of FtC4H fragments

图2 FtC4H的核苷酸序列及氨基酸序列Fig.2 Nucleotide sequence and amino acid sequence of FtC4H
2.2 生物信息学分析
2.2.1 理化性质、亚细胞定位与保守域分析 理化性质预测结果显示,FtC4H蛋白分子式为C2233H3536N624O634S13,理论分子量为49 685.22Da,亲水性平均系数(GRAVY)为-0.331,不稳定系数(II)为48.69,为不稳定蛋白,脂溶指数为95.39,负电荷残基54个,正电荷残基58个,理论等电点为8.73,偏碱性。推测该蛋白为亲水性不稳定碱性蛋白。亚细胞定位结果显示,FtC4H主要分布于细胞质和叶绿体中。通过Conserved domains数据库,对FtC4H的保守结构域(conserved domains)进行分析,发现FtC4H有1个P450结合域(图3)。

图3 苦荞FtC4H蛋白保守结构域分析Fig.3 Conservative structural domain analysis of FtC4H protein in tartary buckwheat
2.2.2 蛋白质疏水性分析及氨基酸翻译后修饰的预测和分析 利用Protscale程序,以Hphob./Kyte&Dodittle为标度,对苦荞FtC4H编码的蛋白质进行分析,以氨基酸标度为纵坐标,氨基酸序列为横坐标,亲水性越强,则分值越小。FtC4H最高分值2.489出现在多肽链中的第381、382、383位氨基酸,该3个位点氨基酸疏水性最强;最低分值-2.656出现在多肽链中的第124位氨基酸,该位点氨基酸亲水性最强。FtC4H整条多肽链中分值在阈值0.5以上的氨基酸位点共26个,其中苏氨酸(Thr)8个、酪氨酸(Tyr)6个、丝氨酸(Ser)12个。
2.2.3 跨膜结构域的预测分析及信号肽预测 跨膜区连接胞内和胞外的部分,主要功能为固定蛋白,部分还有介导信号传递的作用[23]。对于能够在细胞膜或质膜上发挥作用的蛋白质,通过了解多肽链中疏水氨基酸区的数目和位置,可以知道蛋白质的穿膜情况[23]。TMHMM Seruer v.2.0结果图显示,FtC4H不具有跨膜结构域。通过SignalP 5.0 Server在线软件对蛋白的信号肽进行预测,结果显示FtC4H不具有信号肽,属于非分泌蛋白。
2.2.4 蛋白质二级结构及三级结构的预测和分析
通过对蛋白质的二级结构进行在线预测(图4),发现 FtC4H具有丰富的二级结构,无规则卷曲占32.64%,α-螺旋占47.69%,β-折叠占5.55%,延伸链占14.12%。利用SWISS-MODEL对蛋白质的三级结构进行预测(图5),其与数据库目标蛋白6vby.1.A的序列相似度为 77.46%,QMEAN值是-1.00,GMQE值是0.91,表明建模可信度高。

图4 苦荞FtC4H蛋白质二级结构预测Fig.4 Secondary structure prediction of FtC4H protein in tartary buckwheat
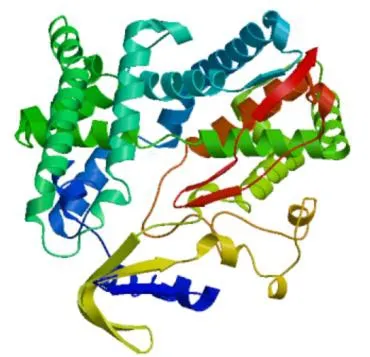
图5 苦荞FtC4H蛋白质三级结构预测Fig.5 Tertiary structure prediction of FtC4H protein in tartary buckwheat
2.2.5 氨基酸结构及系统进化树分析 与已报道的苦荞C4H基因进行多重序列比对(图6),发现克隆到的基因与已报道的不同(黑色核苷酸全部相同为相同)。与已报道的苦荞C4H氨基酸序列进行多重序列比对,发现本研究克隆序列与已克隆序列相似度为 79.17%,且包含血红素结合域保守区“FGVGRRSCPG”(图7)。采用NCBI中的blastp在线程序,查找FtC4H的同源氨基酸序列,比对发现苦荞的FtC4H与蓖麻(Ricinus communis L.)、莫洛海芽(Corchorus olitorius L.)、茶[Camellia sinensis(L.) O. Ktze.]、莲(Nelumbo nucifera Gaertn.)、黄麻(Corchorus capsularis L.)和雷公藤(Tripterygium wilfordii Hook. f.)的C4H氨基酸序列相似性较高,分别为83.80%、83.33%、83.33%、83.29%、83.10%和83.06%。

图6 FtC4H与已克隆苦荞C4H基因的多序列比对Fig.6 Multiple sequence alignment of FtC4H with C4H genes cloned from tartary buckwheat
运用 MEGA 6.0软件,将本研究克隆的苦荞FtC4H与其他已克隆的苦荞C4H蛋白及其他植物的 C4H蛋白序列采用邻接法构建系统进化树,结果(图8)发现,本研究克隆的苦荞FtC4H单独聚为一支,其余4条苦荞FtC4H聚为一小簇,并与莲、蓖麻等6种植物C4H蛋白聚为一大簇,可见本研究克隆的苦荞 FtC4H与其他已克隆的苦荞FtC4H有差异,可能是1个新基因(图7)。

图7 FtC4H与已克隆苦荞C4H蛋白的多序列比对Fig.7 Multiple sequence alignment of FtC4H with C4H proteins cloned from tartary buckwheat

图8 FtC4H与其他植物来源C4H基于蛋白质序列的系统进化树Fig.8 Phylogenetic trees based on protein sequences of FtC4H and other plant sources C4H
2.2.6 FtC4H基因相对定量分析 用qRT-PCR分析FtC4H在云荞1号和小米荞不同部位的表达水平,结果(图9)发现,FtC4H的相对表达量在不同苦荞的不同部位表达不同,其中在种子中表达最高,且远远高于其他部位。FtC4H在小米荞的叶中相对表达量极显著高于云荞1号,小米荞叶中的表达量是云荞1号中的9倍多;在花中相对表达量差异显著,在小米荞中的表达量约是云荞1号中的2倍。FtC4H在种子中表达量高的原因可能是取样时间处于结实期,是种子快速生长期和黄酮类物质合成期,C4H基因较活跃。
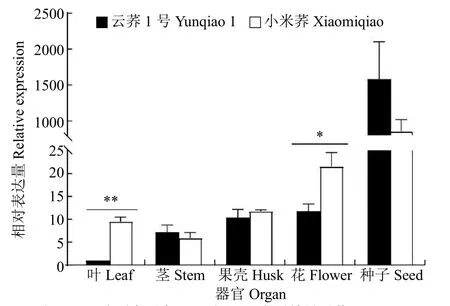
图9 FtC4H基因在苦荞不同器官的相对表达量Fig.9 Relative expression of FtC4H gene in different organs of tartary buckwheat
3 讨论
黄酮类化合物作为苦荞重要的基础药效物质之一,具有显著的药理活性,C4H作为苯丙素类化合物生物合成途径中的关键调节酶,在植物细胞中的表达量可以影响木质素和黄酮类物质合成等多条代谢支路[24]。C4H作为细胞色素 P450超家族(CYP73)的成员之一,包含C4H/CYP73A5的5个保守特征性底物结合位点基序(SRS)及细胞色素 P450保守域[25]。本研究克隆了苦荞 FtC4H基因,序列比对发现从云荞 1号和小米荞中克隆的FtC4H序列完全相同,但是不同于已报道的苦荞FtC4H基因。陈鸿翰等[21]的克隆材料为西荞2号苦荞(AFU54390);刘荣华等[22]的克隆材料为黑丰1号苦荞(AUT31007.1、AUT77170.1),推测C4H基因在云荞1号和小米荞中的功能相似,而不同于黑丰1号和西荞2号苦荞的C4H功能。经氨基酸多重比对发现,本研究克隆的FtC4H的SRS2基序与其他已报道的苦荞C4H氨基酸相比有1个氨基酸的改变(A-S);SRS5基序中亦发现1个氨基酸改变(G-P);SRS1基序中FtC4H与AUT77170.1相比有D-G这1个氨基酸的改变,与AFU54390.1相比有R-Q这1个氨基酸的改变;在SRS3基序中,与 AEF30417.1相比有 A-T这个氨基酸的改变;SRS4基序及血红素结合域无氨基酸改变。本研究克隆的FtC4H亚细胞定位于细胞质。而陈鸿翰等[21]及刘荣华等[22]克隆的 FtC4H亚细胞均定位于内质网外膜,推测是由于本研究克隆的FtC4H不含有富含脯氨酸的铰链结构 P34PGPIPVP41,该结构对FtC4H形成正确的折叠和锚定于内质网外膜具有重要意义。系统进化树结果表明,FtC4H单独为一支,与苦荞其他C4H的亲缘关系较远。可以进一步为FtC4H与已发表的苦荞C4H基因功能有区别的推测提供论据。
在番茄中同源正义超表达 C4H基因降低了番茄茎中木质素的含量,却增加了番茄果实中黄酮类化合物的含量[16]。Yan等[26]在烟草植株中过表达大豆GmC4H基因,结果烟草的木质素积累增加,并且对寄生疫霉以及黄萎病的抗性增强。冯艺川等[27]的研究首次明确了膜荚黄芪的毛蕊异黄酮及其糖苷化合物的生物合成可能直接受到 AmC4H2基因的调控作用。qRT-PCR表明FtC4H在小米荞的花和叶中相对表达量显著高于云荞1号。在果壳和茎部也有表达,由此推测FtC4H可能参与了多种物质(黄酮、木质素)的生物合成,具体功能有待进一步挖掘。
4 结论
从云荞1号和小米荞中克隆得到了FtC4H基因,通过分析发现与前人已克隆的苦荞 C4H基因不同,且其表达具有组织特异性。该结果丰富了C4H基因资源,也为探讨苦荞苯丙烷类次生代谢途径奠定了一定的基础。

