磁性茶渣炭的简易制备及其活化过硫酸盐降解罗丹明B的性能
吴永娟,马青春,刘 博
磁性茶渣炭的简易制备及其活化过硫酸盐降解罗丹明B的性能
吴永娟1,马青春1,刘 博2
(1. 陕西学前师范学院化学化工学院,西安 070100;2. 西安科技大学安全学院消防工程系,西安 710054)
以硫酸亚铁(FeSO4·7H2O)和红茶渣为原料,采用限氧高温热解技术制备了系列磁性生物炭(Fe-BC0.72、Fe-BC0.55、Fe-BC0.25)并将其用于活化过二硫酸盐(PS)降解罗丹明B(Rh B))。考察了Fe3O4(Fe)与生物炭(BC)的质量比、Fe-BC投加量、过硫酸钾用量、溶液pH、温度等参数对BC-Fe活化PS降解Rh B效果的影响。结果表明,当Fe3O4与生物炭(BC)的质量比为0.55、Fe-BC用量为0.021 3 g、PS用量为0.030 2 g,pH为5、反应温度为30 ℃时Fe-BC0.55对RhB (40 mg·L-1)的降解效果最佳,反应90 min时的降解率为98.8%。将Fe-BC0.55磁性分离、循环使用5次,对RhB的降解率为75%。
磁性生物炭;高温热解;过硫酸盐;罗丹明B
罗丹明B是一种人工合成三苯甲烷类红色碱性荧光染料,该染料广泛应用于纺织印染业、造纸业、矿业、烟花爆竹和钢铁等行业[1]。其结构中因含有苯环且为刚性高共轭体系,故很难采用生物方法将其降解[2]。
目前,高级氧化技术(AOPs)[3-8]和吸附法[9-11]是从废水中去除该类染料的主要方法。其中,非均相类芬顿方法是高级氧化技术中的重要方法之一。通常,人们利用各种催化剂(天然矿物、粘土和碳质材料等)和不同的氧化剂如过氧化氢(H2O2)[11-13]或过硫酸盐(S2O82−)[14-16]构建“类芬顿”体系。
近年来,S2O82−-AOP由于S2O82−(E0= 2.5–3.1 V)比H2O2具有更强的氧化性而引起人们的广泛关注。S2O82−-AOP的关键是寻找一种高效、经济的催化剂活化过硫酸盐产生SO4−·。
生物炭(BC)是生物废料(如农作秸秆、果壳、粪便、水生藻类等)在限氧、密闭条件下经过高温(<700 ℃)得到的多孔隙富碳材料[17]。它在农业、环境科学领域中的有着广泛的应用[18-19]。BC是一种很难与水系统中分离出来的精细粉末,将其赋予磁性制备成磁性生物炭(MBC)可以利用外加磁场将其与污染物分离,从而提高BC的循环使用性能[20]。将BC磁性化常用的材料有铁、钴[21-22]或镍[23]。其中,铁是最广泛地用于磁化炭材料的基体。常见的铁质磁性粒子有Fe0、γ-Fe2O3、Fe3O4等。其中,4氧化三铁是广泛用于磁性炭材料的基体,能催化分解过硫酸盐产生硫酸自由基、羟基等,可以降解废水中生物难降解有机污染物[24]。将四氧化三铁纳米颗粒与生物炭相结合构建复合材料具有广泛的应用前景。故有关磁性生物炭的研究不断增加,如人们先后合成了烟秆基[25]、波斯菊[26]、麦秸与木屑[27]磁性生物炭等。
基于以上调研,作者以“茶叶中咖啡因提取”实验回收的红茶渣为原料,利用硫酸亚铁红茶渣限氧高温热解合成了磁性生物炭(Fe-BC)。以罗丹明B(Rh B)为模拟污染物,考察了体系中Fe3O4/BC比例、过硫酸盐降解活化剂用量、过硫酸(PS)投加量、溶液pH、温度等因素对Fe-BC活化PS降解RhB的影响,并初步探讨了Fe-BC活化PS降解RhB的机理,为过硫酸盐活化高级氧化技术应用于实际环境污染治理提供理论依据和参考。
1 材料与方法
1.1 仪器与试剂
红茶渣为实验室回收的废茶渣;过二硫酸钾, 天津市科密欧化学试剂有限公司;罗丹明B,天津市福晨化学试剂厂;FeSO4·7H2O,天津市恒兴化学试剂制造有限公司。
紫外可见分光光度计, UV-8000S型, 上海元析仪器有限公司;马弗炉, DX-2700BH型X射线衍射,DX-2700BH型,中国丹东浩元仪器有限公司;振荡器,ZHWY-2012C型,上海智城有限公司;总有机碳 (TOC)分析仪,TOC–V CPH 型,日本岛津公司。
1.2 磁性茶渣炭(Fe-BC)的制备
用分析天平分别称取一定质量的FeSO4·7H2O和红茶渣,将上述试剂置于玛瑙研钵中,将二者混合并研磨成粉末,然后转至坩埚中,置于马弗炉中,在限氧条件下600℃煅烧1 h,得到产品Fe-BC。
1.3 Fe-BC中Fe3O4 (Fe)与BC质量比的测定
精确称取Fe-BC样品0.200 0 g,置于已称重的洁净离心管中,加入一定体积的浓HCl,超声反应1 h,离心分离。将离心管内黑色残留物洗涤至中性,80℃干燥、称重,记录为m g,即为BC的质量。Fe3O4(Fe)与BC的质量比例(R)的计算方法见公式(1)。这里将Fe3O4与BC不同质量比例的样品分别命名为Fe-BC0.72、Fe-BC0.55和Fe-BC0.25。
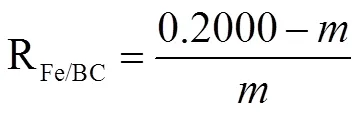
1.4 Fe-BC活化PS降解Rh B性能
配制100 mL 一定浓度的Rh B溶液,加入一定质量的Fe-BC和PS,调节至预定pH值,在一定温度下搅拌。在一定时间间隔内取样,离心、取上清液于551 nm处测定吸光度,分析其浓度变化。根据溶液中Rh B的初始质量浓度(C)和时刻(min)溶液中Rh B的剩余浓度(C)计算Rh B的降解率,具体公式见式(2)。将式(2)中的数据用准一级动力学方程进行处理。具体公式见式(3)。
降解率()=(C-C)/C(2)
ln(C/C)=-k(3)
式中,C为RhB的初始浓度;C为时刻溶液中RhB的浓度;k为表观速率常数。
1.5 催化剂的重复利用实验
每次实验后永磁铁回收催化剂,采用超纯水洗涤 3 次后,根据1.4的步骤重复实验。
1.6 分析方法
利用Rh B与其最大吸收波长(551 nm)有很好的线性相关性这一特点,采用紫外-可见分光光度法测定溶液中Rh B的浓度。采用邻二氮菲分光光度法测定体系中的铁含量。
2 结果与分析
2.1 XRD表征
图1是四氧化三铁(Fe3O4)、系列Fe-BC、相同条件下制备的BC的XRD图谱。对照标准Fe3O4的XRD图谱(JCPDF番号为97- 015-9969)可以看出,系列Fe-BC在2θ为18.4、30.0、35.5、42.9、56.8、62.7o时出现了Fe3O4的特征衍射峰,标志着磁性生物炭的形成。当Fe3O4与BC质量比由0.25增加至0.75时,Fe3O4在2= 30.0o、35.5o、62.7o等处的特征衍生峰的峰强逐渐增大,说明Fe3O4含量的增加。
BC样品在2= 22.6o(002)出现了一个对应任意取无定形碳的宽衍射峰。对照标准BC的XRD图谱,系列Fe-BC的XRD图谱中并没有出现碳的特征峰,这是由于生物炭以无定形碳的形式存在于Fe-BC复合物中。
鉴于Fe-BC0.55活化PS降解RhB的效果最佳,故这里以Fe-BC0.55为例进行了红外表征(图2)。在567 cm−1处的吸收峰归属于Fe3O4特征吸收峰[28-29]。在1 226和1 036 cm−1处的吸收峰归属于C-O-C的伸缩振动,在1 584 cm−1处的吸收峰归属于C=C 伸缩振动。在3 738.9 cm−1处的吸收峰归属于游离-OH的伸缩振动。图2 的结果表明磁性Fe-BC0.55结构中存在一定量疏水性化学键(如C-O-C、C=C)和亲水性化学键(如-OH)[30]。
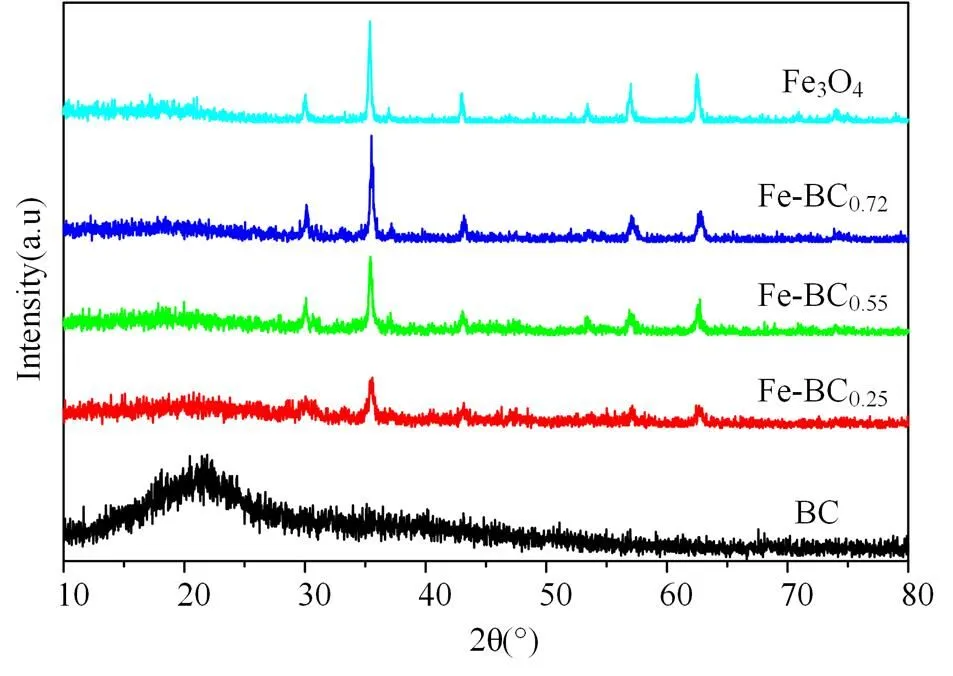
图1 四氧化三铁(Fe3O4)、系列Fe-BC及BC的XRD图谱(0.25, 0.55及0.72是Fe3O4与BC的质量比)
Figure 1 XRD patterns of (a) Fe3O4, (b) series of Fe-BC and BC (0.25, 0.55 and 0.72 is the mass ration of Fe3O4and BC)
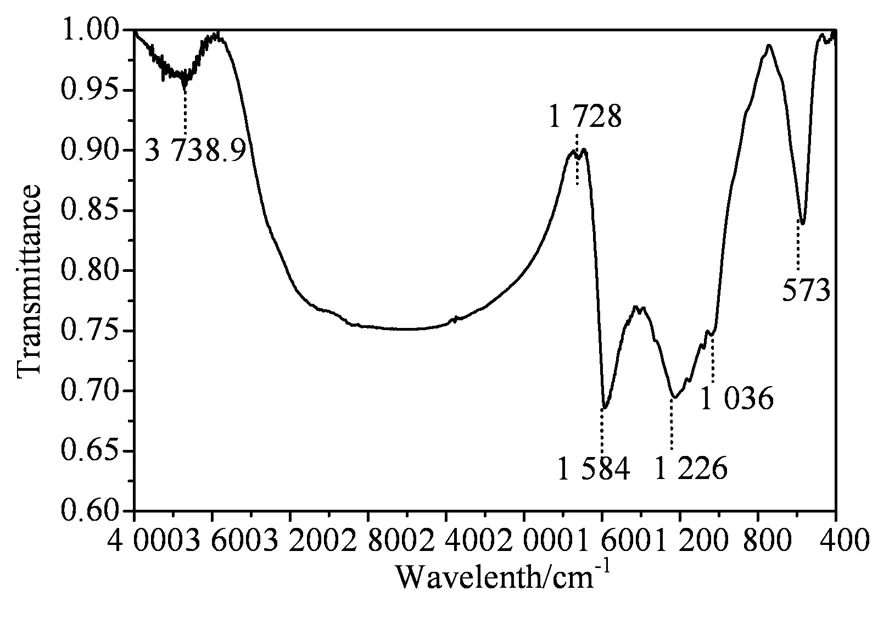
图2 Fe-BC0.55的红外光谱图
Figure 2 IR of Fe-BC0.55
2.2 不同催化体系罗丹明B的降解
为了证实BC-Fe样品中BC和Fe活化PS的协同作用,在降解RhB时设计如下对照实验,其结果见图3。由图3(a)可以看出,单独加入PS、Fe3O4和Fe-BC0.55时,对RhB的去除率分别为42.8%、26.8%和34.5%。Fe-BC0.22、Fe-BC0.55和Fe-BC0.72活化PS对RhB最终降解率分别为88.9%、100%和95%远远高于PS单独存在时对RhB的去除效果。说明Fe-BC0.55中的BC和Fe产生协同降解RhB作用。将图3(a)中的数据用一级动力方程(式3)进行处理,其结果见图3(b)。可以看出,Fe-BC3种催化剂的反应速率常数(0.024~0.011 min-1)明显高于PS(0.004 1)、BC (0.002 2 min-1)和Fe3O4(0.002 8 min-1)的反应速率常数。Fe-BC系列催化剂的催化反应速率常数顺序为Fe-BC0.55>> Fe-BC0.72> Fe-BC0.22。因此,Fe-BC0.55对PS具有最佳活化效果。
图3(c)是Fe-BC0.55/PS体系中RhB降解的UV-vis光谱随时间的变化过程。可以看出,经过2.5 h的反应后,RhB在551 nm的特征峰光谱几乎消失。总有机碳(TOC)去除效率是高级氧化过程(AOPs)中的一个重要参数,如图3(d)所示,反应180 min后,约55%的有机物完全降解为二氧化碳和水,表明Fe-BC0.55将有害有机物转化为无害的二氧化碳和水方面效率较高。因此,这里对Fe-BC0.55活化PS降解RhB过程进行了详细的研究。
2.3 实验参数对Fe-BC0.55/PS降解罗丹明的影响
2.3.1 体系初始pH值的影响 溶液的pH值是影响高级氧化技术的一个重要因素。由图4(a)可知,不同pH值条件下Fe-BC活化PS降解RhB的大小顺序为pH 5 (98.8%) > pH 4 (90.5%) >> pH6 (45.0%)≈pH7 (40.0%)。酸性条件下BC-Fe0.55活化PS降解RhB的效果明显高于近中性(pH=6、7)的降解率。说明弱酸性介质更有利于Fe-BC催化PS分解产生SO4-·。在弱酸性(pH=4或5)条件下,随着反应的进行,溶液的pH值最终下降至3.2左右(图4(b))。在中性条件下体系的pH值略有上升,这可能不同pH值时铁溶出程度和RhB矿化程度不同造成的[13]。
图4(c)是不同初始pH值条件下Fe-BC0.55催化PS降解时Fe2+的最终溶出浓度([Fe2+])的柱状图。在不同pH下Fe2+溶出浓度大小顺序为:pH5 (21.60 mg·L−1) > pH 4(19.16 mg·L−1) > pH6 (11.10 mg·L−1) ≈ pH7 (10.97 mg·L−1),与不同pH值时Fe-BC0.55活化PS对RhB的降解率大小顺序一致,即铁溶出的浓度越高,降解率越高,说明弱酸性介质中降解的过程可能存在非均相体系进行的均相催化降解过程,具体反应过程见方程(4)。
Fe2++S2O82-→Fe3++ SO4-· + SO42-(4)
2.3.2 Fe-BC用量的影响 Fe-BC作为催化剂,其投加量直接决定产生SO4-·的多少,从影响RhB降解。由5可以看出,当Fe-BC-Fe0.55用量由0.083 增加至0.25 g·L−1时,Fe-BC活化PS降解RhB达到平衡的时间迅速下降,最终降解率明显提高。当Fe-BC用量≥ 0.25 g·L−1时,达到降解平衡的时间和最终降解率无明显变化。这是由于磁性Fe-BC催化剂的过量造成催化剂本身发生明显团聚,从而相对有效催化剂的量及催化性能无明显变化。故选择Fe-BC投加量为0.25 g·L−1比较合适。
2.3.3 K2S2O8投加量的影响 由图2的实验结果可知,PS是SO42-·的来源,因此PS的加入量对降解RhB有重要的影响。由图6可以看出,当PS用量由0.17 g·L−1增加至0.25 g·L−1时,降解速率明显增加,反应80 min时,RhB降解率达到98%。但是,当PS投加量超过0.25 g·L−1时,RhB降解速率和最终降解率并无明显变化。这可能是由于随着PS用量的增大,分解产生的SO42-·会与多余的PS发生副反应而被消耗掉。可见PS不仅是SO42-· 的生成剂,同时也是它的消除剂[31],具体反应见方程(5)。故PS用量为0.25 g·L−1时对RhB降解效果最佳。
SO42-· + S2O82-+ H2O → 2SO42-+ HO2· + H+

(a)不同催化剂活化PS对RhB降解率;(b)不同催化剂活化PS降解RhB的反应动力学;(c)Fe-BC0.55 /PS降解RhB的紫外可见光谱及(d)相应TOC去除率。反应条件:[RhB] = 40 mg·L−1, [催化剂] = 0.25 g·L−1,[PS] = 0.25 g·L−1,温度=20℃,pH=5。
Figure 3 Camparision of RhB degradation by PS activiation via different catalysts
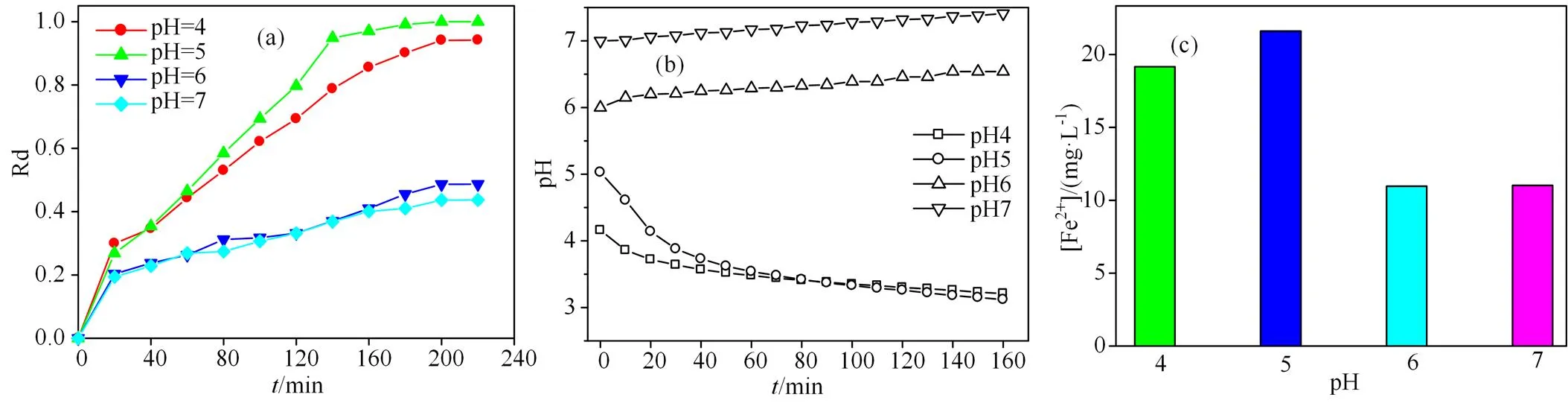
(a)体系初始pH值对Fe-BC0.55/PS降解罗丹明的影响; (b)反应过程中pH 的变化;(c)Fe2+的最终溶出浓度。反应条件:[RhB] =40 mg·L−1, [催化剂] = 0.25 g·L−1,[PS] = 0.25 g·L−1,温度=20 ℃。
Figure 4 Effect of initial pH value on various parameters during RhB degradation via Fe-BC0.55/PS
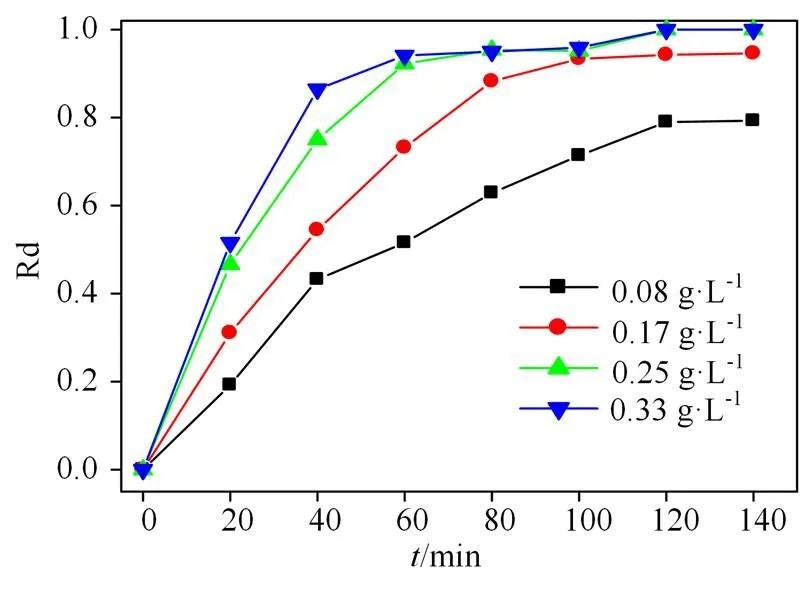
反应条件:[RhB]=40 mg·L−1,[PS]=0.25 g·L−1,温度= 20℃,pH=5。
Figure 5 Effect of Fe-BC0.55dosage
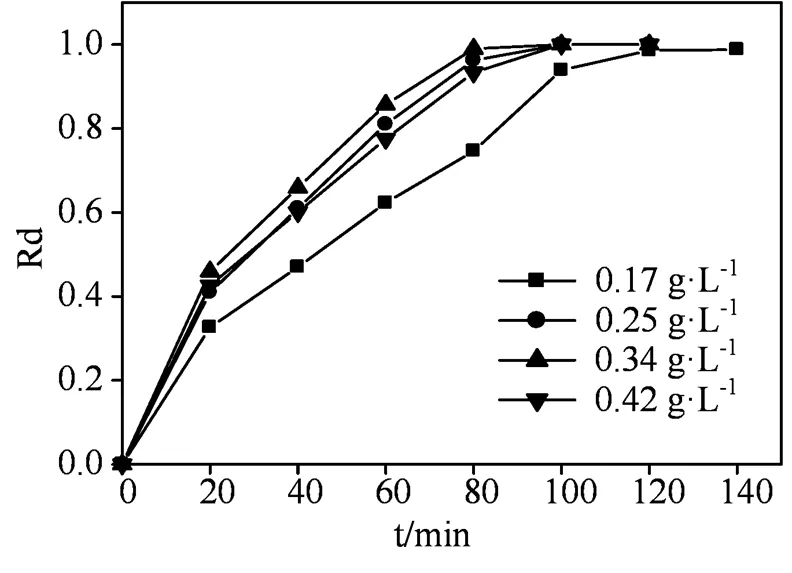
反应条件:[RhB]=40 mg·L−1,[catalyst]=0.25g·L−1,温度= 20℃,pH=5。
Figure 6 Effect of K2S2O8dosage
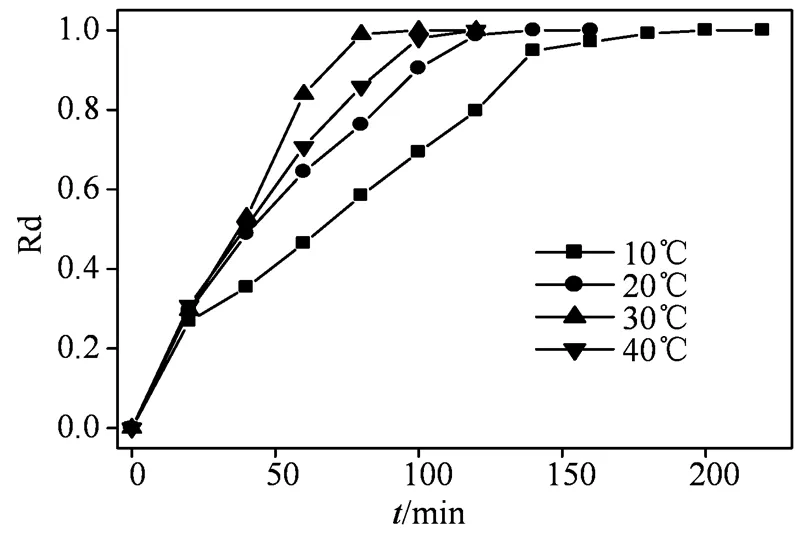
反应条件:[RhB]=40 mg·L−1,[PS]=0.25 g·L−1,温度=20℃,pH=5。
Figure 7 Effect of reaction temperature
2.3.4 反应温度的影响 反应温度是活化PS产生自由基的一个重要因素。由图7可以看出,不同温度下BC-Fe0.55活化PS降解RhB时达到平衡降解率需要的时间顺序为30 ℃(80 min) < 40 ℃(100 min) < 20 ℃ (120 min) < 10 ℃ (180 min)。因此。在反应温度为30℃时,BC-Fe54.8活化PS降解RhB效果最佳。
Figure 8 The magnetic separation of Fe-BC0.55

反应条件同图 2。
Figure 9 The reuse ability of Fe-BC0.55
2.3.5 Fe-BC0.55的循环使用实验 催化剂的再生是影响其工业化应用的重要指标。可以明显看出,BC-Fe0.55在外加磁铁的作用下,Fe-BC0.55完全被吸引至烧杯一侧,实现固液分离(图8),说明Fe-BC0.55磁性较强,容易分离回收。图9是在优化条件下对其进行循环使用的数据图。可以看出,BC-Fe0.55循环使用5次后,其活化PS对RhB的降解率基本稳定在75%左右,说明此时BC-Fe0.55的结构和催化性能趋于稳定。
3 结论
系列磁性生物炭(Fe-BC0.72、Fe-BC0.55和Fe-BC0.25)结构中的铁物种为Fe3O4。Fe-BC0.55结构中存在一定量的C-O-C、C=C和-OH等化学键。当Fe-BC0.55与PS的浓度分别为0.25 g·L−1、溶液的pH为5,反应温度为30℃时Fe-BC0.55/PS体系对RhB (40 mg·L−1)的降解效果最佳,反应时间为80 min时RhB的降解率为98.8%。将Fe-BC0.55分离回收、循环使用5次,Fe-BC0.55/PS对RhB的降解率为75%。 BC-Fe活化PS降解RhB的机制可能是Fe-BC溶出的铁协同Fe-BC0.55活化PS降解RhB。
[1] 吴明山, 马建锋, 杨淑敏, 等. 磁性生物炭复合材料研究进展[J]. 功能材料, 2016, 47(7): 7028-7033.
[2] 宋菊玲, 吴永红, 刘波, 等. 沸石吸附脱除水溶液中品红的研究[J]. 化学工程与装备, 2011(1): 30-31.
[3] 欧晓霞, 张凤杰, 王崇, 等. 芬顿氧化法处理水中酸性品红的研究[J]. 环境工程学报, 2010, 4(7): 1453-1456.
[4] PARK J H, WANG J J, TAFTI N, et al. Removal of Eriochrome Black T by sulfate radical generated from Fe-impregnated biochar/persulfate in Fenton-like reaction[J]. J Ind Eng Chem, 2019, 71: 201-209.
[5] PARK J H, WANG J J, XIAO R, et al. Degradation of orange G by Fenton-like reaction with Fe-impregnated biochar catalyst[J]. Bioresour Technol, 2018, 249: 368-376.
[6] WANG J L, WANG S Z. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chem Eng J, 2018, 334: 1502-1517.
[7] WANG S Z, WANG J L. Activation of peroxymonosulfate by sludge-derived biochar for the degradation of triclosan in water and wastewater[J]. Chem Eng J, 2019, 356: 350-358.
[8] WANG S Z, WANG J L. Peroxymonosulfate activation by Co9S8@ S and N co-doped biochar for sulfamethoxazole degradation[J]. Chem Eng J, 2020, 385: 123933.
[9] CHEUNG W H, SZETO Y S, MCKAY G. Enhancing the adsorption capacities of acid dyes by chitosan nano particles[J]. Bioresour Technol, 2009, 100(3): 1143-1148.
[10] KARIM A B, MOUNIR B, HACHKAR M, et al. Removal of Basic Red 46 dye from aqueous solution by adsorption onto Moroccan clay[J]. J Hazard Mater, 2009, 168(1): 304-309.
[11] BARREIRO J C, CAPELATO M D, MARTIN-NETO L, et al. Oxidative decomposition of atrazine by a Fenton-like reaction in a H2O2/ferrihydrite system[J]. Water Res, 2007, 41(1): 55-62.
[12] WANG Y, ZHAO Y C, MA Y, et al. Photo-oxidation of mordant yellow 10 in aqueous dispersions of ferrihydrite and H2O2[J]. J Mol Catal A Chem, 2010, 325(1/2): 79-83.
[13] WU Y J, CHEN R F, LIU H, et al. Photo-catalyzed p-nitrophenol degradation in aqueous dispersions of ferrihydrite and H2O2[J]. J Nanosci Nanotechnol, 2014, 14(9): 7325-7332.
[14] 肖开棒, 许伟城, 梁发文, 等. Mo源改性石墨相氮化碳(g-C3N4)活化过一硫酸盐可见光降解罗丹明B的性能研究[J]. 环境科学学报, 2021, 41(9): 3521-3534.
[15] 李江, 赵鹏龙. EDTA络合亚铁离子活化过硫酸盐降解罗丹明B[J]. 安徽化工, 2020, 46(6): 43-45.
[16] 盛寒祯, 尤宏, 柳锋, 等. 可见光驱动下氧掺杂氮化碳活化过硫酸盐降解罗丹明B[J]. 环境科学学报, 2020, 40(8): 2708-2714.
[17] 麻彬彬, 李小刚, 金阿伟, 等. 磁性多孔碳复合材料的简易合成及其吸附性能[J]. 华北理工大学学报(自然科学版), 2017, 39(3): 25-31.
[18] 李捷, 张峰, 黄菁菁, 等. 纳米四氧化三铁在茶叶农药残留检测中的应用及方法优化[J]. 福建农业学报, 2021, 36(1): 65-70.
[19] 傅晓艳, 赵委托, 杜江坤, 等. 稳定化纳米零价铁活化过硫酸盐降解罗丹明B[J]. 中国给水排水, 2020, 36(11): 57-62.
[20] WANG B, JIANG Y S, LI F Y, et al. Preparation of biochar by simultaneous carbonization, magnetization and activation for norfloxacin removal in water[J]. Bioresour Technol, 2017, 233: 159-165.
[21] YANG M T, TONG W C, LEE J, et al. CO2as a reaction medium for pyrolysis of lignin leading to magnetic cobalt-embedded biochar as an enhanced catalyst for Oxone activation[J]. J Colloid Interface Sci, 2019, 545: 16-24.
[22] YANG M T, DU Y C, TONG W C, et al. Cobalt- impregnated biochar produced from CO2-mediated pyrolysis of Co/lignin as an enhanced catalyst for activating peroxymonosulfate to degrade acetaminophen[J]. Chemosphere, 2019, 226: 924-933.
[23] MUBARAK N M, SAHU J N, ABDULLAH E C, et al . Plam oil empty fruit bunch based magnetic biochar composite comparison for synthesis by microwave-assisted and conventional heating[J]. J Anal Appl Pyrolysis, 2016, 120: 521-528.
[24] 林鑫辰, 于晓丹, 肖成龙, 等. Fe3O4@生物炭磁性材料光-类Fenton降解水中盐酸四环素[J]. 环境科学与技术, 2019, 42(5): 89-93.
[25] 余佳敏, 赵宇, 肖勇, 等. 烟秆基Fe/Mg磁性生物炭复合材料的制备、表征及吸附性能[J]. 江苏农业科学, 2019, 47(9): 257-262.
[26] 吴汉福, 田玲, 王沥荭. 磁性波斯菊生物炭制备及降解二甲酚橙性能[J]. 云南化工, 2020, 47(11): 34-36.
[27] 郭晓慧, 康康, 王雅君, 等. 麦秸与木屑热解制备磁性生物炭基材料理化性质研究[J]. 农业机械学报, 2018, 49(8): 293-300.
[28] WANG P, LO I M C. Synthesis of mesoporous magnetic γ-Fe2O3and its application to Cr(VI) removal from contaminated water[J]. Water Res, 2009, 43(15): 3727-3734.
[29] WU Y J, GENG L N, WANG X R, et al. Reductive transformation of p-nitrophenol by Fe(II) species: the effect of anionic media[J]. J Hazard Mater, 2013, 263 Pt 2: 556- 561.
[30] ORTIZ L R, TORRES E, ZALAZAR D, et al. Influence of pyrolysis temperature and bio-waste composition on biochar characteristics[J]. Renew Energy, 2020, 155: 837-847.
[31] LIN A Y C, LIN C F, CHIOU J M, et al. O3and O3/H2O2treatment of sulfonamide and macrolide antibiotics in wastewater[J]. J Hazard Mater, 2009, 171(1/2/3): 452- 458.
Facile synthesis of magnetic biochar derived from tea residue and its activation of potassium persulfate for degradation of rhodanine B
WU Yongjuan1, MA Qingchun1, LIU Bo2
(1. School of Chemistry & Chemical Engineering, Shaanxi Xueqian Normal University, Xi'an 710100;2. Fire Safety Engineering, Safe College, Xi’an University of Science and Technology, Xi’an 710054)
Series of magnetic biochar (Fe-BC0.72, Fe-BC0.55and Fe-BC0.25) were prepared by solid-phase grinding coupled with pyrolysis of ferrous sulfate and red tea residue. The effects of mass ratio of Fe3O4and BC, Fe-BC and persulfate (PS) dosages, solution pH and temperature on rhodanine B(Rh B) degradation were investigated in the system of Fe-BC and PS. The results showed that the degradation rate of Rh B was ideal as the mass ratio of Fe3O4and BC was 0.55, Fe-BC0.55dosage was 0.021 3 g and PS mass was 0.030 2 g at pH5 and the reaction temperature of 30 ℃. The degradation rate of RhB was 98.8% at the reaction time of 90 min. The degradation rate of Rh B was 75% after BC-Fe0.55was recycled for 5 times via magnetic separation.
magnetic biochar; pyrolysis; persulfate; rhodanine B
X788
A
1672-352X (2022)06-0955-06
10.13610/j.cnki.1672-352x.20230106.009
2023-01-09 09:08:44
[URL] https://kns.cnki.net/kcms/detail//34.1162.S.20230106.1206.012.html
2021-12-16
陕西省自然科学基金项目 (2016JM2018)和国家自然科学基金(51904233)共同资助。
吴永娟,博士,副研究员。E-mail:yjwu76@163.com

