产前诊断先天性膈疝的转运救治机制与临床实证分析
王莹 马立霜 刘超 魏延栋 李景娜 赵云龙 张艳霞 张悦
首都儿科研究所附属儿童医院普通(新生儿)外科,北京 100020
先天性膈疝(congenital diaphragmatic hernia,CDH)是指先天性膈肌发育不全形成缺损,腹腔脏器由此进入胸腔的一种结构性出生缺陷,其发病率为1/5 000~1/2 000,重症CDH患儿(出生后6 h内出现呼吸窘迫综合征者)病死率达70%[1-3]。自上世纪九十年代多学科临床诊疗模式在欧美国家兴起,越来越多的产科、儿外科医生通过合作提出规范、合理、个性化的诊疗方案[4]。目前国内许多大型儿科医学中心与产科医院是分离的,一部分产前诊断的CDH胎儿因没有得到专业的评估与咨询而选择引产,很多CDH患儿出生后需转运至综合实力强的儿童专科医院救治。本研究回顾性分析首都儿科研究所附属儿童医院近年来在产前诊断为CDH并接受生后转运救治的患者临床资料,分析CDH转运救治机制的运行及实践效果。
材料与方法
一、研究对象
首都儿科研究所附属儿童医院与北京市及周边地区8家产前诊断中心建立合作网,以2018年1月至2020年12月期间来本中心接受产前咨询的CDH孕妇为研究对象,共88例,其中2018年、2019年、2020年人数分别为19例、33例、36例。最终经绿色通道转运收治的产前诊断为先天性膈疝患儿63例,2018年、2019年、2020年转运收治人数分别为16例、24例、23例。
二、组织机构及相应职责
产前诊断中心:负责先天性膈疝的产前诊断及孕妇分娩,在CDH产前诊断和高危产妇分娩方面给予指导。新生儿外科疾病诊疗中心(即本中心):接受CDH家长关于治疗及预后的咨询,参加产前评估会诊,确定病情危重程度并制定诊疗方案,对分娩时间及分娩方式提出意见。产时进驻产房,协助产时抢救处理,并完成转运工作及后续手术等。
三、具体流程
合作网内医院产前发现膈疝胎儿,转诊至北京市产前诊断中心复查进一步确诊。孕妇同时就诊于本院新生儿外科门诊进行产前咨询,记录产前信息并存档。产前由新生儿外科与产科主导,协同超声影像科、遗传科组成专家小组不定期进行多学科会诊,对畸形的诊断与预后进行评估。
将文献中应用较为广泛的2项指标:产前诊断胎龄(≤25周为重度,>25周为中度,产前未发现为轻度),肝脏是否疝入(疝入为重度)作为本研究产前评估病情严重程度的标准。重度指标出现一个判定为重度,轻度指标全部满足判定为轻度,其他情况判定为中度。由于本研究中患者来自不同医疗机构,产前肺头比测量水平差异较大,多数检查报告中缺少此项描述,因此本研究未纳入肺头比作为产前评估指标。
产妇入院待产即与本院新生儿外科联系,提前做好接诊准备。生产当日新生儿外科专业医生、护士进入产房,联合产院儿科、产科,组成产时抢救小组,按产前拟定的生产方式、抢救预案进行准备。在部分有条件的产院,产前评估为重度CDH的患儿可在分娩的同时行子宫外产时治疗(EX-utero intrapartum treatment,EXIT),即患儿娩出后于断脐前完成气管插管,避免因紧急插管导致低氧血症和酸中毒。然后通过绿色通道紧急转运至我院新生儿外科监护病房。转运途中使用转运呼吸机支持,移动暖箱保温,持续胃肠减压,间断清理气道分泌物,监测心率及导管前经皮血氧饱和度。
四、手术指征及围术期管理
待患儿呼吸、循环状态相对稳定,达到手术指征时可行手术治疗。围术期管理:①监测生命体征,注意导管前后经皮氧饱和度及差异;②常频或高频模式呼吸机辅助通气;③持续胃肠减压;④胸部正位X线片、心脏超声检查监测肺动脉高压情况及评估有无心脏结构异常;⑤恰当的液体管理及血管活性药物使用,包括一氧化氮或西地那非、曲前列尼尔等,必要时选择不同种类药物适当组合使用。
结 果
63例经绿色通道转运收治的产前诊断为先天性膈疝患儿中,男41例,女22例;足月儿52例,早产儿11例(中位出生胎龄34周);出生体重(2 978.73±607.69)g;产时气管插管22例(34.9%),产房内高频呼吸机使用22例(34.9%)。9例二氧化碳分压大于70 mmHg,54例小于70 mmHg者。产前评估为重度CDH 31例(产前诊断胎龄小于25周不伴有肝疝入16例,产前诊断胎龄大于25周合并肝脏疝入6例,产前诊断胎龄小于25周合并肝脏疝入9例);评估为中度CDH 32例。产前诊断孕周(27.69±5.33)周。左侧膈疝53例,右侧膈疝10例。肝脏疝入共15例。转运相关因素与预后的关系见表1。
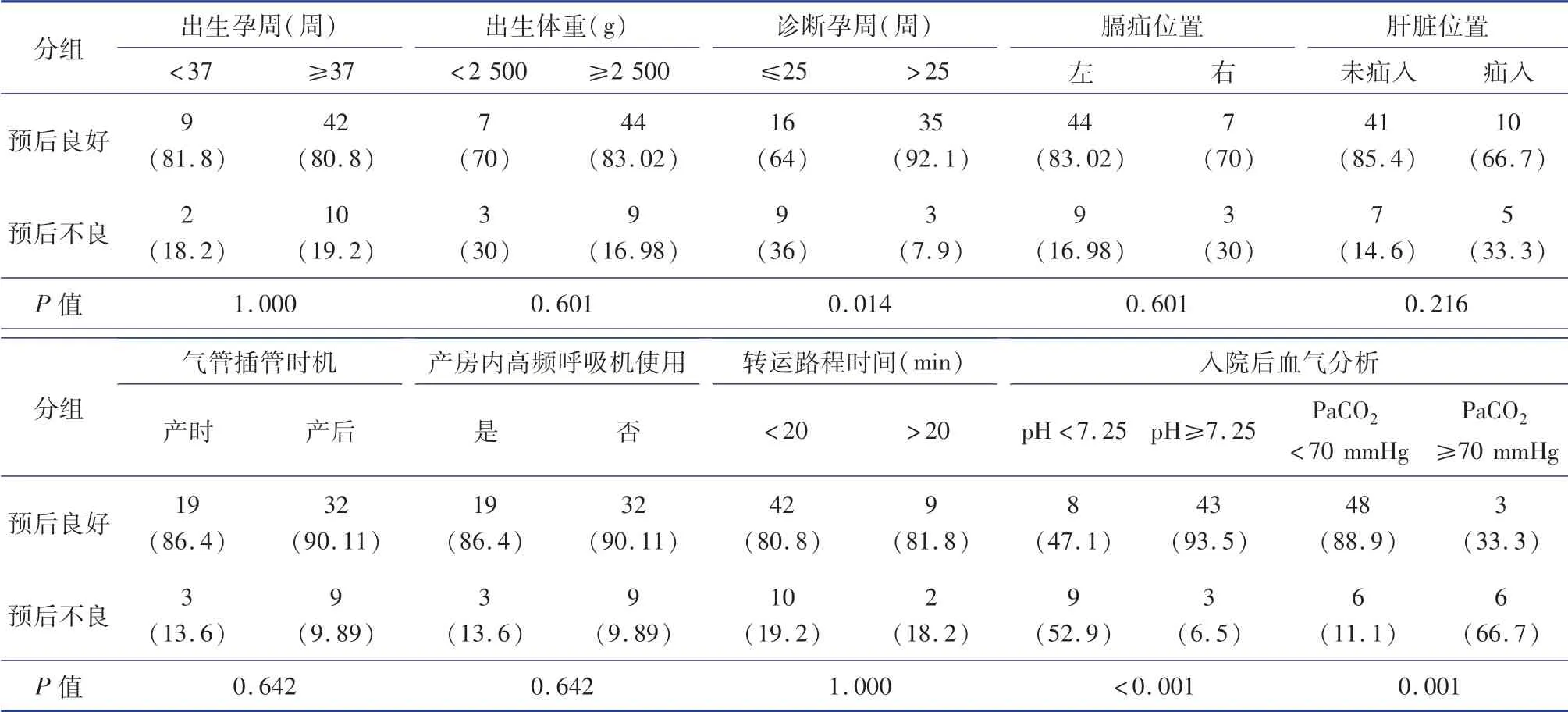
表1 转运相关因素与预后的关系[n(%)]Table 1 Analysis of prognostic factors in children with prenatal diagnosis of CDH[n(%)]
63例中,58例行手术治疗,5例产前评估提示极重度膈疝,出生后虽经全面抢救无法改变呼吸循环衰竭状态而死亡。开放手术8例(13.8%),腔镜手术50例(86.2%);无疝囊35例,有疝囊23例;术中发现B级缺损20例(34.5%),C级和D级缺损共38例(65.5%)。使用补片修补膈肌者占10.3%(6/58)。术后存活率为87.9%(51/58);2例术后放弃治疗,6例死亡,其中3例死于术后持续肺动脉高压,2例死于合并先天肾功能衰竭。2018—2020年产前诊断为膈疝患儿的治疗结果见表2。
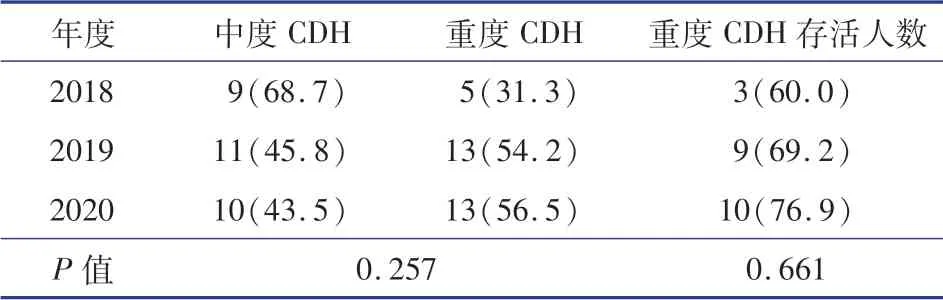
表2 2018—2020年产前诊断为膈疝患儿的治疗结果[n(%)]Table 2 Treatment results of patients with diaphragmatic hernia diagnosed prenatally from 2018 to 2020[n(%)]
讨 论
随着先天畸形产前诊断水平的提高,多数CDH可获得产前诊断。由于CDH围术期、围生期死亡风险高,需要以新生儿外科和产科为主导,在产前与影像科、遗传科等多学科团队共同协作,对畸形的诊断与预后进行评估,制定出个性化诊疗方案。2010年欧洲CDH联盟提出CDH标准化诊疗管理模式,联合多中心、多学科开展CDH产前-产时-产后多学科综合诊疗模式[5]。Lazar等[6]研究发现,多学科联合诊疗模式可降低产前诊断为CDH患儿生后肺损伤发生率,从而改善CDH患儿预后。
目前国内外绝大多数儿童医学中心与产科医院分离,危重新生儿救治过程中转运工作非常重要。国内尚无关于CDH转运救治管理及其对结局影响的相关研究,国外文献亦不多。Sarah等[7]描述了加州危重新生儿转运模式,指出先天性结构异常或有外科手术需求约占所有转运需求的25%。Katarina等[8]研究发现当地新生儿CDH转运时,如路途遥远,则更倾向于选择CDH病情较轻者进行转运,而生命体征严重紊乱的CDH未获得转运救治。此外,国内各级医院诊疗水平参差不齐,产科、儿科对CDH产前诊断、咨询、评估的沟通不畅现象普遍存在。因此,综合治疗能力强的产科、儿科紧密联合,共同救治产前诊断重症CDH患儿,更加适合我国国情需要。本中心2017年底开展并完善CDH产前评估、绿色通道转运及微创治疗联合的一体化诊疗方案,建立网格化管理,确诊病例宫内转诊至产前诊断中心,进行多学科联合诊断评估,监测病情直至分娩。新生儿外科医生进驻产房或手术室参与产时处理,同时负责转运、围术期管理及手术治疗。
有研究表明,出生后第1个小时的新生儿管理对所有新生儿的即刻和长期结局具有重要影响[9]。在这一黄金处理时段需要采取许多干预措施,使新生儿并发症的发生率降至最低[10]。CDH患儿出生后第1个小时往往处于产房-转运途中或刚刚进入监护室,这一时段的处理要求安全且流畅。
一、有效的产前咨询与评估
CDH转运救治机制第一步是产、儿联合进行产前诊断和产前咨询。有效的产前咨询应包括风险评估、对风险的沟通以及持续的支持,其目的是在产前对孕妇及患儿病情和预后做出尽可能准确的判断,对可能发生的各种风险及应对措施做出预案,制定出个性化诊疗方案[11]。本研究显示,孕25周以后诊断的膈疝患儿存活率明显高于孕25周前诊断的患儿。随着产前诊断孕周的增加,CDH患儿存活率逐步上升。产前超声检查可以发现肝脏是否疝入胸腔,膈疝患儿如出现肝脏疝入,往往提示严重肺发育不良,预后欠佳[12]。本组患儿产前超声提示,无肝脏疝入CDH患儿的治愈率高于肝脏疝入者(84%vs.66%),符合这一观点。本组病例中部分孕妇转诊至产前诊断中心时为孕晚期,错过LHR等指标测量的最佳时机,因而产前诊断CDH患儿宫内转运流程仍需进一步疏通,完善网格化管理模式。
二、产房内清单式管理模式
分娩及转运前对所有可能需要的抢救器械、药品、检测仪器、监测设备以及护理用品进行清单式管理是非常有效的。不仅需要保障所需物品的数量,还应保障仪器设备的正常运行[11]。如果产前评估为重度CDH,可能需要子宫外产时治疗,应在断脐前完成气管插管,因此还应进一步明确产房布局、新生儿转移路线(产床或手术台-产时插管操作台-开放辐射抢救台-移动密闭暖箱),有条件的产儿团队可以在分娩前实地演习。因为EXIT产房将比平时更拥挤,配有专业设备和来自多个医疗专业的工作人员,协调手术场地周围人员和设备运转的顺序对于避免并发症至关重要[13]。本研究中22例患儿完成产时气管插管,过程顺利流畅,患儿在产房内转移交接过程中均未出现路线受阻、脱管、经皮血氧饱和度下降等情况。最初几例在产前经过产儿团队多次讨论,制定方案,并进行实地演练。本组数据显示产时EXIT以及产房内使用高频呼吸机的患儿,在存活率上并没有明显优势,考虑产前评估膈疝危重程度可能存在偏差。
三、产房内工作职责
分娩时产房内由新生儿外科、新生儿内科、麻醉科共同组成产时抢救小组。分娩前每一位小组成员都应明确自己的任务,减少在复苏期间交叉混淆,避免有效的干预措施被延迟或者遗漏[14]。如果是双胎,尤其是早产儿,分娩前务必确认患儿身份,明确参加抢救的医护人员数量及职责,避免抢救小组注意力全部集中在CDH患儿身上,而忽略其他新生儿。在CDH患儿复苏过程中,应尽可能避免气囊加压和面罩通气,完成气管插管后通过呼气/呼气末CO2检测是确认气管导管放置成功的最可靠方法[15]。
四、转运途中注意事项
转运环节工作由新生儿外科医生、护士共同完成。移动密闭暖箱应提前加温预热,从而保证患儿转运途中体温正常。有文献表明,新生儿进入重症监护病房时体温每降低1℃,死亡率增加28%[16]。CDH转运途中予呼吸支持同样需要遵循保护性通气原则,即保持可接受范围内的低氧血症及高碳酸血症。由于目前尚无移动高频呼吸机,部分重症CDH可能出现二氧化碳弥散障碍,随着转运途中时间延长,呼吸性酸中毒可能加重。尽管我院转运数据显示死亡率与转运途中花费时间无明显关系,符合Katarina的报道,但我们仍认为随着转运时间的增加,转运途中的高风险因素逐渐增加[8]。通过分析入院时第一份动脉血气分析结果,我们发现pH小于7.25、二氧化碳分压大于70 mmHg的患儿死亡率明显升高。我们认为,二氧化碳分压相对于氧饱和度可更好提示病情严重程度。此外,转运途中血糖、血压的监测和适当的镇静同样重要。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为王莹、刘超、李景娜,论文调查设计为王莹、马立霜,数据收集与分析为王莹、马立霜、刘超、魏延栋、李景娜、赵云龙,论文结果撰写为王莹,论文讨论分析为王莹、马立霜

