完全肿瘤细胞减灭术加全盆腔切除加腹腔热灌注化疗在腹膜癌合并盆腔肿瘤中的应用
Pedro Barrios Oriol Crusellas Montse Martín Isabel Ramos
肿瘤细胞减灭术(cytoreductive surgery,CRS)+腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)治疗腹膜癌疗效显著,已获得肿瘤学界认可[1]。随着手术经验的积累、手术方案的完善和腹膜癌专业中心的支持,CRS+HIPEC 相关病发症率和死亡率降低[2],促进了其在腹膜癌中的应用。
CRS+HIPEC 疗效直接取决于CRS 质量,即肿瘤细胞减灭程度(completeness of cytoreduction,CC)。目前认为,清除肉眼可见肿瘤,达到CC 0,可实现最佳疗效[3]。1995年,Paul H. Sugarbaker 等[4]报道了腹膜切除术和多脏器联合切除术,使CC 0 切除成为可能。
盆腔切除术在局部晚期结直肠癌、泌尿系肿瘤、女性生殖系统肿瘤及盆腔肉瘤的治疗过程中发挥了重要作用。部分腹膜癌患者合并晚期盆腔肿瘤,CRS+全盆腔切除术(total pelvic exenteraction,TPE)+HIPEC整合治疗策略,是目前唯一可能的治愈疗法。
目前,后盆腔切除术作为盆腔腹膜切除的一部分,已得到广泛应用。而其他盆腔切除方式,如TPE,临床应用受限,原因:腹膜癌病人体弱且预后不确定;操作复杂、风险大,病发症率高、死亡率高,对生活质量影响大。因此,严格病例筛选,组建专业外科团队,建立专业腹膜癌中心是非常必要的。
本研究总结本中心CRS+EPT+HIPEC 经验,描述CRS+EPT+HIPEC 且无造瘘手术策略和技术改进,重点阐述安全性和优化功能重建,并强调了专业手术团队和专业中心,对促进手术标准化和整体治疗方案规范化的重要意义。
1 材料与方法
1.1 临床资料
研究对象均来源于加泰罗尼亚腹膜癌前瞻性数据库。选取2006年9月至2021年1月经CRS+HIPEC治疗的腹膜癌患者1 172 例,累计接受CRS+HIPEC治疗1 314 例次,女性占63.6%,男性占36.4%,平均年龄为57(18~83)岁。1 314 例次CRS+HIPEC 术中,14 例行TPE,且功能重建未行消化道造瘘和尿量改道。纳入标准:1)患者符合CRS+HIPEC 适应证。2)手术团队根据影像学、手术探查结果,评估肿瘤生物学行为、治疗风险和身体状态,决定是否联合TPE。可行CRS+HIPEC 标准:1)ECOG 评分0~1 分;2)年龄≤75岁;3)主要脏器功能无手术禁忌;4)无其他活动期恶性肿瘤。
1.2 方法
1.2.1 术前护理方案 术前护理方案包括:营养评估,机械性肠道准备,血栓预防等。术前常规预防性使用抗生素,有吻合患者,连续应用3 天。所有患者均行持续胃肠减压和肠外营养,直到恢复进食。
1.2.2 CRS+TPE+HIPEC 手术技术 所有手术操作均由同一腹膜肿瘤手术团队完成,无其他外科专家参与。HIPEC 在吻合完成后进行,温度为42.5 °C,时长为30、60 或90 min,模式为开放式,化疗药物根据肿瘤病理选择。采用国际直肠癌外科研究组(ISGRCS)系统定义和评价吻合口病发症[5]。
1.2.3 CRS:全腹膜切除术+联合脏器切除术 腹膜切除术是指切除肉眼可见肿瘤侵犯的腹膜区域,局限/孤立的肿瘤结节可以电外科设备电灼气化灭活。脏层腹膜受侵则行受侵脏器联合切除,涉及脏器包括:胃、小肠、结肠、直肠、膀胱等。腹膜切除术采用电刀操作,以减少出血并清除瘤床的活性肿瘤细胞。
1.2.4 根治性盆腔手术:盆腔切除术 部分腹膜癌患者合并晚期盆腔肿瘤,并常累及多个盆腔区域,盆腔切除术是唯一根治性治疗策略。全盆腔切除术需切除小骨盆内的所有脏器:男性包括直肠、膀胱和前列腺,女性包括直肠、子宫、和膀胱。通常为肛提肌上盆腔切除,当肿瘤侵犯尿道、阴道远端1/3 或肛管时,联合肛提肌下盆腔部分切除。
肛提肌上全盆腔切除术遵循肿瘤学整块切除原则,由筋膜外入路,向心性分离,整块切除盆腔肿瘤及周围脏器和结构。
1.2.5 改良结直肠端端机械吻合技术 本中心改良了传统结直肠机械吻合术,实现完全端端吻合,无需预防性造口,结直肠吻合口漏发生率仅为0.85%。
改良技术如下:1)充分游离直肠。直肠后方游离时,沿骶前筋膜至肛尾韧带,打开肛尾韧带,游离直肠远端1/3,至耻骨直肠肌水平。2)直肠残端准备。裸化直肠残端,显露肠壁,距离约距缝合钉线1.5 cm(图1A)。3)直肠断端缝合钉线处理。点状缝合直肠断端的缝合钉线两侧端,收紧缝线,使缝合钉形成环绕吻合器穿刺杆的环。穿刺杆自缝合钉环中央穿出直肠壁,调整缝合钉环,并在穿刺杆上打结,使其完整进入吻合装置内(图1B)。4)环形机械吻合术。闭合吻合装置前,避免过度推挤残端组织,使直肠残端,包含缝合钉线环,松弛的进入吻合装置,以减少组织损伤(图1C)。5)闭合吻合装置并根据组织厚度调整钉高,以避免组织撕裂。HIPEC 后或长时间手术后,肠壁水肿增厚,调整吻合钉高尤为重要。吻合完成后,退出机械吻合器,查看吻合口残端,确认完整包含直肠残端和吻合钉环。吻合口完全端端对合,无两侧“耳”,且完全在生物组织钉合,无横向缝合钉干扰。6)手工加固吻合口。浆肌层间断缝合加固吻合口整圈。如前所述,直肠残端充分游离有助于安全完成加固(图1D)。
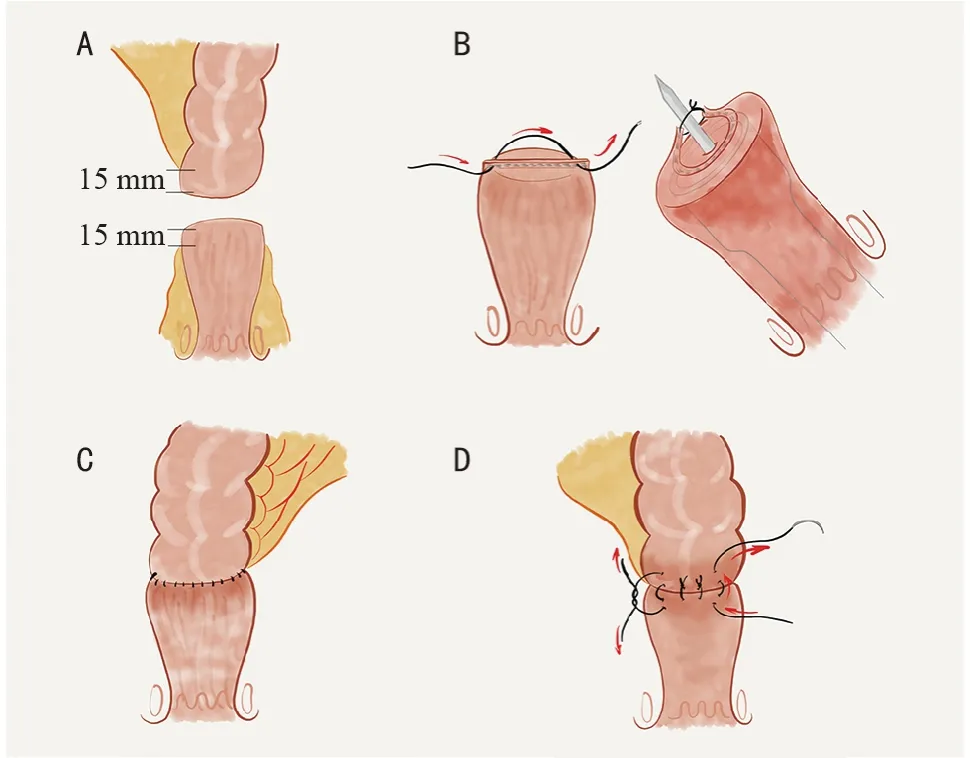
图1 改良结直肠端端机械吻合技术
1.2.6 尿路重建技术 所有患者均接受了膀胱全切除或次全切除术及相应的泌尿道重建:1)保留两侧输尿管开口的膀胱次全切除术及膀胱扩容术。输尿管或膀胱三角未受累者,可行膀胱次全切除术。膀胱重建优先采用游离小肠段、盲肠或乙状结肠进行膀胱扩容术(图2)。2)保留单侧输尿管开口的膀胱次全切除及膀胱扩容术。少数患者中,肿瘤只侵犯一侧输尿管膀胱段,可行保留健侧输尿管口的膀胱次全切除术,并在膀胱扩容术后行“Y 行”输尿管移位。3)膀胱全切除和膀胱重建术。肿瘤累及膀胱颈时,需行膀胱全切除术。根据肠管剩余情况,选用回盲部复合体或游离回肠段行膀胱重建术。在需要切除尿道内括约肌或尿道内口的患者中,通常使用回盲部复合体重建,并保留阑尾近端1/3 及其供血血管,以吻合近端尿道,改善尿失禁(图3)。
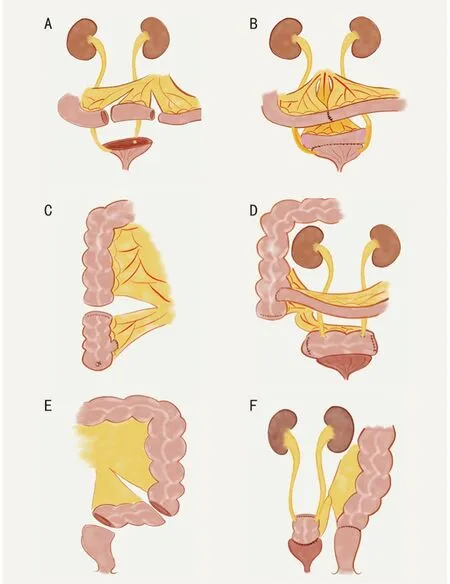
图2 膀胱次全切除和膀胱扩容术

图3 膀胱全切除和膀胱重建术
输尿管与新膀胱吻合采用回肠内植入吻合技术,可确保肠腔内输尿管远端保留1~2 cm 的长度,促进输尿管血管化,安全性好。这种输尿管残端在肠腔内游离状态,可作为一种抗反流瓣膜机制。泌尿道重建过程中,双侧输尿管均常规置入D-J 管,术后保留1 个月。
2 结果
2.1 基线数据
14 例患者中,女性9 例,男性5 例;妇科肿瘤腹膜转移5 例,结直肠癌腹膜转移6 例,小圆细胞肿瘤1 例,脐尿管来源腹膜假黏液瘤1 例。
2.2 CRS+TPE+HIPEC
14 例患者均实现了CC 0 切除,腹膜切除区域≥4 个,且包含联合腹腔脏器切除,吻合口≥2 个。肛提肌上TPE 共11 例,3 例行部分盆底切除,11 例行膀胱扩容术,采用的肠段分别为:回肠6 例,盲肠4 例,乙状结肠1 例。3 例行回盲部复合体行膀胱重建术,以阑尾近端1/3 与尿道近端吻合。
2.3 安全性
无消化道吻合口病发症。术后尿漏5 例,其中3例无需侵入性修补,1 例行肾造瘘术,1 例因膀胱过度扩张导致输尿管植入部位脱出,行二次手术修补。无术后90 天内死亡。
3 讨论
CRS+HIPEC 治疗腹膜癌安全、有效,而盆腔切除术是目前可能治愈局部晚期盆腔肿瘤的唯一策略[6]。得益于外科专科化和专病中心建设,两种治疗策略得到了良好的发展。CRS+HIPEC 和盆腔切除术都适应于局部转移癌治疗,但前提是转移灶可彻底切除。此外,术前和术后身体状态[7-8],营养不良的早期识别和治疗[9],及早期和晚期病发症管理[10]均为重要的考虑因素。
腹膜癌合并晚期盆腔肿瘤并不少见,在本中心数据中,15.3% 的腹膜癌患者需行盆腔切除术,其中1.3%行TPE,56%的患者可避免任何形式的造瘘术。尽管,临床上已相对广泛的应用后盆腔切除术联合CRS+HIPEC 治疗腹膜癌。但由于晚期肿瘤预后不确定性,且TPE 操作复杂、难度大、风险高,CRS+TPE+HIPEC 临床应用仍受限。
在适当选择的患者中,CRS+TPE+HIPEC 整合治疗是安全、有效的,具备临床可行性。然而,此类患者大多需至少一种造瘘术,严重影响了生活质量。
本中心每年由同一外科团队开展CRS+HIPEC超过120 例次,有丰富的CRS 和TPE 经验,控制吻合口漏发生率低于1%,术后60 天死亡率低于0.20%(1 314 例CRS+HIPEC 手术,3 例术后死亡)。本文报道25 例CRS+TPE+HIPEC,术中均未行消化道造瘘(2 例术前即为结肠造瘘状态,因直肠残端过短,未行还纳),14 例患者亦未行尿路改道,证明CRS+TPE+HIPEC 可在无需任何造瘘的前提下完成,极大改善此类患者生活质量。
患者选择对CRS+TPE+HIPEC 整合治疗策略至关重要。仅有治愈可能,且有治愈意愿的患者适用于该治疗策略。TPE 过程中涉及的神经和血管切除,仅限于闭孔神经和髂血管,而坐骨神经、主动脉分叉及骨受侵,或需要大规模重建骨盆缺损为该治疗策略的禁忌证。推荐术前新辅助化疗,以检测药物疗效,缩小肿瘤体积,降低手术创伤,仅对新辅助化疗有客观响应的患者适用该整合治疗。采用腹膜癌指数,评估不同来源腹膜癌完全CRS+HIPEC 及R0 盆腔肿瘤切除的可行性。
本研究聚焦CRS+TPE+HIPEC 联合应用的临床指征,首次详细描述了无需造瘘术的TPE 在切除和重建阶段的技术要点,证实了其安全性和可行性,但其短期和长期临床疗效仍需进一步研究验证。

