基础胰岛素转换德谷胰岛素利拉鲁肽注射液的病例分享
赖亚新,肖新华
1.中国医科大学附属第一医院,辽宁 沈阳 110000;2.北京协和医院,北京 100730
2 型糖尿病是一种进展性疾病,随着病程的延长,患者胰岛β 细胞逐渐衰竭,起始基础胰岛素治疗能够控制空腹血糖,并在一定程度上控制餐后血糖。起始胰岛素治疗后,随着β 细胞功能不断衰竭,对胰岛素需求增加,需进一步优化治疗方案。新型降糖药德谷胰岛素利拉鲁肽注射液(Insulin Degludec and Liraglutide Injection,IDegLira)将基础胰岛素(德谷胰岛素)与胰高血糖素样肽-1 受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA)(利拉鲁肽)两种药物联合,增强降糖效果。现回顾中国医科大学附属第一医院的4 例因基础胰岛素和(或)口服降糖药控制不佳转换为 IDegLira的门诊病例,梳理患者的治疗过程,旨在为优化此类患者的治疗提供参考。
1 病例特点
1.1 一般资料
本组4 位患者均为成人2 型糖尿病(type 2 diabetes mellitus,T2DM)患者(诊断标准参见1999年WHO 标准),年龄均在40 岁以上,病程5~25年。患者因基础胰岛素和(或)口服降糖药物治疗血糖控制不佳[糖化血红蛋白(glycated hemoglobin A1c,HbA1c)>8%]来中国医科大学附属第一医院内分泌科门诊就诊。患者性别、病程、用药情况、个人史、既往史和家族史等资料,详见表1,病例特点见表2。4 位患者既往均无低血糖发作史。
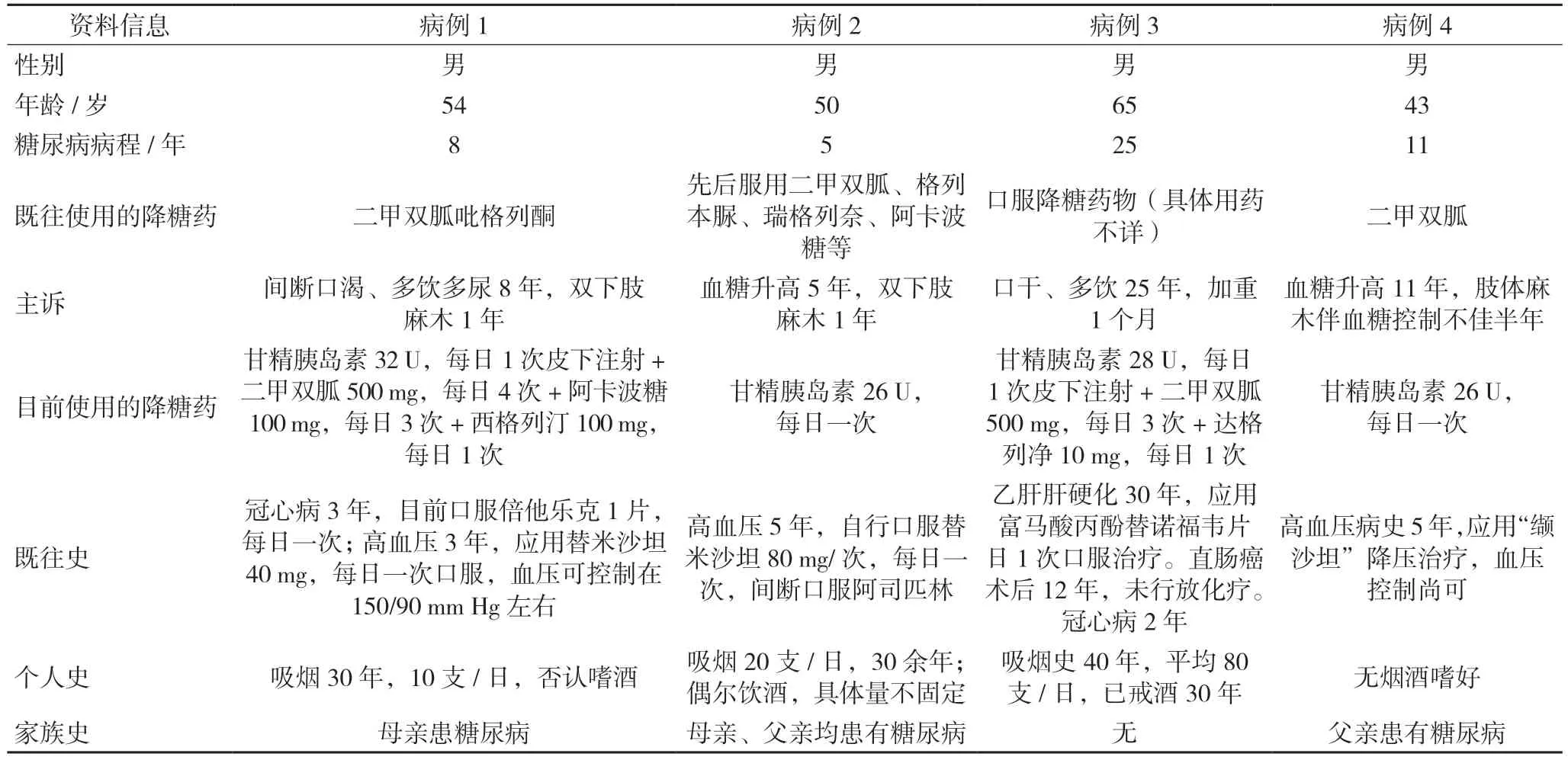
表1 4例T2DM患者一般资料

表2 4例T2DM患者特点分析
1.2 实验室检查及辅助检查
4 例患者均评估了体重指数(body mass index,BMI),HbA1c,空腹血糖(fasting plasma glucose,FPG),餐后血糖(postprandial plasma glucose,PPG)等,以及其他实验室检查,详见表3。此外,病例1 颅脑CT 提示,脑内多发缺血灶、腔梗灶。脑白质疏松。病例2 内脏脂肪面积:104 cm2。病例3 甲状腺超声提示,甲状腺内见多个低及混合回声。病例4 腹部超声提示,脂肪肝,肝右叶偏低回声,考虑脂肪肝脂肪分布不均;内脏脂肪106 cm2,腹部皮下脂肪180 cm2。
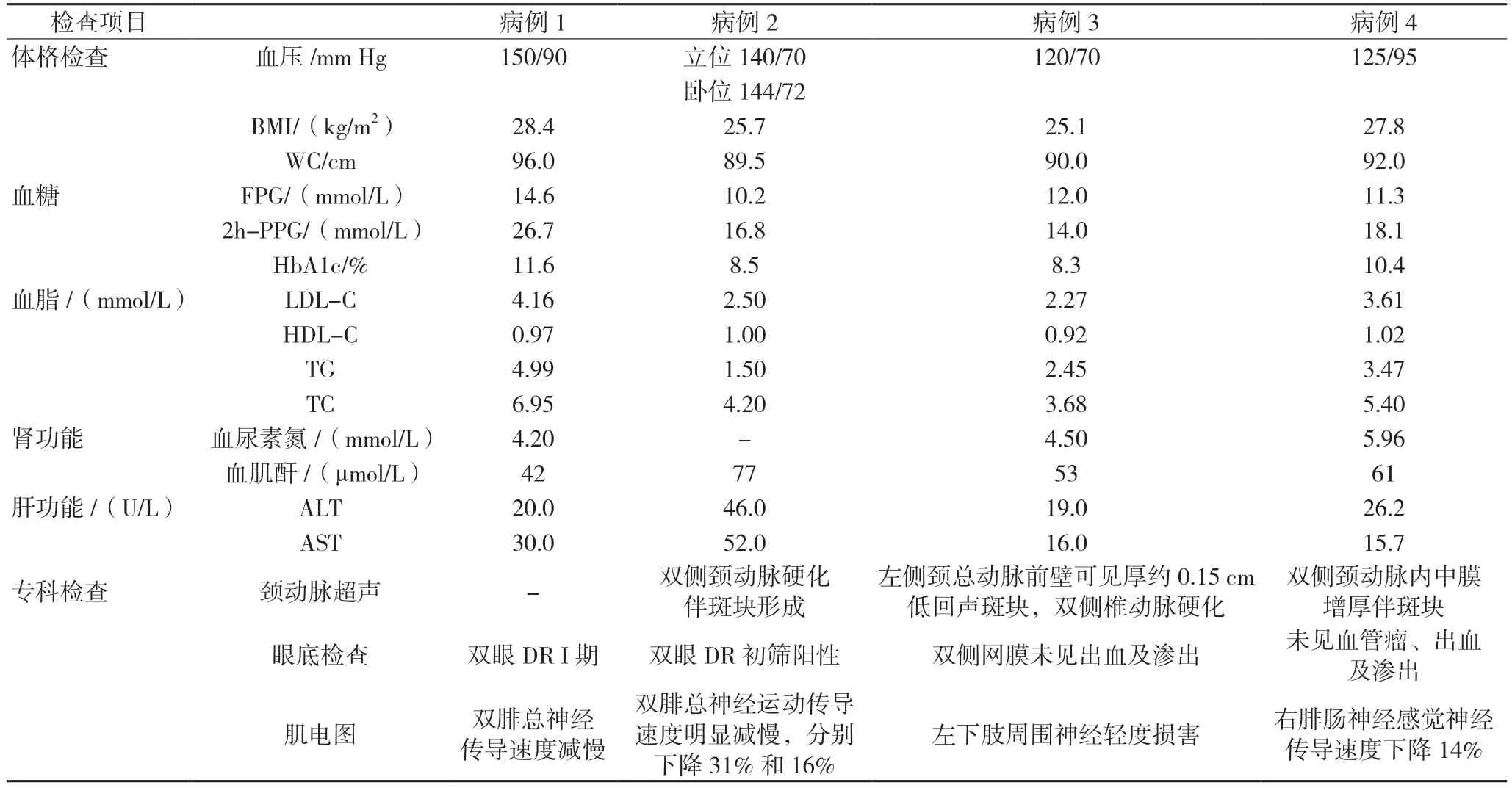
表3 4例T2DM患者实验室检查结果
1.3 治疗经过与结果
4 例患者共同特点是病程长(5~25 年),腹型肥胖,基础胰岛素分泌尚可,伴有周围神经病变,3 例合并心血管疾病,1 例合并脂肪肝,经基础胰岛素和(或)口服降糖药治疗后,血糖控制不佳。给予患者IDegLira 治疗,或是联合口服降糖药或速效胰岛素治疗。具体治疗方案见表4。

表4 4例T2DM患者治疗起始、出院时及随访时降糖方案
1.4 患者治疗期间低血糖、体重及不良反应发生情况
患者转换为德谷胰岛素拉鲁肽注射液后,除病例4 在第2 周随访时发生过1 次低血糖和有胃肠道不良反应外,其他病例均无低血糖事件发生、胃肠道反应及其他不良反应。病例1 第2 周随访时,体重下降3 kg,腰围减少4 cm;病例4 第3 个月随访时,体重下降7 kg,病例2 和病例3 未提及体重或腰围变化。
1.5 患者治疗前后血糖变化
详见表5。

表5 4例T2DM患者治疗前后自我血糖监测(SMBG)的变化 mmoL/L
2 病例点评
4 例T2DM 患者均为糖尿病病程较长,均合并糖尿病周围神经病变,均伴超重或腹型肥胖;其中病例2~4 同时合并心脑血管疾病或颈动脉粥样硬化,病例2 合并脂肪肝;4 例T2DM 经基础胰岛素和(或)口服降糖药(oral antidiabetic drug,OAD)治疗后,血糖控制不佳(HbA1c:8.3~11.6%),转换为IDegLira 治疗不联合/联合口服降糖药或速效胰岛素治疗后,空腹及餐后血糖均在短时间内获得良好控制并维持,耐受性和安全性良好。
已知T2DM 的发病机制非常复杂,涉及全身多个器官和组织[1],每种降糖药的作用靶点和病理生理的改善是有限的,因此联合不同作用机制的降糖药成为国内外糖尿病治疗的新特点和趋势。而早期启动联合治疗也有助于预防及延缓β 细胞衰竭[2]。同时T2DM 也是一种异质性疾病[3],个体差异较大,针对个体不同时期的病理生理异常进行个性化治疗也是未来精准治疗的趋势。
基础胰岛素和GLP-1RA 互为补充,靶向作用于T2DM 的核心病理生理缺陷即胰岛素抵抗和胰岛β 细胞功能障碍,其中基础胰岛素通过与肝脏、脂肪、骨骼肌的胰岛素受体结合,抑制肝糖生成,促进葡萄糖利用。GLP-1 作用于多靶点,可以葡萄糖依赖性地诱导胰岛素β 细胞合成和分泌胰岛素,并促进胰岛β 细胞新生,抑制胰岛β 细胞凋亡;还可作用于胰岛α 细胞,抑制胰高糖素的分泌,进而作用于肝脏,抑制肝糖生成,减少肝糖输出;同时减弱胃肠运动,延缓胃排空,减少摄食;作用于外周骨骼肌,增加胰岛素敏感性;也作用于大脑,可以降低食欲,增加饱腹感,从而减少能量摄入[4],二者联合可同时调整T2DM 病理生理机制的多重问题,促进空腹和餐后血糖双达标,全面改善血糖控制并减少血糖波动。固定配比的IDegLira 在胰岛素使用剂量相同或更低的情况下,降糖效果优于基础胰岛素,并且能减少低血糖风险,避免胰岛素治疗带来的体重增加等不良反应。DUAL 系列研究中发现IDegLira 组最终胰岛素日剂量低于基础胰岛素治疗组[5-6],且改善血糖的同时并不增加低血糖风险,胰岛素治疗相关的体重增加也较少。同时该系列研究还观察到剂量逐渐调整的过程有效减少了恶性、呕吐、腹泻等胃肠道反应的发生,并且发生胃肠道反应的严重程度也有减轻[6-8]。
DUAL II 研究[9]对比了既往使用基础胰岛素+二甲双胍±磺脲类/格列奈类治疗的患者,随机转为二甲双胍加IDegLira 治疗和二甲双胍加德谷胰岛素治疗。在相同的胰岛素剂量下,加IDegLira治疗组的HbA1c 降幅优于加德谷胰岛素组(-1.9%vs-0.9%,P<0.000 1),同时伴体重减轻2.7 kg(P<0.000 1),且无低血糖风险增加。DUAL V 研究[6]纳入既往应用基础胰岛素+二甲双胍控制不佳的T2DM 患者,随机分为IDegLira+二甲双胍组或优化甘精胰岛素剂量+二甲双胍,治疗结束时IDegLira 组在更少胰岛素剂量(41 单位vs 66 单位,P<0.001)的情况下降低HbA1c 的疗效优于甘精胰岛素(-1.81%vs-1.13%,P<0.0001);IDegLira 组平均体重减轻1.4 kg,甘精胰岛素组则平均增重1.8 kg(P<0.000 1),且IDegLira 组确证性低血糖发生率也显著低于甘精胰岛素组(28.4%vs49.1%)。这些研究中均入组既往应用基础胰岛素±OAD 治疗的患者,在转为IDegLira 时,均以16 剂量单位(德谷胰岛素16 U/利拉鲁肽0.6 mg)起始,每周2 次调整剂量,直至FPG 达标,操作简单,易于临床指导患者。
本组4 例患者均既往使用甘精胰岛素(26~32 U/d)联合或不联合OAD 血糖控制不佳的T2DM 患者,在转为IDegLira 治疗时3 例以16 剂量单位起始,1 例从12 剂量单位起始,在治疗随访1~3 个月后最终日剂量为12~20 剂量单位,均较之前剂量大幅减少,但空腹和餐后血糖均良好控制达标。不良反应反面,除病例4 在第2 周随访时发生过1 次低血糖和有轻度胃肠道不良反应外,其他病例均无低血糖事件发生、胃肠道反应及其他不良反应。2 例患者体重下降,腰围减少,整体上安全性、耐受性良好。
DUAL 系统研究还发现,与基础胰岛素或基础-餐时胰岛素治疗相比,IDegLira 治疗与血压、血脂等心血管危险因素的改善相关[6-7,10]。瑞士一项单一中心的真实世界研究也发现,转为IDegLira治疗后患者收缩压和舒张压均有小幅降低[11]。
对于糖尿病病程较长、合并包括心脑血管疾病等多种慢性并发症,已应用基础胰岛素±OAD 治疗控制不佳的T2DM 患者,在需进一步强化治疗时,转换为IDegLira 治疗,除弥补多重T2DM 病理生理紊乱外,而且方案操作简便,耐受性良好,低血糖风险低,不增加体重,值得临床选择适合的患者进一步积累临床实践经验。

