响应面优化蕲艾总黄酮提取工艺及其抗氧化活性研究
杨理萍,刘梦婷,郑雯琪,胡 婷,吴 鹏
(黄冈师范学院生物与农业资源学院,经济林木种质改良与资源综合利用湖北省重点实验室,大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000)
艾叶为菊科艾属类干燥叶,是常用的中医药材,其中以蕲艾最为盛名。蕲艾为我国湖北省蕲春县特产,植株高大、根茎粗壮、叶茎纤细、叶厚纸质[1],主要含有黄酮类、挥发油、鞣酸类、有机酸类等化学成分[2],具有抑菌、去湿、抗氧化等作用[3]。黄酮类物质作为植物源抗氧化剂之一,具有广阔的应用前景[4]。据研究报道,蕲艾与其他地方产的艾叶相比,其黄酮含量更高,具有较好的抗氧化、清除自由基、改善心脑血管循环和调节血压等功效[5]。
植物中提取总黄酮的方法主要有有机溶剂提取法、微生物发酵提取法、超声波辅助提取法[6]、微波辅助提取法等[7]。其中,有机溶剂提取法耗费时间和溶剂[8];微生物发酵提取法耗时长、成本高、作用效果有限[9];超声波辅助提取法受到系统溶剂的选择、提取温度以及提取工艺条件等的制约[10]。而微波辅助提取法是近年来比较新颖的提取植物总黄酮的方法[11-12],该方法具有操作简单、提取效率高和节省溶剂等优点[13],但应用响应面法优化微波辅助提取蕲艾中总黄酮的工艺及其抗氧化活性的研究鲜见报道。
当前对蕲艾的研究主要集中在初级产品加工等方面,对其深加工产品的研发较少。为了拓宽蕲艾的深加工方式,提升蕲艾产业的发展水平,本试验以蕲艾为原料,采用微波辅助法提取蕲艾总黄酮,利用响应面优化法得到其最优提取工艺[14],为更好地开发利用蕲艾黄酮资源提供理论支持;并通过DPPH自由基清除能力与体外总还原能力评价蕲艾总黄酮在最优提取工艺条件下的抗氧化活性,为蕲艾中总黄酮的综合利用提供理论参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
新鲜蕲艾:购于黄冈市蕲春县。
无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、1,1-二苯基-2-三硝基苯肼(DPPH)、磷酸盐、铁氰化钾、三氯乙酸,均为国产分析纯:国药集团化学试剂有限公司;VC标准品:国药集团化学试剂有限公司;芦丁标准样品:中国药品生物制品鉴定所。
1.1.2 仪器与设备
SHZ-DⅢ型循环水真空泵:巩义市予华仪器有限责任公司;AL204型电子天平:梅特勒-托利多仪器(上海)有限公司;FW100型高速万能粉碎机、DK-98ⅡA型电热恒温水浴锅:天津市泰斯特仪器有限公司;723型可见分光光度计:上海光谱仪器有限公司;H/T18MM型台式高速离心机:湖南赫西仪器装备有限公司。
1.2 方法
1.2.1 工艺流程
新鲜蕲艾→干燥→粉碎→过筛→称重→浸泡→微波辅助提取→抽滤→提取液
1.2.2 操作要点
将经过一系列初加工处理后的蕲艾干燥叶碾碎后过80目标准筛,得到颗粒尺寸≤0.180 mm的粉末。称取0.500 g蕲艾粉末于250 mL锥形瓶内,依据设定的料液比加入体积分数50%的乙醇溶液浸泡0.5 h,在设定的微波条件下进行总黄酮的提取,反应结束后趁热抽滤,得到提取液。
1.2.3 单因素试验设计[15-16]
1.2.3.1 微波功率的筛选
精确称取干燥蕲艾粉0.500 g于锥形瓶中,按料液比1∶80(g·mL-1)加入相应量的50%乙醇溶液浸泡30 min,分别在微波功率为80、240、400、640、800 W,微波时间5 min的条件下对其进行微波处理,考察不同微波功率对蕲艾中总黄酮得率的影响。
1.2.3.2 微波时间的筛选
精确称量干燥蕲艾粉0.500 g于锥形瓶中,按料液比1∶80(g/mL)加入相应量的50%乙醇溶液浸泡30 min,分别在微波时间为2、3、4、5、6 min,微波功率为240 W的条件下对其进行微波处理,考察不同微波时间对蕲艾中总黄酮得率的影响。
1.2.3.3 料液比的筛选
精确称取蕲艾干燥粉0.500 g于锥形瓶中,加入体积分数为50%的乙醇溶液,分别在料液比为1∶40、1∶60、1∶80、1∶100、1∶120(g/mL)的条件下浸泡30 min,微波功率240 W,微波时间5 min,考察不同料液比对蕲艾中总黄酮得率的影响。
1.2.4 响应面优化试验设计
基于单因素试验结果,以微波功率、微波时间、料液比为自变量,利用Box-Behnken法设计3因素3水平响应面试验[17],优化得出提取蕲艾黄酮的最佳工艺,试验因素与水平见表1[18]。

表1 蕲艾黄酮提取工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface experiment for extraction technology optimization of flavonoids from Artemisia argyi
1.2.5 总黄酮的检测
1.2.5.1 芦丁标准曲线的绘制
参考黄艳玲等[19]的方法配制0.61 mg/mL的芦丁标准溶液,先加入1.0 mL 5%的亚硝酸钠溶液,静置5 min后,加入1.0 mL 10%硝酸铝溶液,再静置5 min,最后加入4.0 mL 10%氢氧化钠溶液,用体积分数50%的乙醇溶液定容至刻度线。同理,配制除芦丁外的试剂作空白参照,在波长510 nm处测定其吸光度并绘制芦丁标准曲线,得到芦丁质量浓度C与吸光度A的关系:A=11.221C-0.003 1(R2=0.999 6),线性关系良好,可信度高。
1.2.5.2 总黄酮含量测定
将滤液转入50 mL容量瓶中,继而用体积分数50%乙醇溶液定容至刻度线后摇匀,再用移液枪精确量取0.2 mL蕲艾乙醇混合液于10 mL容量瓶中,按制作标准溶液的步骤方法加入2倍体积的试剂,摇匀后用体积分数50%乙醇溶液作为溶剂定容至刻度处,放置5 min。以体积分数50%乙醇溶液为对照组,在510 nm[19]处测定吸光度,代入回归方程即可得蕲艾中总黄酮的浓度,通过公式得到蕲艾中总黄酮的得率。
计算公式为:
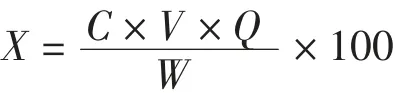
式中:X为蕲艾中总黄酮得率,%;C为测定样品液的浓度,g·mL-1;V为测定样品液的体积,mL;Q为待测液的稀释倍数;W为蕲艾粉的质量,g。
1.2.6 总黄酮抗氧化能力的测定
1.2.6.1 DPPH自由基清除能力[20-21]
以抗坏血酸为阳性对照,将蕲艾黄酮溶液配制成浓度为0.2、0.4、0.6、0.8、1.0 g·L-1的待测液。分别取3 mL上述各个浓度的蕲艾黄酮溶液置于不同试管中,再向每只试管中加入3 mL 0.1 mol·L-1的DPPH溶液,充分混合后,放置30 min。以无水乙醇作为参比,在波长517 nm处测得吸光度AX;以无水乙醇替代3 mL蕲艾黄酮溶液,测量后得吸光度A0;于试管中充分混合相同体积不同浓度的蕲艾黄酮溶液与无水乙醇,静置30 min,测得吸光度AX0。
DPPH自由基清除率计算公式为:

式中:A0为空白溶液的吸光度;AX为样品溶液的吸光度;AX0为样品与无水乙醇等体积混合液的吸光度。
1.2.6.2 体外总还原能力[22]
以抗坏血酸为阳性对照,将蕲艾黄酮溶液配制成浓度为0.2、0.4、0.6、0.8、1.0 g·L-1的待测液。精确量取2.5 mL上述不同浓度的蕲艾黄酮待测液转移至5支试管中,依次加入2.5 mL磷酸盐缓冲液(pH=6.6)和2.5 mL 1%铁氰化钾溶液于试管中,边加边振荡,再将试管置于50℃水浴锅内加热20 min,立即取出,再加入精确量取的2.5 mL 10%三氯乙酸溶液,摇匀后置于离心机中以3 000 r·min-1离心10 min,然后取5 mL上清液,依次加入5 mL蒸馏水、1 mL 0.1%三氯化铁溶液,于700 nm处[23]测定吸光度。
1.2.7 数据处理
使用Excel软件对数据进行统计分析并绘制图表[24],采用Design-Expert 8.0.5b软件及Box-Behnken法进行方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 不同微波功率对蕲艾总黄酮得率的影响
由图1可见,微波功率在80~400 W时,蕲艾总黄酮得率呈现增长趋势;微波功率为400 W时得率达到最大,为12.42%;微波功率在400~800 W时,蕲艾总黄酮得率呈现递减趋势。可能原因是:在较低微波功率的提取条件下,温度提升得较慢,蕲艾细胞的破碎程度较低,但随着微波功率的增大,温度也在渐渐上升,分子无规则运动速率增加,进而蕲艾细胞的破碎程度增强,因此,蕲艾总黄酮得率也随之变大;当微波功率超过适当限度时,温度上升过快,乙醇溶剂蒸发损失过大,进而使得蕲艾在溶剂中溶解得更少;另外太高的微波功率会破坏黄酮化合物的结构,其得率也会受到影响。因此,确定蕲艾黄酮提取的最佳微波功率为400 W。
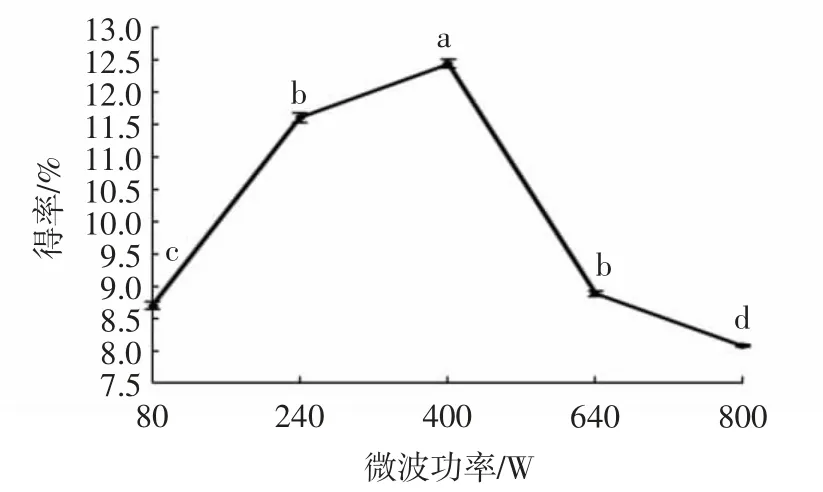
图1 微波功率对蕲艾黄酮得率的影响Fig.1 Effects of microwave powers on extraction yields of flavonoids from Artemisia argyi
2.1.2 不同微波时间对蕲艾总黄酮得率的影响
由图2可以看出,微波时间为2~5 min时,蕲艾总黄酮得率随微波时间的延长逐渐升高;当微波时间为5 min时,总黄酮得率最大,其值为11.41%;而当微波时间为5~6 min时,总黄酮得率随着微波时间的延长而降低。这是由于微波时间的增加使得辐射的强度增强,黄酮细胞的破碎程度进一步增加[25],溶液中提取出的黄酮含量也会随之增多,导致得率增加;但当微波时间超过一定限度时,细胞破碎程度在增加的同时,乙醇不断挥发,溶剂损失也在增加,溶液中黄酮溶解量降低,导致黄酮得率也随之下降。
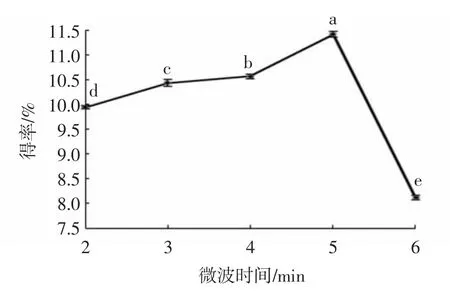
图2 微波时间对蕲艾黄酮得率的影响Fig.2 Effects of microwave time on extraction yields of flavonoids from Artemisia argyi
2.1.3 不同料液比对蕲艾总黄酮得率的影响
由图3可见,在1∶40~1∶80(g/mL)的料液比区间内,随着乙醇使用量的增加,蕲艾总黄酮得率会随之上升;在料液比为1∶80(g/mL)时,总黄酮得率达到最大值,为10.30%;然而在1∶80~1∶120(g/mL)的区间内,乙醇溶剂使用量增加,总黄酮得率反而下降。这是因为当乙醇溶剂使用占比小时,随着乙醇含量的增加,溶液中的乙醇与蕲艾中的黄酮类化合物接触更加密切,导致溶液中溶解的黄酮类化合物也逐渐增加,相应得率明显上升;当乙醇溶剂用量过大时,溶液体系中其他物质会与黄酮类化合物竞争乙醇溶剂[26],进而影响黄酮类化合物的得率。
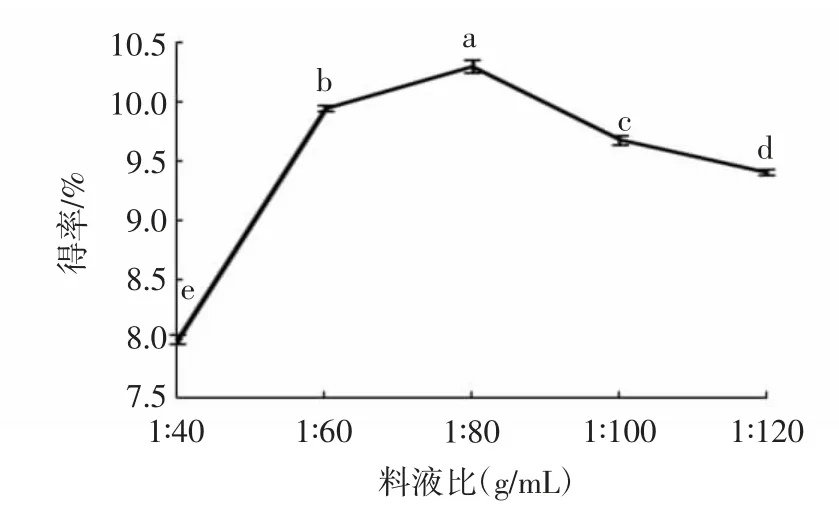
图3 料液比对蕲艾黄酮得率的影响Fig.3 Effects of solid-liquid ratios on extraction yields of flavonoids from Artemisia argyi
2.2 响应面试验优化蕲艾黄酮的提取工艺
2.2.1 响应面试验结果与分析
根据单因素试验结果,以微波功率(A)、微波时间(B)、料液比(C)为自变量,蕲艾总黄酮得率(Y)为响应值,利用Box-Behnken法设计优化试验[27],响应面试验结果及数据分析见表2。
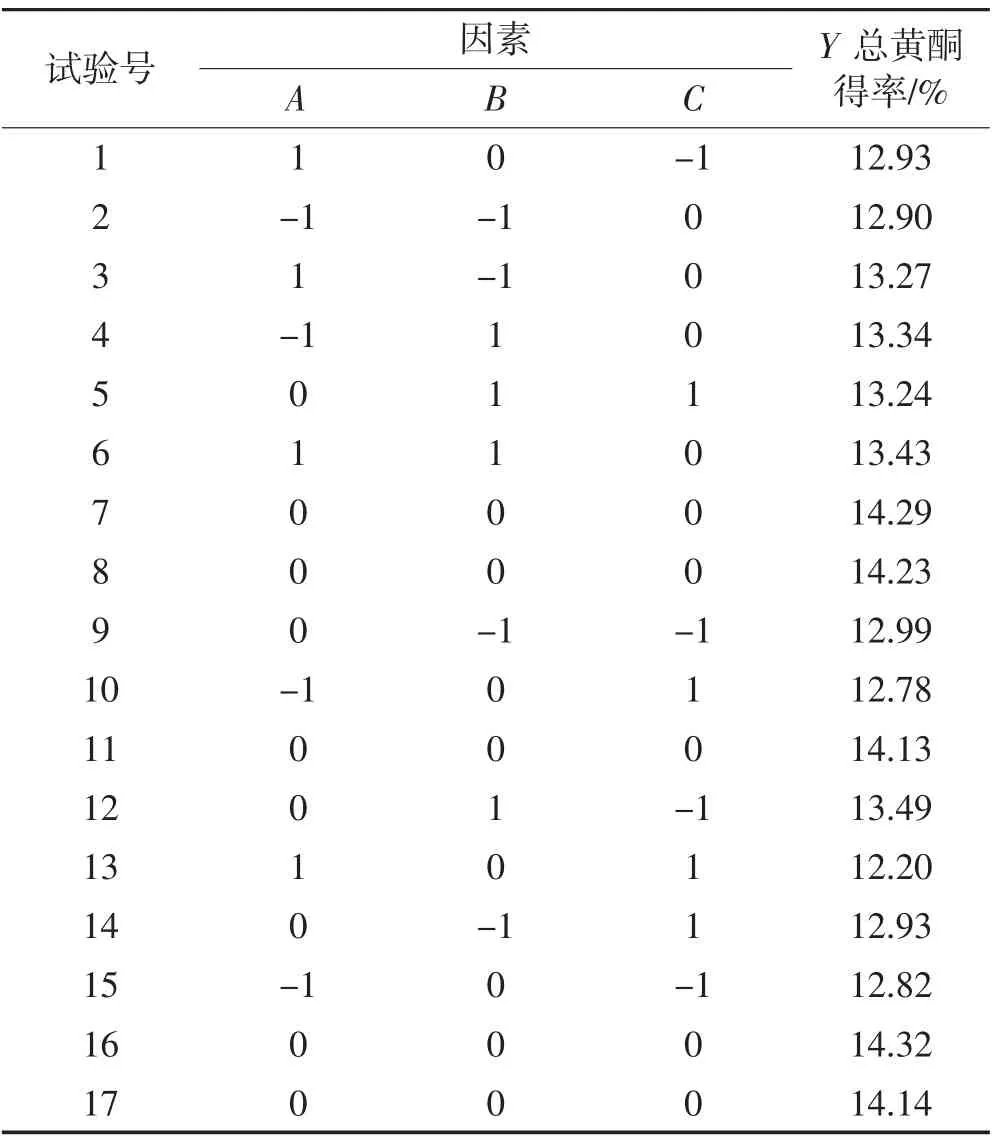
表2 蕲艾黄酮提取工艺优化的响应面试验结果与分析Table 2 Results and analysis of response surface experiment for extraction technology optimization of flavonoids from Artemisia argyi
对表2的数据进行二次多元拟合[28],得到蕲艾总黄酮得率对微波功率(A)、微波时间(B)、料液比(C)的回归方程为:

对模型进行显著性检验,结果如表3所示。
由表3可见,以蕲艾黄酮得率为响应值建立的试验模型中P<0.000 1,说明回归模型极显著,而失拟项P=0.064 8>0.05,检验结果为不显著,说明该结果可行,且决定系数R2=0.976 2,校正决定系数=0.945 6,表明本模型可以解释94.56%的响应面变化,说明此回归曲线对试验拟合度较好,因此用该模型和方程来探究蕲艾黄酮的最佳工艺是可行的。其中二次项A2、B2、C2对结果影响极显著(P<0.01);因素B、C、交互项AC对结果影响显著(P<0.05);而因素A、交互项AB、BC对结果影响不显著。
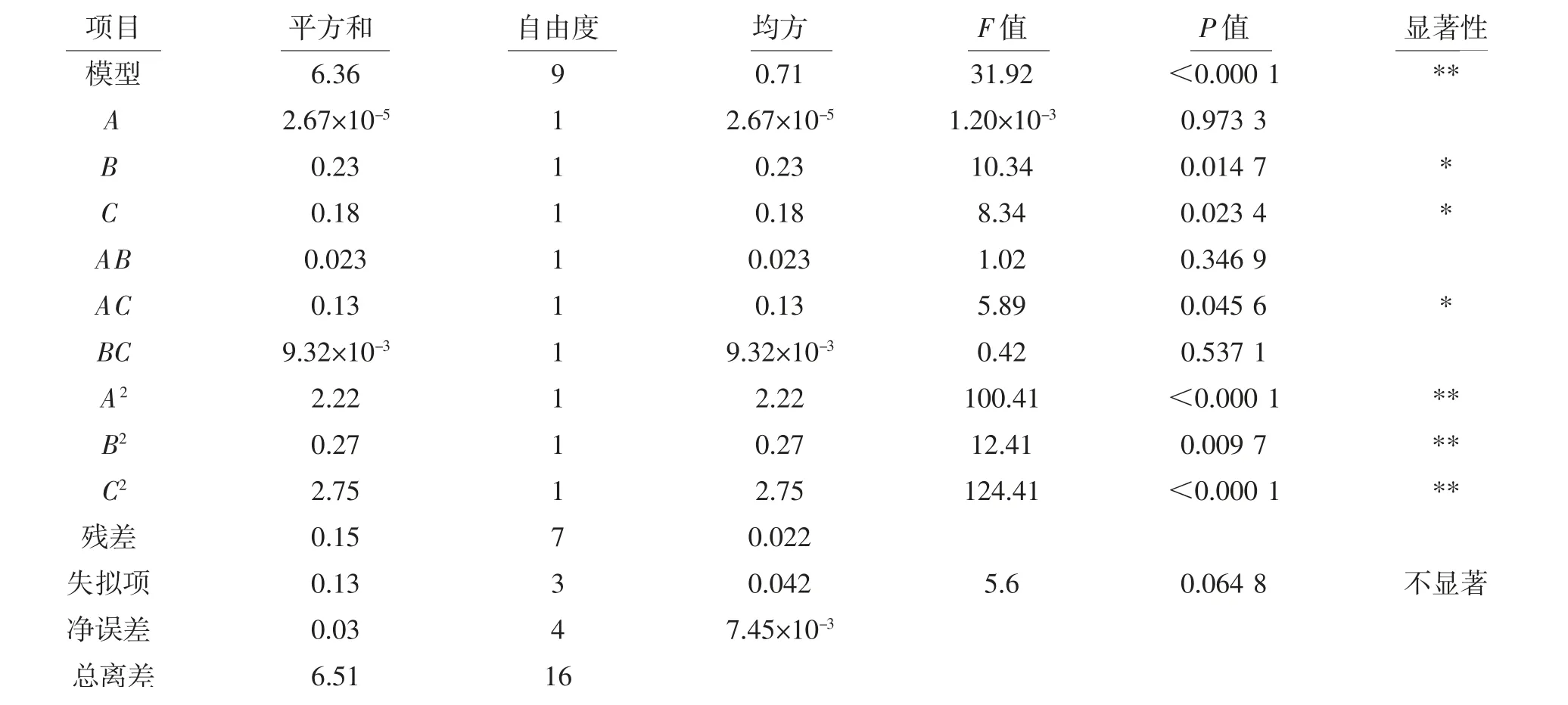
表3 回归模型的方差分析Table 3 Variance analysis of regression model
根据F值大小可知,3个因素中对黄酮得率影响程度的顺序为:B>C>A,即微波时间>料液比>微波功率。
2.2.2 响应面分析与优化
由图4可知,微波功率与微波时间交互作用、微波功率与料液比交互作用、微波时间与料液比交互作用的显著性情况与表3交互项P值的分析结果一致。在响应面分析中,响应面曲面的陡度反映了响应面中得率对提取条件的敏感度[29-30],沿微波时间(B)方向比微波功率(A)的响应面坡度更陡,等高线也更密集,说明微波时间比微波功率对蕲艾黄酮得率的影响更大,与方差分析结果一致;等高线呈椭圆形,则表示两因素交互作用影响较大,微波功率(A)与料液比(C)两因素交互作用明显,符合方差分析的结果。
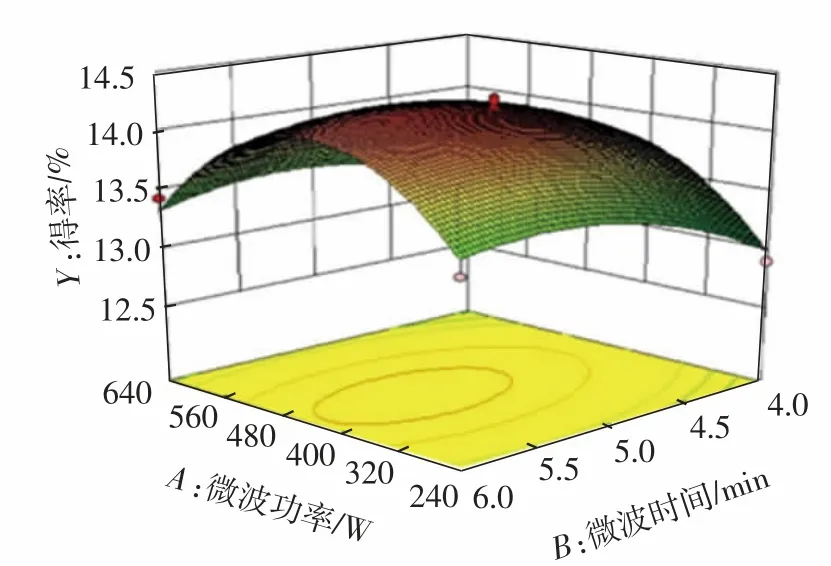

图4 各因素之间的交互作用对蕲艾总黄酮得率影响的响应曲面图Fig.4 Response surface and contour lines showing the interaction effects of microwave power,microwave time and solid-liquid ratio on flavonoids extraction yields
依据Design-Expert 8.0.5b软件构建的模型,进行单因素的最优分析[31],得出蕲艾中总黄酮提取的最佳工艺为:料液比1∶78.14(g/mL),微波功率438.15 W,微波时间5.36 min,在该工艺条件下,蕲艾总黄酮的得率可达到14.26%。
2.2.3 响应面法的可靠性验证
综合考虑到实际操作的方便性和可实施性,将上述工艺所得参数调整为:微波功率400 W,微波时间5 min,料液比1∶80(g/mL),为了验证该工艺的可靠性,进行3组平行试验后,得到艾叶中总黄酮的平均得率为14.22%,与模型预测的理论值接近。结果表明,响应面法优化微波辅助提取蕲艾中总黄酮的工艺条件是可靠的。
2.3 蕲艾总黄酮抗氧化活性测定结果
2.3.1 DPPH自由基清除能力测定结果
蕲艾黄酮及VC对DPPH自由基清除能力测定结果如图5所示。
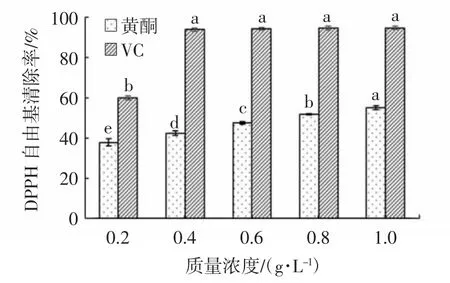
图5 蕲艾总黄酮的DPPH自由基清除能力测定结果Fig.5 Determination results of DPPH free radical scavenging rates of flavonoids from Artemisia argyi
由图5可知,蕲艾总黄酮在质量浓度为0.2~1.0 g·L-1时,其对DPPH自由基具有较好的清除能力,随着总黄酮质量浓度的增加呈现上升趋势,且DPPH自由基清除能力在蕲艾黄酮浓度为1.0 g·L-1时达到最强,为55.40%。与阳性对照VC相比,相同浓度下的蕲艾总黄酮的DPPH自由基清除能力均低于VC。
2.3.2 体外总还原能力测定结果
蕲艾黄酮及VC体外总还原能力测定结果如图6所示。

图6 蕲艾总黄酮的体外总还原能力测定结果Fig.6 Determination results of total reduction capacities in vitro of flavonoids from Artemisia argyi
由图6可知,不同质量浓度的蕲艾总黄酮均表现出一定的还原能力,当黄酮浓度在0.2~1.0 g·L-1时,随着黄酮浓度的上升,其体外总还原能力也逐步上升,在黄酮浓度为1.0 g·L-1时,其吸光度最大,为0.208,即体外总还原能力达到最高峰。与阳性对照VC相比,相同浓度下的蕲艾黄酮体外总还原能力略低于VC。
3 结论
以蕲艾为原料,采用微波辅助法提取总黄酮,在单因素试验基础上应用响应面分析法进行工艺优化,得到蕲艾总黄酮最佳提取工艺为:微波功率400 W,微波时间5 min,料液比1∶80(g/L),在此条件下,蕲艾总黄酮的得率可高达到14.22%,与预测值(14.26%)接近,说明该提取工艺准确性高、重复性好,可应用于蕲艾总黄酮的工业化提取,能为蕲艾总黄酮的相关开发研究提供有利的参考依据。
蕲艾总黄酮的抗氧化活性试验结果表明,其抗氧化活性随质量浓度的增大呈上升趋势,当质量浓度为1.0 g·L-1时,其对DPPH自由基清除率为55.4%,相同浓度下的蕲艾黄酮体外总还原能力略低于VC,表明蕲艾黄酮具有良好的抗氧化活性,该结果为深入开发蕲艾中总黄酮资源提供了重要的理论依据。

