基于重水拉曼技术评价次氯酸钠对粪肠球菌抑菌效能的研究
马玉莹芦昕张利娟刘育含李帆谭凯璇张颖李修珍杨芳
1.青岛市市立医院口腔医学中心,青岛266071;2.大连医科大学口腔医学院,大连116044;3.临沂市妇幼保健院口腔科,临沂276002;4.青岛大学口腔医学院,青岛266000;5.天津医科大学口腔医学院,天津300070
根管治疗是牙髓炎和根尖周炎最有效、最常规的治疗方法,而根管治疗的成功与否取决于根管内的感染物能否彻底清除以及根管内感染能否得到控制。其中,粪肠球菌被认为是与根管感染相关的主要病原体[1],有效抑制粪肠球菌在根管治疗的成功中就显得尤为重要。
尽管根管机械预备技术已相当成熟,但仍有至少35%~50%的根管壁难以被器械预备[2],无法达到彻底清除根管系统内感染物质的目的,还需辅以冲洗液的机械或化学作用来达到。次氯酸钠是临床常用根管冲洗液,有良好的组织溶解能力和抗菌能力[3],其常用质量分数为0.5%~5.25%。
目前评价药物对病原微生物作用效果的“金标准”是通过最小抑制浓度(minimum inhibitory con‐centration,MIC)对目标药物进行定量评价[4]。传统药物评价技术主要作用于细胞群体水平,忽略了细胞异质性,而药物作用下产生的细胞异质性则是致病菌产生耐药的基础。病原菌的异质性水平必须降低到一定水平才能保证抗菌剂良好的作用效果。最小抑菌浓度的测定仅能考察微生物生长抑制效果,而未考虑细胞活性,忽略了不生长但具有代谢活性(nongrowing but metabolically active,NGMA)的持留菌群体。细胞异质性和细胞代谢活性的存在正是导致耐药性及疾病复发的重要因素[5]。
重水拉曼技术是一种不依赖细胞培养的、在单细胞水平上,快速、定量、无损、高通量的评价抗菌剂对目标微生物的代谢抑制效果的技术手段,并已应用于临床药物评价筛选、微生物种类鉴别[6]等领域。Tao等[7]采用重水拉曼技术在单细胞水平表征不同口腔抑菌剂对变异链球菌UA159、血链球菌ATCC10556等多种细菌代谢活性的影响,证实了拉曼光谱中的重水峰[(C-D峰)2 040~2 300 cm-1区域]是细胞生理代谢活性的生物学指示标志,其所占比例可用于分析药物刺激目标菌株后的代谢反应;并提出最低抑制代谢浓度(mini‐mum inhibitory concentration based on metabolic ac‐tivity,MIC-MA)[使目标菌株在药物作用8 h后的ΔC-D-ratio(当前时间与0 h的C-D ratio(重水峰所占面积)差值)均值≤0且标准差≤0.005的最小药物浓度]评价抗菌剂对目标菌种的代谢抑制作用,为重水拉曼技术研究抗菌药物对病原菌的功能抑制作用提供理论和数据支持。
随着各种抗菌剂的广泛应用,细菌耐药性问题已经严重影响到传统药物对相关疾病的治疗效果,甚至产生超级病原菌,严重威胁人类健康[8]。为了减少根管封药菌株的产生、根管治疗失败及难治性根尖周炎的发生,降低高浓度用药导致的毒副作用,指导临床合理用药,单细胞药物评价系统成为大势所趋。本实验采用粪肠球菌作为实验菌株,研究重水对粪肠球菌生长的影响及其对重水的吸收规律,评价重水拉曼技术的普适性,并应用重水拉曼技术评价次氯酸钠对粪肠球菌生长和代谢的抑制效果。
1 材料和方法
1.1 实验菌株
实验菌株粪肠球菌ATCC29212购自中国医学菌种保藏中心,甘油菌种于-80℃条件下储藏。
1.2 材料和仪器
5.25%次氯酸钠(福建维真园医药科技有限公司);全自动生长曲线分析仪(Lab systems公司,芬兰);超净工作台(Thermo Scientific公司,美国);电热恒温培养箱(Shelab公司,美国);96孔板(Corning公司,美国);酶标仪(BioTek公司,美国);共聚焦显微拉曼光谱仪(Horiba公司,法国);CaF2玻片(Crystran limited公司,英国);99.99%D2O(Sigma-Aldrich公司,美国)。
1.3 方法
1.3.1 重水标记的粪肠球菌生长周期观察 1)将冻存的粪肠球菌ACTT29212划线接种于脑心浸液肉汤(brain heart infusion,BHI)培养基表面,于37℃培养24 h后贮藏在4℃条件下。2)挑取粪肠球菌ATCC29212单克隆菌落接种于5 mL BHI培养液中,37℃培养至对数生长期,用BHI培养液调整菌液浓度至OD600=0.5。3)将培养至对数生长期的粪肠球菌ATCC29212按照体积比1∶10分别接种于含不同重水浓度(0%、10%、20%、30%、40%、50%)的BHI培养液中(0%为对照组),37℃条件下每隔15 min定时测定菌液样本的OD600值,设定观测时间段为0~12 h。实验重复3次,每次每个时间点设置3个生物学平行。
1.3.2 图谱中重水峰面积与所加重水浓度的关系研究 粪肠球菌ATCC29212培养同前。将培养至对数生长期,OD600=0.5的粪肠球菌ATCC29212按照体积比1∶10分别接种于含不同重水浓度(0%、10%、20%、30%、40%、50%)的BHI培养液中(0%为对照组),37℃条件下培养12 h,每个重水浓度分别随机测定30个单细胞拉曼图谱。实验重复3次。
拉曼图谱采集:使用基于LabRam HR型的改良后共聚焦拉曼荧光显微镜,采用532 nm的Nd:YAG激光源,使用Newton EMCCD采集散射光子,采用每毫米300线规格的分光光栅,在100倍物镜视野内随机采集30个单细胞拉曼图谱。
1.3.3 重水拉曼技术评价药物抑菌效能的敏感性分析 粪肠球菌ATCC29212培养同前。将培养至对数生长期,OD600=0.5的粪肠球菌ATCC29212按照体积比1∶10接种于含30%重水的BHI液体培养基中,37℃条件下培养,时间梯度上(0、0.5、1、2、3、4、6、8 h)按照每个时间点进行取样,采集拉曼图谱及测量OD600值。实验重复3次。
1.3.4 次氯酸钠对粪肠球菌的MIC测定 粪肠球菌ATCC29212培养同前,将对数生长期的粪肠球菌ATCC29212菌液调整浓度至OD600=0.5。于超净台内打开无菌96孔板,将所获菌液加入不同浓度(0.2、0.4、0.45、0.6、0.9、1、1.8 g·L-1)次氯酸钠实验组及对照组(不含次氯酸钠)中,每孔内液体总体积为200μL,37℃培养24 h,使用酶标仪测定0 h和24 h时的OD600值,测定次氯酸钠作用后的MIC值,ΔOD600≤0.05时对应的最低药物浓度,即次氯酸钠对粪肠球菌ATCC29212的MIC[9]。实验重复3次。
1.3.5 次氯酸钠对粪肠球菌的MIC-MA测定 粪肠球菌ATCC29212培养同前。将对数生长期的粪肠球菌ATCC29212菌液调整浓度至OD600=0.5。将所获菌液按1∶10比例稀释至含有0 g·L-1、0.225 g·L-1(0.5×MIC)、0.45 g·L-1(1×MIC)、0.9 g·L-1(2×MIC)浓度次氯酸钠和30%重水的BHI培养基中,37℃恒温培养,0、0.5、1、1.5、2、3、4、6、8 h时间梯度取样。
获得的样品经200μL超纯水洗涤,离心后弃上清,此操作重复3次。然后使用超纯水重悬粪肠球菌细胞后取2µL稀释液点在CaF2玻片表面,超净台内自然风干,100倍物镜下在不同视野内随机收集测量约30个单细胞拉曼图谱。
将采集到的拉曼光谱用LabSpece 5软件进行拉曼图谱的背景去除、基准线归一化和最大值标准化处理后,即可计算图谱中重水峰面积。通过计算8 h和0 h的重水峰所占面积的差值得到ΔC-D ratio,当ΔC-D ratio≤0且标准差≤0.005时对应的最低药物浓度即为次氯酸钠对粪肠球菌ATCC29212的MIC-MA[7]。实验重复3次。
为进一步探究粪肠球菌ATCC29212的代谢活性是否会随培养时间的延长而升高,本研究将粪肠球菌ATCC29212的培养时间延长至24 h,并绘制了平均重水峰所占面积随时间变化的折线图。
1.4 统计学分析
实验中定量数据均采用“均数±标准差”表示。采用SPSS 17.0软件进行统计学分析,统计方法采用T检验,检验水准为双侧α=0.05。实验结果采用R(3.6.1版本)软件包进行统计学分析,由于拉曼图谱包含多个数据点为多维数据,因此拉曼图谱之间的比较采用Wilcoxon秩和检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 重水标记粪肠球菌生长周期的观察结果
将粪肠球菌ATCC29212暴露于含不同重水浓度的培养基中分别测定OD600值,与未加重水的对照组相比,培养基中重水浓度≤40%时,粪肠球菌ATCC29212的生长不会受到抑制(P>0.05);浓度在50%时,粪肠球菌ATCC29212的生长受到一定程度抑制(P=0.028,P<0.05)(图1)。因此,当重水浓度低于40%时,重水的毒性不成为本实验的限制因素。
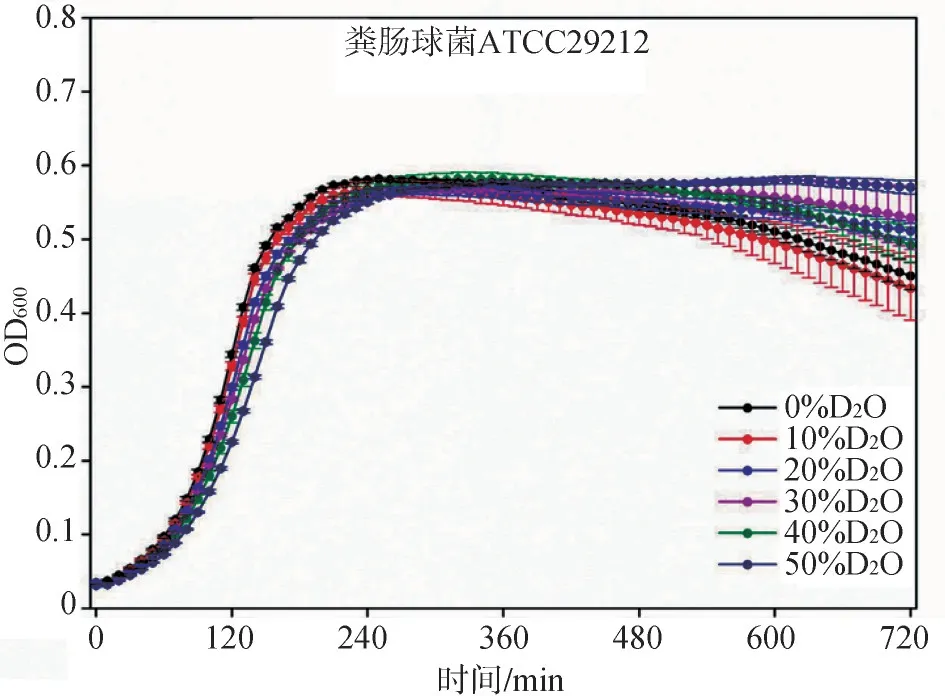
图1 粪肠球菌ATCC29212在不同重水浓度下OD600随时间的变化Fig 1 The temporal change of OD600 for Enterococcus faecali s ATCC29212 under different D2Olevels
2.2 图谱中重水峰面积与所加重水浓度之间关系的研究结果
除不含重水的对照组外,不同浓度重水培养的粪肠球菌ATCC29212的拉曼图谱在2 040~2 300 cm-1区域均会出现重水峰(图2),且重水峰大小随重水浓度的增加而增加,重水峰所占面积与所加入重水浓度呈线性正相关关系(R2=0.958 5,P<0.001)(图3)。该结果表明:粪肠球菌ATCC-29212能够活跃代谢重水并通过拉曼图谱检测出来,因此本研究选择既不影响粪肠球菌ATCC-29212生长状态,又能显示出明显重水峰的重水浓度——30%作为后续实验的重水浓度。
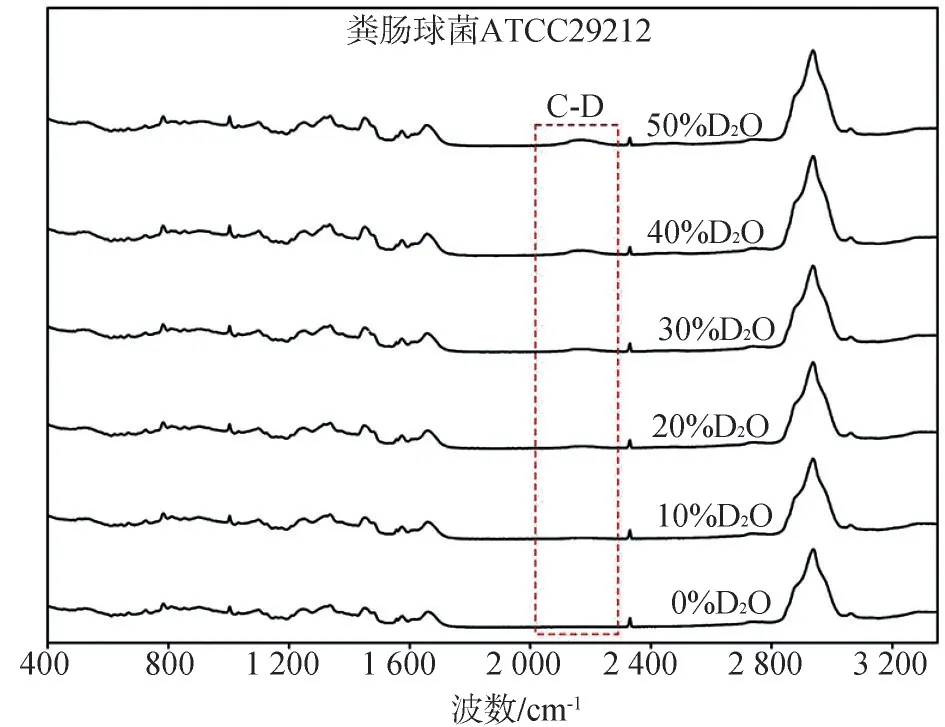
图2 粪肠球菌ATCC29212的单细胞拉曼图谱Fig 2 The single cell Raman spectrum of Enterococcus faecali s ATCC29212
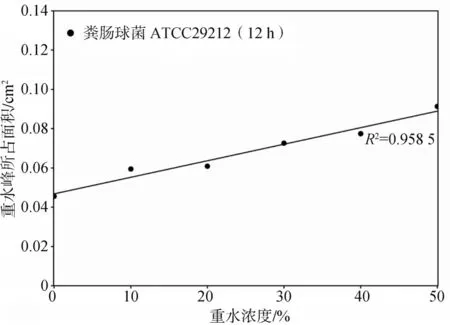
图3 稳定期粪肠球菌ATCC29212单细胞拉曼图谱中重水峰所占面积与重水浓度之间关系Fig 3 Therelationshipbetween C-Dratioand D2Oconcentrationin SCRSof Enterococcusfaecali sATCC29212atstablephase
2.3 重水拉曼技术评价药物抑菌效能的敏感性分析结果
随着粪肠球菌ATCC29212在含有30%重水培养基中培养时间的延长,重水峰的强度如图4所示,单细胞拉曼图谱中重水峰所占面积与OD600随时间变化趋势如图5所示。基于代谢活性的重水峰几乎在加入30%重水后的即刻就出现,并在30 min时即差异有统计学意义(P<0.01);而基于生长的吸光度值OD600的明显变化在3 h后才出现。因此基于代谢活性的技术手段较为敏感。
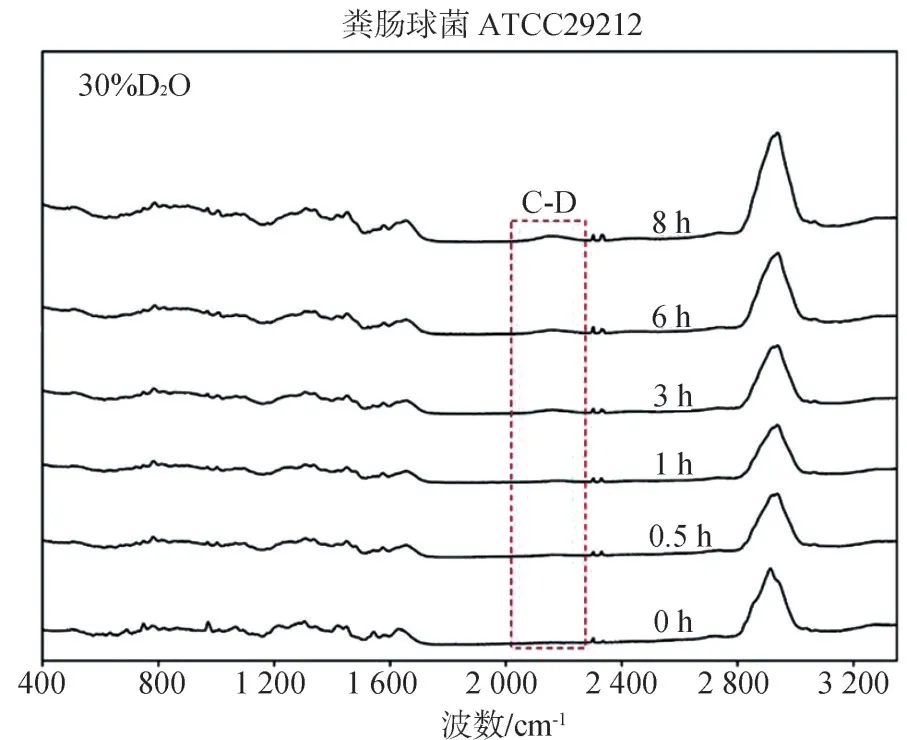
图4 粪肠球菌ATCC29212在30%重水浓度下随时间变化的单细胞拉曼图谱Fig 4 The temporal change of SCRS for Enterococcus faecali s ATCC29212 under 30%D2O
2.4 次氯酸钠对粪肠球菌的MIC测定结果
次氯酸钠对粪肠球菌ATCC29212的MIC测定结果显示:在次氯酸钠浓度分别为0.2、0.4 g·L-1时,ΔOD600>0.05;在次氯酸钠浓度为0.45、0.6、0.9、1、1.4、1.8 g·L-1时,ΔOD600<0.05。因此,次氯酸钠对粪肠球菌ATCC29212的MIC为0.45 g·L-1。
2.5 次氯酸钠对粪肠球菌的MIC-MA测定结果
次氯酸钠对粪肠球菌的MIC-MA测定结果表明:次氯酸钠浓度在0.225 g·L-1(0.5×MIC)及0.45 g·L-1(1×MIC)时,ΔC-D-ratio>0;次氯酸钠浓度在0.9 g·L-1(2×MIC)时,ΔC-D-ratio<0且标准差<0.005,ΔC-D ratio值明显降低(P<0.001)。因此,粪肠球菌ATCC29212的MIC-MA为0.9 g·L-1,即2×MIC。
随着次氯酸钠药物浓度的升高,ΔC-D-ratio呈下降趋势,表现为负相关关系。当药物浓度达到MIC-MA时,绝大多数粪肠球菌ATCC29212进入小于0的“代谢静止区”,而在MIC浓度下,大部分细菌细胞没有进入“代谢静止区”,仍存在代谢活性(图6)。
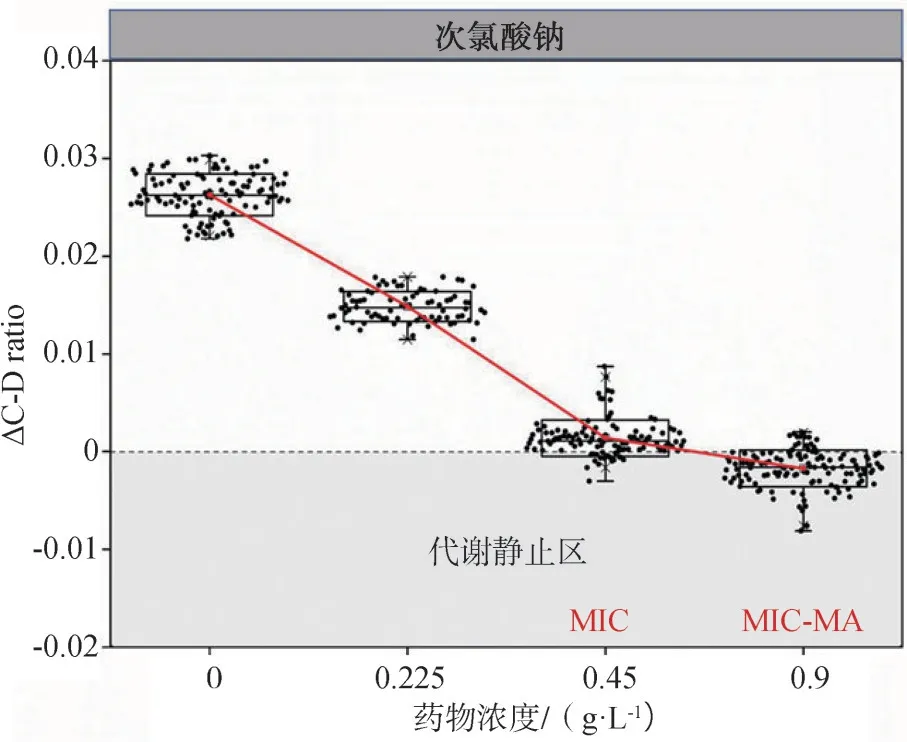
图6 次氯酸钠对粪肠球菌ATCC29212的MIC-MA测定Fig 6 The measurement of MIC-MA of NaClO for Enterococcus faecali s ATCC29212
拉曼图谱中重水峰所占面积的时间动态变化曲线显示(图7),次氯酸钠浓度为MIC时,虽然重水峰的增长低于未加药的对照组,且保持在一个较低的水平,但8 h时的重水峰较0 h时高,将粪肠球菌ATCC29212的培养时间延长至24 h后,结果显示(图8),MIC浓度次氯酸钠刺激下的粪肠球菌ATCC29212的重水峰所占面积大幅回升,达到对照组的93%;而药物浓度在MIC-MA时,粪肠球菌ATCC29212的代谢活性在24 h内始终保持在基线水平。
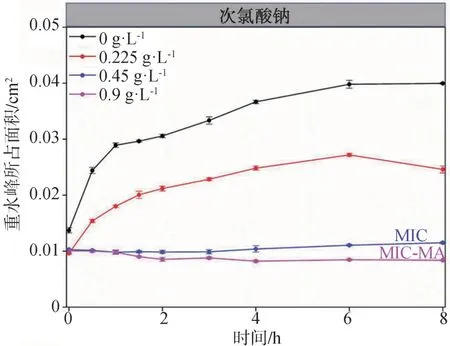
图7 8 h内粪肠球菌ATCC29212在不同浓度次氯酸钠作用下重水峰所占面积的时间梯度曲线Fig 7 Temporal dynamics of C-D ratio of Enterococcus faecali s ATCC29212 under different concentrations of NaClO in 8 h
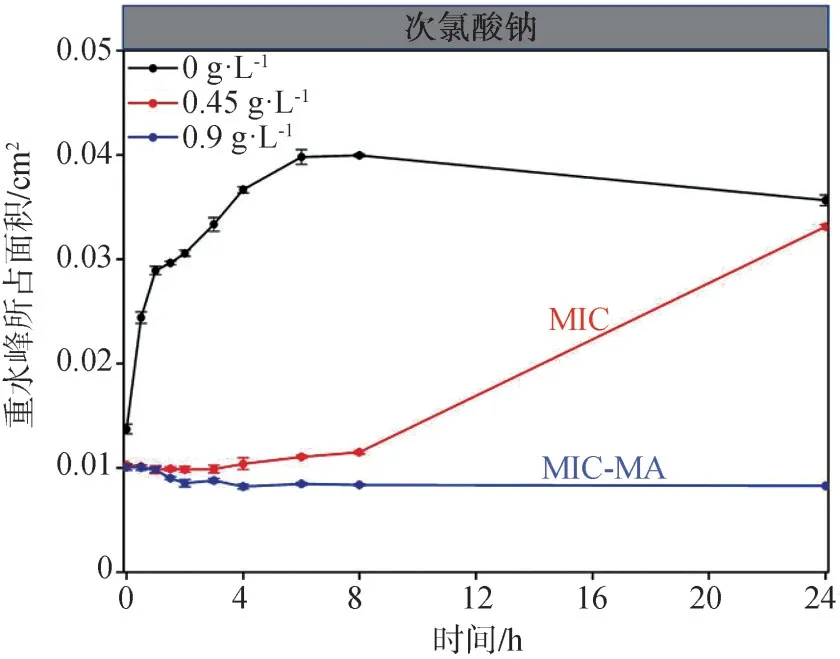
图8 24 h内粪肠球菌ATCC29212在不同浓度次氯酸钠作用下重水峰所占面积的时间梯度曲线Fig 8 Temporal dynamics of C-D ratio of Enterococcus faecali s ATCC29212 under different concentrations of NaClO in 24 h
3 讨论
本研究测定了次氯酸钠对粪肠球菌ATCC-29212生长及代谢的影响,建立了抗菌剂对细菌代谢活性的作用模型,评价了重水拉曼技术的先进性、优越性及可靠性,为后期评价抗菌剂对细菌作用效能等方面的研究提供了新思路及理论依据。
传统药物评价系统多是依赖细胞生长的、微生物群体水平上的检测手段,不仅耗时长、对难以培养的细菌束手无策、忽略了细胞间的异质性是产生耐药性的基础,而且无法研究微生物群体中小部分NGMA状态的持留菌细胞。持留菌是细菌中普遍存在的,处于休眠状态的一类特殊小亚群。它们通过降低代谢活性和生长速率,进入代谢性休眠的非分裂状态来抵抗致死浓度抗菌剂的威胁,维持自身的生存,其代谢活动随着外界环境的变化而变化[10]。持留菌对逆境的不应答性和代谢活动的变化使其能够耐受不利环境而存活,这种细菌的持留性在感染的复发及慢性感染中扮演着重要角色[11-12],而且与细菌耐药性的增加有关[5,13],它们的存在增加了细菌感染治疗的难度。若粪肠球菌以低代谢活性的状态在根管中长时间存留,则可能导致根管治疗失败及难治性根尖周炎的发生[14-16]。因此,停留在抑制细菌生长层面的研究已无法满足现代化临床治疗的需要。
随着细菌耐药问题的日益严峻,人们急需新型抗菌剂及新的药物评价手段来帮助临床合理用药。目前,单细胞技术评价细菌对药物刺激的反应主要是通过荧光标记法,通过研究某个基因以及下游表达产物在药物刺激下的表型来评价药物作用效果。而荧光标记技术需要外源性标记物,会干扰细胞正常生理功能。单细胞拉曼技术虽无需外源性标记且能够反映细胞分子生物学构成,但拉曼光谱也存在着对细胞基因学背景、生理学状态及环境因素等极度敏感等缺陷。因此,本课题组发展了一种重水同位素标记技术与单细胞拉曼技术联合应用的技术手段,基于抗菌剂作用下细菌对重水的代谢差异,在单细胞水平上揭示细菌代谢活性的信息,实现对抗菌剂作用效能的快速判定,评价药物作用效果。
重水中的D+能够被有代谢活性的微生物细胞通过置换NADPH中的H+来合成细胞内的大分子物质,从而在拉曼图谱中2 040~2 300 cm-1的区域出现重水峰,通过分析重水峰所占面积即可表征药物作用后细菌单细胞水平上的代谢活性,评价药物抑菌效能[6-7]。不仅如此,单细胞拉曼技术还具有非常广泛的应用前景,拉曼图谱理论上可以涵盖细胞内全部物质的图谱,尤其是600~1 800 cm-1的“指纹区”涵盖着丰富的生物信息,根据不同峰的变化可以实现对细胞类型的快速区分或细胞对不同刺激反应的区别和分类[17]。
重水拉曼技术作为一种评价抗菌剂对目标微生物的代谢抑制效果的技术手段,采用重水作为标记物,其特点为不依赖细菌生长、快速、定量、无损、高通量。细菌在含重水的培养基中培养0.5 h即可测得明显重水峰,8 h内即可快速鉴定筛选对目标菌株有效的抗菌剂。与传统依赖细胞生长的药物评价方法相比,可更快更准确地评估药物作用后细菌细胞的代谢水平,降低疾病的复发率[7,18],为持留菌的临床防治提供新思路。
本研究探究了粪肠球菌ATCC29212在不同浓度重水中的生长状态及对重水的吸收规律,结果显示,8 h内培养基中重水浓度为30%时,粪肠球菌ATCC29212的生长状态不会受到抑制(P>0.05),细胞可稳定代谢重水,在拉曼图谱2 040~2 300 cm-1区域出现明显重水峰,且重水峰的时间变化趋势易被检测到,因此选取30%浓度重水用于重水拉曼技术定量检测抗菌剂对粪肠球菌ATCC-29212抑菌效能的研究。后续实验评价了次氯酸钠对粪肠球菌ATCC29212的抑菌效能,通过肉汤稀释法测定了其MIC,基于重水拉曼技术测定其MICMA,结果显示,MIC-MA值为MIC值的2倍。往期研究也得到了类似结果,Tao等[7]在探究口腔抑菌药物对变异链球菌抑菌效果时发现,氟化钠与氯己定对变异链球菌的MIC-MA值均高于MIC值,分别为3×MIC和2×MIC。证明药物在传统MIC浓度时虽抑制了细胞生长,但仍不能完全抑制目标细菌的代谢活性,24 h时该菌代谢活性的大幅回升也证明了这一点,细胞仍可进行代谢活动从而对人体产生危害;而在MIC-MA浓度下,细菌细胞的生长与代谢在一定时间内均被完全抑制。这充分显示了重水拉曼技术对于研究不生长但有代谢活性细胞的独特优势。
本研究发现,即使是较高的MIC-MA浓度也远低于次氯酸钠的临床常用浓度,但这一实验数据是在细菌纯培养条件下获得的,而牙髓感染通常是多种细菌导致的混合感染[19]。细菌在根管系统中主要以生物膜的形式存在,由于生物膜独特的三维立体结构和其中因受到营养物质限制而处于缓慢生长或不生长状态的细胞等因素[20],导致以生物膜形式存在的细菌较浮游菌的耐药性强100~1 000倍[21]。本实验仅以次氯酸钠对浮游状态的粪肠球菌ATCC29212的抑菌效能为例,通过单细胞拉曼光谱实时探讨了药物的抗菌特性,建立了重水拉曼技术对抗菌剂作用效果评估的模式体系。后续重水拉曼技术凭借其快速、准确的突出优点,可作为一种普适性的、无损且定量的抗菌剂评价手段,进一步研究多菌种生物膜状态下菌群对抗菌剂的反应,以更好地指导临床合理用药,避免高浓度用药及药物滥用对人体的不良反应、减少耐药菌株的产生,为精准医疗奠定基础。
利益冲突声明:作者声明本文无利益冲突。

