肿瘤特异性CD8+ T 细胞在三阴性乳腺癌免疫治疗中的价值研究
王月鹏
TNBC 是乳腺癌的一种分型,占比约为10%~17%,主要临床特点为孕激素受体(PR)、雌激素受体(ER)以及人表皮生长因子受体-2(HER-2)表达为阴性[1]。根据临床资料显示,发病患者年龄较小,病情进展快速,且转移率高。目前针对TNBC 患者免疫治疗是重要研究方向,临床试验效果具有突出优势。肿瘤特异性T细胞在肿瘤细胞行为中起到促进生长和清除的作用,是免疫治疗中的重要观察指标[2]。肿瘤细胞在治疗期间通过突变和间质细胞作用,可躲避清除,造成癌细胞转移。CD8+T 细胞在其中具有灭杀肿瘤细胞的重要作用,为了研究免疫治疗中CD8+T 细胞的临床价值,本文于本院2019 年1 月~2020 年1 月的患者癌组织中,随机选取88 例进行分析,报告如下。
1 资料与方法
1.1一般资料 选取2019 年1 月~2020 年1 月本院收治的88 例患者的癌组织为样本,随机分为对照组与观察组,各44 例。并于两组患者中各随机抽取22 例取癌旁组织(共44 例)作对照。对照组中,女44 例,年龄(50.48±3.62)岁;根据WHO 分级,Ⅰ~Ⅱ级22 例,Ⅲ级22 例。观察组中,女44 例,年龄(51.62±3.50)岁;根据WHO 分级,Ⅰ~Ⅱ级21 例,Ⅲ级23 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准 纳入标准:①对照组患者均经过组织学及免疫组化检查,确诊为非TNBC 患者;②观察组确诊为TNBC 患者[3];③对本研究知情;④两组患者预估生存期均>1 年,配合度高,全程参与本研究。排除标准:①已经出现远端转移的患者;②患有合并其他部位肿瘤的患者;③中途退出,不配合本研究的患者。
1.3方法 癌旁组织取患者肿瘤边缘5 cm 外的正常组织。使用免疫组化染色处理,制作切片,进行抗原修复。经过孵育染色后,在显微镜下观察。由2 名高年资病理科医师进行评估,得出统一结论。
1.4观察指标及判定标准 ①对比两组及癌旁组织中CD8+T 细胞表达结果。根据免疫组化评价标准[4],通过显微镜观察染色阳性肿瘤间质细胞占比,统计视野内阳性占比。通过计数法进行免疫组织化学的评价,按照计分制,0 分:0~5%;1 分:6%~25%;2 分:26%~50%;3 分:51%~75%;4 分:76%~100%。根据染色情况进行计分,和背景颜色一致,0 分;呈现淡黄色,1 分;呈现棕黄色,2 分;呈现棕褐色,3 分。两次分数相乘后为最终评分,≥2 分,为阳性;<2 分,为阴性。②对比两组WHO 分级和CD8+T 细胞表达水平的关系。③对比两组复发或转移预后效果和CD8+T 细胞表达水平的关系。
1.5统计学方法 采用SPSS23.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1两组及癌旁组织中CD8+T 细胞表达结果对比观察组与对照组CD8+T 细胞表达阳性率对比,差异无统计学意义(P>0.05)。观察组与对照组CD8+T 细胞表达阳性率均高于癌旁组织,差异有统计学意义(P<0.05)。见表1。

表1 两组及癌旁组织中CD8+ T 细胞表达结果对比[n(%)]
2.2两组WHO 分级和CD8+T 细胞表达水平的关系对比 观察组中,WHOⅠ~Ⅱ级患者的癌组织中CD8+T 细胞阳性率明显高于WHOⅢ级患者,差异有统计学意义(P<0.05)。对照组中,WHOⅠ~Ⅱ级患者的癌组织中CD8+T 细胞阳性率与WHOⅢ级患者对比,差异无统计学意义(P>0.05)。见表2。
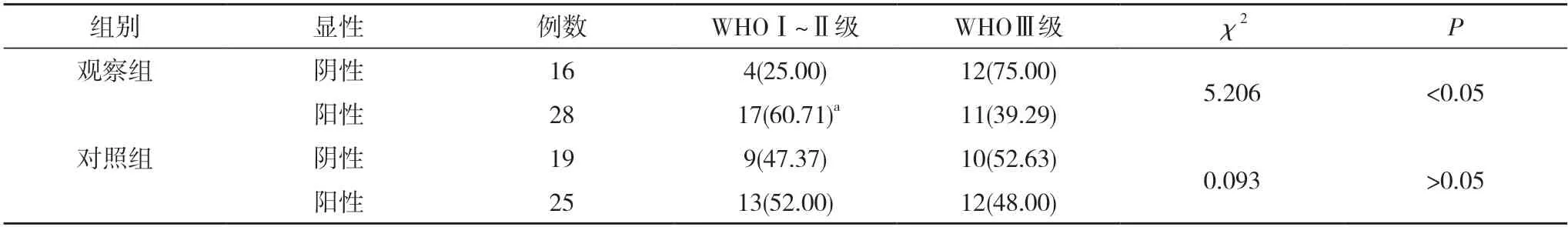
表2 两组WHO 分级和CD8+ T 细胞表达水平的关系对比[n(%)]
2.3两组复发/转移预后效果和CD8+T 细胞表达水平的关系对比 观察组中,无复发或转移患者的癌组织中CD8+T 细胞阳性率明显高于存在复发或转移的患者,差异有统计学意义(P<0.05)。对照组中,无复发或转移患者的癌组织中CD8+T 细胞阳性率与存在复发或转移患者对比,差异无统计学意义(P>0.05)。见表3。
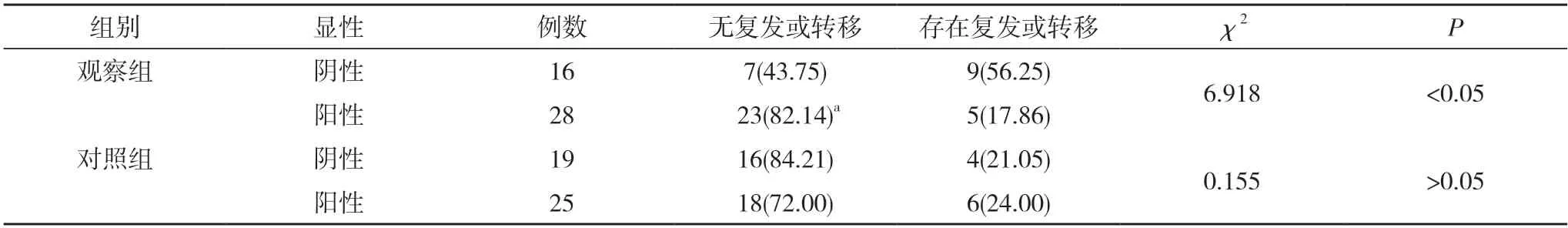
表3 两组复发/转移预后效果和CD8+ T 细胞表达水平的关系对比[n(%)]
3 讨论
肿瘤发病和进展都和人体免疫系统关系密切,肿瘤发展和转移也受到免疫效益影响。其中肿瘤特异性淋巴细胞起到关键作用,和抗肿瘤治疗关系密切[5]。其中CD8+T 细胞具有肿瘤抗原特异性,能够对肿瘤细胞起到杀伤作用。肿瘤特异性CD8+T 细胞在淋巴细胞浸润中占据60%,在免疫治疗和肿瘤疫苗研发中广泛应用[6]。目前已经有研究证实,CD8+T 细胞可以在微环境中对肿瘤细胞靶向杀伤,从而发挥出抗肿瘤的作用[7]。也有研究指出,CD8+T 细胞数量和乳腺癌患者的生存期存在正相关关系[8]。
TNBC 患者接受免疫治疗通过维持人体免疫循环系统,恢复正常的免疫功能,从而达到抗肿瘤作用,从而达到清除或控制肿瘤的效果。目前以PD-1/PD-L1为靶点进行免疫治疗较为常见,通过和B7 球蛋白配体结合,降低T 细胞活性,激活T 淋巴细胞以及B 淋巴细胞等。有研究指出,在TNBC 细胞中可见PD-1/PD-L1 表达。在肿瘤细胞微环境中,T 细胞表达PD-1分子结合肿瘤细胞表达的PD-L1,从而激活PD-1 通路,抑制T 细胞杀灭肿瘤细胞,造成肿瘤细胞免疫逃逸。给予PD-1/PD-L1 抑制剂进行免疫治疗,阻断PD-1 和PD-L1 结合,从而提高人体抗肿瘤机制,达到治疗作用。过继性免疫疗法是将具备特异免疫的淋巴细胞输入给患者,提高患者抗肿瘤免疫力。巨噬细胞、杀伤细胞以及CD8+T 细胞则是常见的效应细胞,具有特异性免疫力[9]。最常用的就是CD8+T 细胞,通过体外筛选,选出具备靶向识别作用的CD8+T 细胞,或者直接对CD8+T 细胞受体序列进行改变,实现靶向识别,能够嵌合抗原受体。但由于经过筛选后的CD8+T 细胞进入人体后,并不能定居于实体瘤,抗肿瘤效果不佳[10]。但目前已经有大量研究证明,CD8+T 细胞和患者预后关系密切,随着CD8+T 细胞数量增加,患者预后效果越好。因此本研究选择TNBC 患者和非TNBC 患者体内CD8+T 细胞的表达情况展开研究,发现观察组与对照组CD8+T 细胞表达阳性率均高于癌旁组织,差异有统计学意义(P<0.05)。证实乳腺癌患者CD8+T 细胞表达水平显著高于健康人群,但在不同分型中,CD8+T细胞表达并无明显差异。
CD8+T 细胞表达和TNBC 患者预后有密切关联,有研究指出,在TNBC 患者中CD8+T 细胞表达水平越高,对应着患者无复发生存期越长,且临床分期更好[11]。本研究证实,观察组中,WHOⅠ~Ⅱ级患者的癌组织中CD8+T 细胞阳性率明显高于WHOⅢ级患者,差异有统计学意义(P<0.05)。对照组中,WHOⅠ~Ⅱ级患者的癌组织中CD8+T 细胞阳性率与WHOⅢ级患者对比,差异无统计学意义(P>0.05)。可见在TNBC 患者中,随着CD8+T 细胞表达水平降低,患者病理分期恶化的可能性更高。在WHO 分级低,患者生存期长时,恶性程度低,CD8+T 细胞表达水平更高,患者具有更好的预后效果[12]。CD8+T 细胞表达水平和预后效果具有一致性,本研究证实,观察组中,无复发或转移患者的癌组织中CD8+T 细胞阳性率明显高于存在复发或转移的患者,差异有统计学意义(P<0.05)。对照组中,无复发或转移患者的癌组织中CD8+T 细胞阳性率与存在复发或转移患者对比,差异无统计学意义(P>0.05)。证实CD8+T细胞表达水平和TNBC 患者恶性程度以及预后效果有密切关系,CD8+T 细胞浸润越多,表示TNBC 患者的预后越好,而在非TNBC 患者中并未表现出这一关联性。
综上所述,在TNBC 患者中CD8+T 细胞表达较高,阳性表达越高患者WHO 分级越低,复发、转移率越低,CD8+T 细胞表达水平和TNBC 患者病理特征、恶性程度关系密切,在非TNBC 患者中并无这一关系。临床上对CD8+T 细胞表达进行监控,能够在一定程度上预测TNBC 患者的预后和病情进展。

