不同浓度氯化钙浸种处理对水稻防御酶活性和抗褐飞虱的影响
吴小保, 邓倩倩, 宋 佳, 王 骏, 叶 茂,*
(1.贵州大学昆虫研究所, 贵阳 550025; 2.贵州省山地农业病虫害重点实验室, 贵阳 550025;3.农业部贵阳作物有害生物科学观察实验站, 贵阳 550025)
褐飞虱Nilaparvatalugens属半翅目(Hemiptera)飞虱科(Delphacidae),是我国及东南亚稻区的主要害虫,以成、若虫群集于稻株基部,用口针刺吸茎叶组织汁液,损耗稻株养分,使谷粒不饱满,千粒重减轻,为害严重时引起稻株基部变黑、导致稻株瘫痪倒伏(李春凤等, 2019)。目前施用化学农药仍是防治褐飞虱的主要手段,长期连续或不合理施用已导致褐飞虱对很多种杀虫剂产生了抗药性(王彦华和王鸣华, 2006)。
植物对昆虫的防御有“组成型”和“诱导型”之分,其中组成型防御反应是指植物在受害虫攻击前就存在的物理和化学的防御特征,诱导型抗性则是指植物在遭受植食性昆虫为害或病原微生物侵染后,会迅速启动其防御信号转导,激活植物体内各种诱导防御反应,然后通过生理、生化及形态特征等多方面的变化对虫害或者病害产生抗性(Katarina and Aleksa, 2012)。然而,植物在遇到昆虫袭击后要产生有效的诱导防御需要一段时间,这种诱导的滞后性使得植物可能在这段时间受到严重为害(Frostetal., 2008),为了弥补诱导型抗性的这个弱点,植物逐渐进化形成了诱发抗性机制(defence priming),即当受到某些生物或者非生物环境因子刺激后,植物会进入防御警备状态,提前做好抗虫防御准备(Conrathetal., 2006; 王杰等, 2018),这就好比给植物打了“预防针”,一旦受到害虫袭击时,植物会产生更加快速和强烈的抗虫防御反应(Mauchetal., 2017)。目前已有大量研究发现植食性昆虫的口腔分泌物(Albornetal., 2007; Schmelzetal., 2007)、昆虫产卵(Bandolyetal., 2015)、昆虫自身的气体挥发物(Helmsetal., 2013)、虫害诱导植物挥发物(Erbetal., 2015)、有益微生物如植物促生根际细菌和丛枝菌根真菌(Vanetal., 2008; Songetal., 2013)可以诱发植物抗虫性。此外,一些非金属元素如硅、氮和硒等也能诱发植物对病虫害产生防御,例如,Ye等(2013)发现预先施硅处理的水稻植株,当其遭受稻纵卷叶螟Cnaphalocrocismedinalis为害时,叶片茉莉酸(jasmonic acid, JA)迅速合成,多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase, POD)等防御酶活性显著高于未施硅处理的水稻植株,水稻对稻纵卷叶螟的抗性明显增强;杨浪(2017)发现施硅处理的水稻植株被褐飞虱取食后,叶鞘苯丙氨酸解氨酶(phenylalanline ammonia lyase, PAL)、多酚氧化酶、过氧化物酶和β-1,3-葡聚糖酶(β-1, 3 glucanase,β-1, 3-GA)等防御酶活性显著高于未施硅处理的对照,水稻对褐飞虱的抗性明显增强。一定浓度的重金属元素如镉、铜、锌和镍也可以诱发植物的抗性,如Winter等(2012)发现用含有80 μmol/L铜的营养液培养的玉米植株,当植株遭受草地贪夜蛾Spdopterafrugiperda幼虫取食为害时,根系会快速产生并积累活性氧,叶片JA含量明显增加,诱导植株释放更多的挥发物吸引天敌。有趣的是,Worrall等(2012)发现利用JA浸泡番茄种子,可以诱发增强番茄植株对朱砂叶螨Tetranychuscinnabarinus、烟草天蛾Manducasexta幼虫、桃蚜Myzuspersicae以及灰霉病Botrytiscinerea的抗性,用氨基丁酸(β-amino butryric acid, BABA)浸种处理可以明显增强番茄植株对灰霉病的抗性,并且两种物质浸种处理都不影响番茄植株的生长和发育。
钙是植物生长发育所需的重要营养元素,已有大量研究发现采用叶面喷施和根灌等方法对小麦、水稻等作物外施适宜浓度的钙可以显著提高它们对干旱、高温、低温、盐害以及重金属等不良非生物逆境的抗性(徐芬芬等, 2009; 王鹏等, 2017; Yangetal., 2018; Silveiraetal., 2020)。然而,目前外源钙在调控植物响应生物逆境胁迫方面的研究相对较少,并且主要集中于对植物抗病性方面的研究,例如Debona等(2017)用水培的方法,分别以含有0.26, 2.6和5 mmol/L Ca(NO3)2·4H2O的溶液培养小麦植株,研究结果表明外源钙可以增强细胞壁以抑制稻瘟病侵染和病斑的扩展,更有趣的是外源钙还可以诱导小麦JA, SA和H2O2防御信号转导通路关键基因的表达以及几丁质酶、β-1,3-葡聚糖酶和多酚氧化酶等酶的活性的升高,说明SA和 JA防御信号通路在钙诱导的抗病过程中发挥着重要的作用。在植物抗虫性方面,Zeng等(2020)采用喷施、根灌和浸种方式对菜豆进行外源CaCl2处理均可诱导提高菜豆PAL, 脂氧合酶(lipoxygenase, LOX)和POD等防御酶活性,增强菜豆植株对西花蓟马Frankliniellaoccidentalis的抗性。
利用外源物质诱导提高植物抗逆性,具有抗逆性广、用量小、见效快和效益高等特点,同时又能促进植物的生长发育,是发展可持续农业的一项重要技术。本研究分别用10, 20, 30, 40和50 mmol/L CaCl2溶液浸泡水稻种子,待水稻长至分蘖期时,检测分析不同浓度CaCl2浸种处理对水稻防御酶PAL, POD, PPO和β-1,3-GA活性的诱导以及对褐飞虱存活率的影响,为合理利用外源钙诱导提高田间水稻抗虫性奠定基础。
1 材料与方法
1.1 供试材料
1.1.1植物和昆虫:供试水稻品种为中花11。褐飞虱采自贵州黄平田间种群,实验室人工气候室(温度28±2℃, RH 80%, 光周期14L∶10D)内用感虫水稻品种TN1饲养、繁殖10代以上供实验用。
1.1.2试剂:CaCl2购买于成都金山化学试剂有限公司(www.cdjinshan.com),纯度>96%;钙离子螯合剂乙二醇四乙酸(ethylene glycol tetraacetic acid, EGTA)和离子通道抑制剂氯化镧(lanthanum chloride, LaCl3)够买于北京百奥莱博科技有限公司,纯度>99%; L-苯丙氨酸(L-phenylalanine)、愈创木酚(2-methoxyphenol)购买于索莱宝生物公司(www.solanbio.com),纯度>99%;昆布多糖(laminarin)购买于索莱宝生物公司(www.solanbio.com),纯度>98%;邻苯二酚(catechol)购买于天津市科密欧化学试剂有限公司,纯度>99%。
1.2 水稻浸种处理和褐飞虱取食
1.2.1CaCl2浸种处理:挑选饱满、健康的种子,经10% H2O2消毒10 min后用蒸馏水冲洗3~5次。分别用10, 20, 30, 40和50 mmol/L CaCl2溶液浸种,以不含CaCl2的无菌蒸馏水浸种为对照(CK),48 h后倒掉溶液,将种子放置到培养箱催芽,待水稻种子露白后播种于方形瓷盘中,一周后挑选健康且生长一致的水稻幼苗移栽到塑料杯中,所有水稻幼苗放置于无虫网罩中培养,待水稻长至分蘖期时供实验用。
1.2.2EGTA和LaCl3浸种处理:种子挑选和灭菌方法同1.2.1节。分别用含有1 mmol/L EGTA的CaCl2(20 mmol/L)溶液和含有1 mmol/L LaCl3的CaCl2(20 mmol/L)溶液浸种,对照水稻分别用含有1 mmol/L EGTA和1 mmol/L LaCl3的无菌蒸馏水浸种,浸种方法和水稻植株培养方法同1.2.1节。
1.2.3褐飞虱取食处理:上述各处理水稻植株,待水稻长至分蘖期后,在每株水稻主茎上用parafilm膜制作一个取食袋,再将20头3龄褐飞虱若虫接入取食袋取食24 h。
1.3 褐飞虱存活率的测定
1.2.1和1.2.2节各处理水稻植株主茎接15头2龄褐飞虱若虫,用透明玻璃管(直径30 mm,高300 mm)罩住植株,底部用棉花包住根部固定(保持湿润),顶部用尼龙网封口,每天观察和记录各水稻植株上褐飞虱存活的数量,取食7 d后计算其存活率。各处理20次重复。
1.4 酶活性的测定
1.2.1节各处理水稻植株,每株水稻主茎接20头褐飞虱3龄若虫取食24 h,取被取食叶鞘检测过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶和β-1,3-葡聚糖酶活性。以未经褐飞虱取食的植株为对照。称取水稻叶鞘0.1 g,液氮研磨成粉末,在液氮未挥发前转入离心管,加入相应提取液研磨匀浆后转移至2 mL离心管中,在涡旋振荡仪上涡旋振荡10 s,低温冷冻离心机中12 000 r/min低温(4℃)离心15 min,取上清液(酶液)检测各防御酶活性。每个处理各设6个生物学重复。
1.4.1苯丙氨酸解氨酶(PAL): 参照Xu等(2021)方法进行,稍加修改,在酶标板中依次加入70 μL 0.02 mol/L L-苯丙氨酸,200 μL 0.05 mol/L Tris-HCl(pH 8.8),20 μL酶液(对照加入15 μL PAL提取液),在40℃水浴中30 min,加入250 μL 5 mol/L HCl终止反应,然后在酶标仪290 nm波长下测定OD值,以OD值变化0.01为一个酶活力单位。
1.4.2过氧化物酶(POD): 参照Xu等(2021)方法,稍加修改,在酶标板中依次加入5 μL 0.1 mol/L pH 7.2的磷酸缓冲液,100 μL 0.1 mol/L愈创木酚,100 μL 0.8% H2O2,5 μL酶液后立即放入酶标仪在470 nm波长下测定OD值,以OD值变化0.01为一个酶活力单位。
1.4.3多酚氧化酶(PPO): 参照Xu等(2021)方法,稍加修改,反应混合液:120 μL 0.05 mol/L pH 5.5磷酸缓冲液,35 μL 0.05 mol/L儿茶酚(邻苯二酚),20 μL酶液;在37℃孵育15 min后,酶标仪测525 nm处OD值。以OD值变化0.01为一个酶活力单位。
1.4.4β-1,3-葡聚糖酶(β-1,3-GA): 0.1 mL粗提取液,0.4 mL 1 mL/mg昆布多糖40℃水浴30 min后,加1 mL DNS试剂,沸水浴10 min,冷却后再加6 mL蒸馏水,在540 nm处测定吸光值,求吸光度差值(A样品-A水),从标准曲线求出产生葡萄糖量。一个酶活力单位(U)定义为每克鲜植物组织每秒产生1 μg葡萄糖的量。
1.5 数据分析
用SPSS 22.0对实验数据进行统计分析,不同处理间的差异显著性用Duncan氏多重比较法分析(P<0.05),用SigmaPlot 12.5软件绘制柱状图。
2 结果
2.1 CaCl2浸种处理对水稻叶鞘苯丙氨酸解氨酶(PAL)活性的影响
研究结果表明,未经褐飞虱若虫取食时,在种子阶段经过各浓度CaCl2浸种处理的水稻植株其叶鞘PAL酶活性之间没有显著差异(P>0.05),而褐飞虱取食24 h后,各浓度CaCl2浸种处理水稻植株叶鞘PAL活性都显著升高(P<0.05),其中水浸种处理的水稻植株(CK)褐飞虱取食后叶鞘PAL活性显著比未被取食的植株高59.27%,而10, 20, 30, 40和50 mmol/L CaCl2浸种处理的水稻植株中,褐飞虱取食后叶鞘PAL活性分别比未经褐飞虱若虫取食的植株高79.30%, 103.09%, 181.29%, 70.86%和109.42%。褐飞虱若虫取食时,30 mmol/L CaCl2浸种处理的水稻植株其叶鞘PAL活性最高,分别比10, 20, 40和50 mmol/L CaCl2浸种处理的高80.08%, 38.44%, 50.90%和73.88%(图1)。双因素方差分析结果表明CaCl2浸种和褐飞虱若虫取食的交互作用显著(P=0.0008),说明褐飞虱取食显著诱导了水稻PAL活性,而CaCl2浸种处理显著增强褐飞虱取食诱导的PAL酶活性。

图1 褐飞虱若虫取食胁迫时不同浓度CaCl2浸种处理对水稻叶鞘中苯丙氨酸解氨酶活性的影响
2.2 CaCl2浸种处理对水稻叶鞘过氧化物酶(POD)活性的影响
未经褐飞虱若虫取食时,各浓度CaCl2浸种处理的水稻植株叶鞘中POD活性之间没有显著差异(P>0.05),而褐飞虱若虫取食24 h后,经过CaCl2和水浸种处理的水稻植株(CK)其叶鞘POD活性都显著升高(P<0.05),其中水浸种处理的水稻植株,褐飞虱取食后其叶鞘POD活性显著比未被取食的植株中的高59.88%,而10, 20, 30, 40和50 mmol/L CaCl2浸种处理的水稻植株, 褐飞虱取食后其叶鞘POD活性显著比未经褐飞虱取食的植株中分别高58.00%, 109.16%, 257.86%, 77.82%和63.61%。褐飞虱若虫取食时,以30 mmol/L CaCl2浸种处理的水稻植株其叶鞘POD活性最高,分别比10, 20, 40和50 mmol/L CaCl2浸种处理的植株中高116.41%, 55.67%, 58.80%和81.45%(图2)。双因素方差分析结果表明CaCl2浸种和褐飞虱取食的交互作用显著(P=0.0000),说明褐飞虱取食显著诱导了水稻POD活性,而CaCl2浸种处理显著增强了褐飞虱取食诱导的POD活性。

图2 褐飞虱若虫取食胁迫时不同浓度CaCl2浸种处理对水稻叶鞘中过氧化物酶活性的影响
2.3 CaCl2浸种对水稻叶鞘多酚氧化酶(PPO)活性的影响
实验结果显示,未经褐飞虱取食时,各处理的水稻植株叶鞘PPO酶活性之间没有显著差异(P>0.05),而接褐飞虱24 h后,经过CaCl2和水浸种处理的水稻植株(CK)其叶鞘PPO活性都显著升高(P<0.05)。水浸种处理的水稻植株中,褐飞虱取食后叶鞘PPO活性显著比未被取食的植株中的高83.30%。10, 20, 30, 40和50 mmol/L CaCl2浸种处理的水稻植株中, 褐飞虱取食后叶鞘PPO活性显著比未经褐飞虱取食的植株中分别高273.00%, 166.12%, 366.30%, 219.07%和114.15%。褐飞虱若虫取食时,10和30 mmol/L CaCl2浸种处理的水稻植株PPO活性最高,10 mmol/L CaCl2浸种处理的水稻植株,其叶鞘PPO活性分别比20, 40和50 mmol/L CaCl2浸种处理的高25.77%, 31.66%和82.53%, 30 mmol/L CaCl2浸种处理的水稻植株,其叶鞘PPO活性比20, 40和50 mmol/L CaCl2浸种处理的分别高30.25%,36.35%和89.03%(图3)。双因素方差分析结果表明CaCl2浸种和褐飞虱取食的交互作用显著(P=0.0000),说明褐飞虱取食显著诱导了水稻PPO活性,而CaCl2浸种处理显著增强了褐飞虱取食诱导的PPO活性。

图3 褐飞虱若虫取食胁迫时不同浓度CaCl2浸种处理对水稻叶鞘中多酚氧化酶活性的影响
2.4 CaCl2浸种对水稻叶鞘 β-1,3-GA酶活性的影响
研究结果表明,未经褐飞虱若虫取食时,各浓度CaCl2浸种处理的水稻植株叶鞘 β-1,3-GA酶活性没有显著差异(P>0.05),而褐飞虱若虫取食24 h后,经过CaCl2和水浸种处理的水稻植株(CK)其叶鞘β-1,3-GA活性都显著升高(P<0.05)。水浸种处理的水稻植株中,褐飞虱取食后叶鞘β-1,3-GA活性显著比未经褐飞虱取食的植株高26.13%,在10, 20, 30, 40和50 mmol/L CaCl2浸种处理的水稻植株中, 褐飞虱取食后叶鞘 β-1,3-GA活性显著比未经褐飞虱取食的植株分别高48.47%, 56.45%, 51.55%, 30.49%和40.90%。褐飞虱若虫取食时,10和20 mmol/L CaCl2浸种处理对 β-1,3-GA 酶活性的诱导效果较好,其中10 mmol/L CaCl2浸种处理的水稻其叶鞘 β-1,3-GA活性分别比30, 40和50 mmol/L CaCl2浸种处理的高16.17%, 37.05%和33.36%,20 mmol/L CaCl2浸种处理的水稻其叶鞘 β-1,3-GA 活性分别比30, 40和50 mmol/L CaCl2浸种处理的高20.98%, 42.72%和38.88%(图4)。双因素方差分析结果显示CaCl2浸种和褐飞虱取食的交互作用显著(P=0.0150),说明褐飞虱取食显著诱导了水稻 β-1,3-GA活性,而CaCl2浸种处理显著增强了褐飞虱取食诱导的β-1,3-GA活性。

图4 褐飞虱若虫取食胁迫时不同浓度CaCl2浸种处理对水稻叶鞘中β-1,3-葡聚糖酶活性的影响
2.5 不同浓度CaCl2浸种水稻对褐飞虱存活率的影响
褐飞虱2龄若虫取食10, 20和30 mmol/L CaCl2溶液浸种处理的水稻植株7 d后,存活率分别比取食水浸种处理水稻(CK)的低32.68%, 22.54%和30.28%,但取食40和50 mmol/L CaCl2浸种处理的植株后,褐飞虱若虫存活率与取食对照植株的相比无显著差异(P>0.05)(图5: A)。为了进一步验证CaCl2浸种处理水稻对褐飞虱存活率的影响,在20 mmol/L CaCl2溶液浸种以及水浸种的同时分别加入1 mmol/L钙离子螯合剂EGTA和钙离子通道抑制剂LaCl3,待水稻植株长至分蘖期时,检测褐飞虱2龄若虫取食各处理水稻植株后存活率的变化,结果发现,褐飞虱若虫取食水、水+EGTA和水+LaCl3浸种处理过的水稻植株后,其存活率之间无显著差异(P>0.05)(图5: B)。然而,褐飞虱若虫取食20 mmol/L CaCl2浸种处理过的水稻植株7 d后,其存活率显著比取食水浸种处理植株的若虫低32.18%,取食CaCl2+EGTA和CaCl2+LaCl3处理水稻的褐飞虱其存活率分别比取食CaCl2浸种处理水稻植株的高25.80%和22.12%,表明钙离子螯合剂EGTA和钙离子通道抑制剂LaCl3与CaCl2同时浸种处理水稻显著抑制了CaCl2对褐飞虱取食诱导的水稻抗虫性的影响。
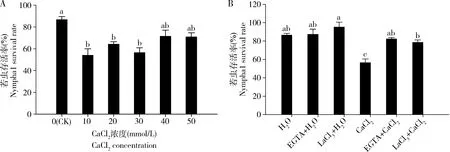
图5 不同浓度CaCl2单独浸种(A)以及20 mmol/L CaCl2分别与1 mmol/L EGTA和LaCl3同时浸种(B)处理7 d对水稻抗褐飞虱的影响
3 结论和讨论
植物的诱导抗性又称获得性免疫,指植物在一定的生物或非生物因子的刺激作用下,通过信号传导激活植物的天然防御机制,涉及到组织、细胞、分子结构与功能的一系列变化,而各种生理生化代谢首先是以防御酶的催化来实现的(王杰等, 2018; 孟琳钦等, 2019; 蒲恒浒等, 2019; 王琦等, 2019)。苯丙氨酸解氨酶(PAL)是植物合成木质素、酚类等次生代谢物质的关键酶(黄珊珊等, 2012),多酚氧化酶(PPO)能将植物中的酚类物质氧化为影响昆虫生长发育的高毒性醌类物质,阻碍昆虫对植物营养的利用,减缓昆虫的生长发育并促使其死亡(雷东锋等, 2004; 田旭涛等, 2013),而过氧化物酶(POD)有助于木质素的合成,强化植物细胞壁,阻碍刺吸式害虫取食(贾贞等, 2004)。这3个防御酶的活性与植物抗虫性密切相关,抗褐飞虱的水稻品种如Rathu Heenati(RH)品种中,褐飞虱取食显著诱导植株PAL酶活性升高(刘裕强等, 2005);吴碧球等(2016)研究表明水稻抗褐飞虱品种IR56遭受褐飞虱胁迫后,叶鞘PAL, POD和PPO活性显著升高,通过回归模型检验后,发现IR56水稻品种植株的PAL, POD和PPO活性与抗褐飞虱的能力成正比。β-1,3-葡聚糖酶(β-1,3-GA)是一种广泛存在于高等植物中的水解酶,与植物的木质素和韧皮部组织都密切相关(李春娟等, 2004; 狄浩, 2013),刺吸式口器害虫烟粉虱Bemisiatabaci和麦双尾蚜Diuraphisnoxia取食可显著诱导β-1,3-GA活性(Van der Westhuizenetal., 1998; 王洪涛等, 2011)。
营养元素氮、钾和硅等,植物生长调节剂如茉莉酸、茉莉酸甲酯、水杨酸甲酯等可以诱导增强植物防御酶的活性,从而增强植物抗虫性(Yeetal., 2013; 丛春雷等, 2014; 吴碧球等, 2016; 杨浪, 2017; 蒲恒浒等, 2019; 徐松鹤等, 2019)。钙是植物重要的营养元素,Zeng等(2020)分别用10, 30和50 mmol/L CaCl2对菜豆进行浸种、根灌和叶片喷施处理,发现3种处理方式都能诱导菜豆叶片POD, β-1,3-GA和LOX的活性,每种处理方式中均以10 mmol/L CaCl2的诱导效果较好。余朝阁等(2012)发现用20 mmol/L CaCl2喷施番茄植株叶片可以显著诱导PAL, POD和PPO活性,增强植株对灰霉病的抗性,而当喷施Ca2+螯合剂EGTA和钙通道抑制剂LaCl3时,植株对灰霉病的抗性被不同程度地抑制。本研究发现褐飞虱取食显著诱导了水稻PAL, POD, PPO和 β-1,3-GA活性(图1-4),说明这些酶在水稻防御褐飞虱的过程中发挥着重要作用。此外,本研究还发现,在没有褐飞虱取食胁迫的情况下,CaCl2浸种处理的水稻植株其叶鞘PAL, POD, PPO和 β-1,3-GA 活性与水浸种处理的对照植株相比均没有明显差异,然而当其遭受褐飞虱取食时,这些防御酶的活性升高的幅度都高于被取食的对照植株升高的幅度(图1-4),该结果表明经过CaCl2浸种处理的水稻,当其受褐飞虱为害时会产生更强烈的防御反应。但不同浓度CaCl2对不同防御酶活性的诱导效果不同,其中30 mmol/L CaCl2浸种处理对PAL和POD活性的诱导效果最好(图1和2),10和30 mmol/L CaCl2浸种处理对PPO活性的诱导效果最好(图3),10和20 mmol/L CaCl2浸种处理对β-1,3-GA活性的诱导效果最好(图4),可见对于不同作物和不同害虫而言,CaCl2处理方式和浓度对作物防御酶的诱导效果存在一定差异。
褐飞虱存活率是水稻植株抗性的重要指标(Yangetal., 2021),通过检测褐飞虱若虫的存活率,我们发现褐飞虱若虫取食10, 20和30 mmol/L CaCl2浸种处理水稻植株7 d后,其存活率均显著低于取食对照植株的褐飞虱,但取食40和50 mmol/L CaCl2浸种处理的植株后,褐飞虱若虫的存活率无显著差异(图5: A),表明不同浓度CaCl2浸种处理水稻对褐飞虱存活率的影响不同,中低浓度的CaCl2处理的水稻植株对褐飞虱的抗性较强。在非生物逆境中,研究者们也发现中低浓度外源钙处理显著增强了植物对盐胁迫和干旱胁迫的抗性,如Roy等(2019)在水稻种子阶段用10和15 mmol/L CaCl2浸泡处理,发现其浸种处理均能提高植物的耐盐性,但低浓度10 mmol/L CaCl2浸种处理的效果更好;同样地,蔡喜悦等(2013)发现高浓度的Ca2+抑制了复羽叶栾树Koelreuteriabipinnata的发芽率,中低浓度的Ca2+(10和15 mmol/L)改善了其发芽特性,同时增强复羽叶栾树K.bipinnata抗旱性的能力强于高浓度的CaCl2处理。
EGTA和LaCl3分别是钙离子螯合剂和钙离子通道抑制剂,Ding等(2019)利用EGTA和LaCl3喷施处理茶树,发现EGTA和LaCl3阻碍了植株中的Ca2+信号的传递,茶树抗寒能力减弱,由此说明茶树抗寒能力与Ca2+信号的传递密切相关。刘勇和郅军锐(2018)的研究发现叶面喷施50 mmol/L CaCl2明显增强了菜豆对西花蓟马的抗性,而EGTA和LaCl3抑制了外源钙对菜豆抗虫性的诱导。Wang等(2021)发现经过氯化钙浸种处理的小麦植株,当其遭受麦二叉蚜Schizaphisgraminum取食时,叶片钙调素蛋白活性,钙离子含量、钙信号通路TaCaM基因和胼胝质合成基因(TaGSL2,TaGSL10和TaGSL19)表达上调幅度都明显高于水浸种处理的对照植株,表明内源钙信号传递是外源钙诱导增强小麦抗虫性的关键。本研究发现取食EGTA+CaCl2和LaCl3+CaCl2浸种处理水稻植株的褐飞虱若虫,其存活率均高于取食CaCl2浸种处理植株的若虫(图5: B),表明EGTA和LaCl3显著抑制了CaCl2诱导的水稻抗虫性,表明在种子阶段水稻内源钙信号传递在外源钙诱导水稻抗褐飞虱的过程中扮演着重要角色。
综上,本研究结果表明通过浸种方式对水稻进行外源钙处理,可以使水稻植株进入防御警备状态,当水稻遭受褐飞虱取食为害时,水稻会产生更高的抗虫防御酶活性,增强水稻对褐飞虱的抗性,然而氯化钙诱发增强水稻抗虫性的分子机理还有待深入研究。

