发情相关基因在小尾寒羊性腺轴组织中的表达谱研究
陈玉林 刘玉芳 储明星


摘要 [目的]探究绵羊发情相关基因KITLG、MAPK1、NOTCH4和NR5A2在小尾寒羊性腺轴组织(大脑、小脑、下丘脑、垂体、子宫、卵巢、输卵管)中的表达差异,为阐明绵羊高繁殖力的分子机理提供理论依据。[方法]以FecB BB型小尾寒羊为研究对象,利用实时荧光定量PCR检测上述4个基因在小尾寒羊发情周期(黄体期和卵泡期)性腺轴相关的7种组织中的表达差异。[结果] KITLG基因在小尾寒羊卵泡期输卵管组织中的表达量最高,其在黄体期小脑与垂体中的表达量显著高于卵泡期(P<0.05);MAPK1基因在小尾寒羊卵泡期大脑组织中的表达量最高且极显著高于黄体期(P<0.01),其在黄体期下丘脑和小脑组织中的表达量显著高于卵泡期(P<0.05),而其在卵泡期输卵管组织中的表达量显著高于黄体期(P<0.05);NOTCH4基因在小尾寒羊黄体期下丘脑中的表达量最高,而其在黄体期子宫中的表达量显著高于卵泡期(P<0.05);NR5A2基因在小尾寒羊黄体期卵巢组织中的表达量最高,其在黄体期子宫组织中的表达量显著高于卵泡期(P<0.05)。[结论]KITLG、MAPK1、NOTCH4和NR5A2基因可作为潜在的候选基因来调控绵羊繁殖力。该研究结果为进一步阐明绵羊高繁殖力的分子机理提供了新思路。
關键词 绵羊;发情相关基因;性腺轴;组织表达
中图分类号 S 826 文献标识码 A 文章编号 0517-6611(2022)01-0092-04
doi:10.3969/j.issn.0517-6611.2022.01.023
Study on the Expression Profile of Estrus-related Genes in the Gonadal Axis Tissues of Small Tail Han Sheep
CHEN Yu-lin1,2, LIU Yu-fang1,2, CHU Ming-xing1
(1.Key Laboratory of Animal Genetics, Breeding and Reproduction of Ministry of Agriculture and Rural Affairs, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193;2. College of Life Science and Food Engineering, Hebei University of Engineering, Handan, Hebei 056001)
Abstract [Objective] To explore the expression difference of estrus-related genes KITLG, MAPK1, NOTCH4 and NR5A2 in the gonadal axis tissues (brain, cerebellum, hypothalamus, pituitary, uterus, ovary, fallopian tube) of Small Tail Han Sheep, and provide the theoretical basis for clarifying the molecular mechanism of high-fertility sheep. [Method]Using FecB BB type Small Tail Han Sheep as the research objects, real-time quantitative PCR was used to detect the expression difference of the four genes in seven kinds of tissues related to the gonadal axis of Small Tail Han Sheep in the estrus period(luteal phase and follicular phase). [Result]The expression level of KITLG gene in the oviduct tissues of Small Tail Han Sheep in the follicular phase was the highest, its expression levels in the cerebellum and pituitary tissues of Small Tail Han Sheep in the luteal phase were significantly higher than that in the follicular phase (P<0.05).The expression level of MAPK1 gene in the brain tissues of Small Tail Han Sheep in the follicular phase was the highest, which was extremely significantly higher than that in the luteal phase(P>0.01). Its expression levels in hypothalamus and cerebellum tissues of Small Tail Han Sheep in the luteal phase were significantly higher than that in the follicular phase (P<0.05), and its expression level in fallopian tube tissues in the follicular phase was significantly higher than that in the luteal phase(P<0.05). The expression level of NOTCH4 gene in the hypothalamus of Small Tail Han Sheep in the luteal phase was the highest, and the expression level in uterus tissues in the luteal phase was significantly higher than that in the follicular phase (P<0.05). [Conclusion]KITLG, MAPK1, NOTCH4 and NR5A2 genes might be used as potential candidate genes to regulate the fecundity of sheep. The research provided a new idea for further clarifying the molecular mechanism of sheep’s high fertility.
Key words Sheep;Estrus-related genes;Gonadal axis;Tissue expression
基金项目 国家自然科学基金项目(31772580);国家肉羊产业技术体系专项(CARS-38);中国农业科学院科技创新工程项目(CAAS-ZDRW202106,ASTIP-IAS13);河北省自然科学基金青年项目(C2019402261)。
作者简介 陈玉林(1997—),男,河南驻马店人,硕士研究生,研究方向:动物遗传育种。
通信作者:刘玉芳,讲师,博士,从事动物遗传育种研究;储明星,研究员,博士,从事羊优异繁殖性状分子机理研究。
收稿日期 2021-05-19
如何提高绵羊的繁殖力一直是畜牧业关注的问题[1]。发情期是动物繁殖的重要时期,分为卵泡期和黄体期,卵母细胞必须经过卵泡期的发育才能成熟进而排卵,黄体期黄体的生长发育则释放黄体酮等激素,为母体妊娠提供适宜的环境,为进一步的繁殖做准备[2]。绵羊的繁殖力受到其發情方式的直接影响,常年发情绵羊的繁殖力通常比季节性发情绵羊有更大的优势[3]。因此,研究绵羊的发情机制及其如何影响绵羊的繁殖力一直是一个备受关注的问题。小尾寒羊作为一种优质的常年发情绵羊,其高繁殖力的特点使其成为研究绵羊发情机制及繁殖力机制的完美模型。笔者筛选出几个与动物发情期相关的基因,旨在为阐明绵羊发情机制提供一定的理论基础,为提高绵羊繁殖力提供新的研究思路。
KIT配体(KITLG)是c-KIT跨膜酪氨酸激酶受体(KIT)的配体,也被称为干细胞因子、钢铁因子或肥大细胞生长因子。动物模型显示,颗粒细胞衍生的KITLG与卵母细胞、卵泡膜细胞衍生的KITLG之间的相互作用涉及卵母细胞和卵泡发育的各个方面,包括卵巢中原始生殖细胞的形成、原始卵泡的激活、卵母细胞的存活和生长、颗粒细胞的增殖、膜细胞的募集和减数分裂停滞的维持[4]。MAPK1是MAPK(丝裂原活化蛋白激酶)的成员之一,在MAPK通路中发挥其作用,是卵泡发育的一条重要途径。MAPK通路的激活可以促进瘦素诱导的卵母细胞成熟[5]。NOTCH4是一个保守的跨膜受体家族成员,可通过与一些特定的配体相互作用调节细胞,在许多发育过程中起关键作用,影响细胞分化、增殖和凋亡[6-8]。Hernandez等[9]研究表明NOTCH4通过Notch信号通路发挥促进黄体细胞活力和类固醇合成的作用。NR5A2也被称为胎儿蛋白转录因子(FTF)、肝脏受体同源1(LRH-1),是核激素受体(NR)转录因子亚家族的成员,NR5A2与哺乳动物的类固醇合成、细胞增殖、卵泡发育、排卵和生育等多种过程有关[10]。
笔者利用实时荧光定量PCR(qPCR)技术对上述发情期相关候选基因在绵羊不同发情期(卵泡期和黄体期)性腺轴组织的表达情况进行检测,为进一步揭示KITLG、MAPK1、NOTCH4和NR5A2基因的功能和解析绵羊繁殖机制提供理论基础。
1 材料与方法
1.1 试验样品的收集
随机选取3周岁健康、经产的空怀小尾寒羊卵泡期和黄体期母羊各3只,于2017年10月饲养于天津市畜牧兽医研究所试验羊场,所有试验羊的饲养环境和饲料均相同。2017年11月对试验羊进行屠宰,取其大脑、小脑、下丘脑、垂体、子宫、卵巢和输卵管,取样后迅速装入1.8 mL RNase-Free冻存管中(最大样品量为冻存管体积的2/3)。所有样品采集要在屠宰后30 min内完成,样品采集完后迅速放入液氮中冷冻保存,用干冰带回实验室,放入-80 ℃冰箱中冷冻保存,备用。
1.2 RNA的提取及质量检测
将采集的小尾寒羊卵泡期和黄体期性腺轴7种组织研磨后,用Trizol试剂(Invitrogen,美国)进行裂解,此后按照动物组织RNA提取试剂盒(天根,北京)的说明书进行总RNA的提取,用1.0%琼脂糖凝胶电泳和Nanodrop 2000检测提取RNA的质量和浓度。经检验合格的组织总RNA于-80 ℃下保存备用。
1.3 引物设计
根据GenBank提供的绵羊KITLG、MAPK1、NOTCH4、NR5A2基因序列(登录号分别为NM_001267888.1、XM_027956867.1、XM_027958770.1、NM_001246280.1)信息,并使用Primer Premier 5.0软件进行引物设计,以RPL19为内参基因。引物由北京天一辉远生物科技有限公司合成。各引物浓度均为10 μmol/L,引物序列详细信息见表1。
1.4 cDNA的合成
利用TaKaRa反转录试剂盒(PK0445)合成cDNA,反转录体系如下:1.0 μL反转录混合引物,1.0 μL Oligo dT引物,1.0 μL随机引物,4.0 μL荧光定量缓冲液,1.0 μL RNA,12.0 μL双蒸水,全程在冰上操作。反应条件:37 ℃ 15 min,85 ℃ 5 s,将反转录完成后的cDNA产物稀释后,用持家基因RPL19进行PCR检测,质量合格后-20 ℃下保存,以备检测基因mRNA表达。
1.5 实时荧光定量PCR
1.5.1 实时荧光定量PCR体系及反应程序。
实时荧光定量PCR反应体系(总体积20 μL):10.0 μL荧光定量Ex Taq引物Ⅱ,0.8 μL上游引物,0.8 μL下游引物,2.0 μL cDNA 模板,6.4 μL双蒸水。PCR反应程序:95 ℃预变性5 min;95 ℃变性5 s,60 ℃ 30 s,40个循环。反应结束后进行熔解曲线分析。
1.5.2 标准曲线的建立。
将cDNA样本5倍稀释后,进行2倍梯度稀释后获得5个浓度梯度(1、1/2、1/4、1/8、1/16)的cDNA样品。用这些cDNA为模板,对目的基因和持家基因进行荧光定量PCR,以浓度梯度的对数值(以10为底数)为横坐标,以检测所得Ct值为纵坐标,绘制目的基因和持家基因的标准曲线。
1.5.3 实时荧光定量检测与数据分析。
使用Roche Light Cycler480 Ⅱ 型荧光定量PCR仪进行荧光定量检测,使用Excel软件进行数据处理,采用2-△△Ct的方法计算各基因的相对表达量。获得的表达量数据使用SPSS 19.0统计软件进行独立样本t检验。
2 结果与分析
2.1 RNA的提取
提取后的总RNA用1%琼脂糖凝胶电泳进行检测,结果发现28S条带明显比18S条带更亮,且条带完整性较好,表明该RNA质量合格,能用于后续试验。
2.2 4个基因在各组织中表达分析
2.2.1 KITLG基因组织表达检测。
qPCR结果显示,KITLG基因在7种组织中均有表达,其在小尾寒羊卵泡期输卵管中的相对表达量最高,其在黄体期小脑与垂体组织中的相对表达量均大于卵泡期且差异显著(P<0.05),在其他组织中的相对表达量差异均不显著(P>0.05)(图1)。
2.2.2 MAPK1基因组织表达检测。
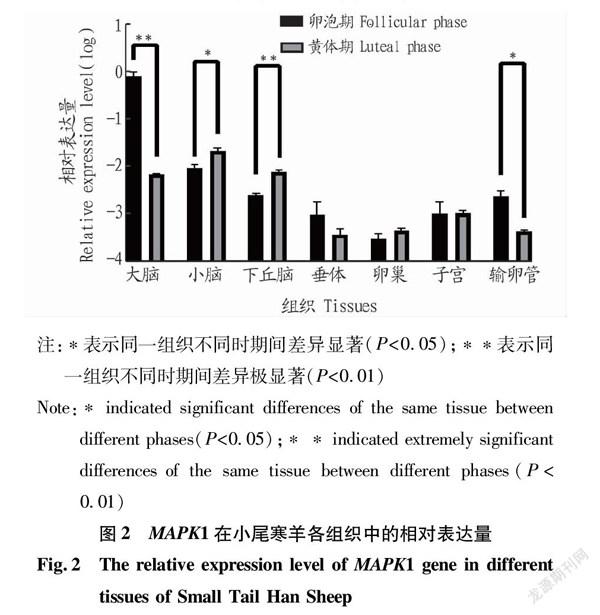
MAPK1基因在小尾寒羊卵泡期大脑组织中的相对表达量最高且极显著高于黄体期(P<0.01),在黄体期下丘脑组织中的相对表达量极显著高于卵泡期(P<0.01);其在黄体期小脑组织中的相对表达量显著高于卵泡期(P<0.05),其在卵泡期输卵管组织中的相对表达量显著高于黄体期(P<0.05);其在其他组织中的相对表达量差异均不显著(P>0.05)(图2)。
2.2.3 NOTCH4基因组织表达检测。
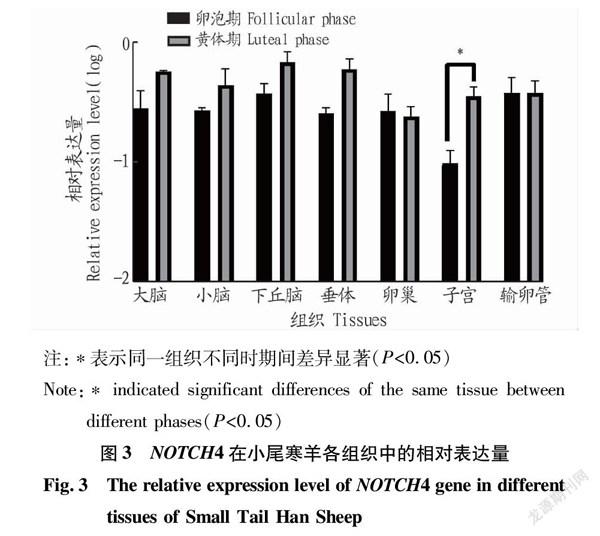
如图3所示,NOTCH4基因在小尾寒羊黄体期下丘脑组织中的相对表达量最高,其在黄体期子宫组织中的相对表达量显著高于卵泡期(P<0.05),而其在其他组织中的相对表达量差异均不显著(P>0.05)。
2.2.4 NR5A2基因组织表达检测。
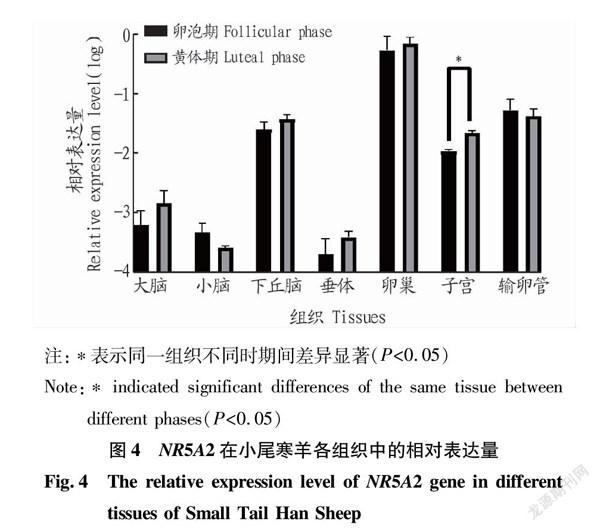
如图4所示,NR5A2基因在小尾寒羊黄体期卵巢组织中的相对表达量最高,其在黃体期子宫组织中的相对表达量显著高于卵泡期(P<0.05),而其在其他组织中的相对表达量均无显著差异(P>0.05)。
3 讨论
动物发情是研究动物繁殖育种不可忽视的一环,其中发情方式、发情时间均受到多种遗传因素的影响,研究绵羊发情期相关基因调控机制对于提高绵羊繁殖力有着重大意义[11]。卵泡在发情期的生长发育状况直接决定了绵羊的排卵数。排卵数是决定绵羊产羔数的直接因素,卵泡的生长发育与排卵数有着直接的联系[12-14]。性腺轴是以下丘脑-垂体-卵巢为主的主要参与调控卵巢内卵泡及黄体生长发育的相关组织,研究性腺轴组织中发情相关基因的表达为进一步探究提高绵羊产羔数的方法提供了新思路[15]。
KITLG作为KIT的配体,是细胞表面锚定因子家族成员之一[16]。KIT/KITLG信号通路是生殖细胞生长发育过程中不可或缺的,其与生殖细胞的发育密切相关[17]。研究表明,KITLG基因在多种动物卵巢组织中均有表达,且对排卵前卵泡的生长发育起重要作用,已有试验证实KITLG基因多态性与绵羊产羔数具有显著关联[18-19]。该试验中KITLG基因在性腺轴7种组织中均有表达,其在小脑和垂体中的相对表达量在2个时期间存在显著差异(P<0.05),其在垂体中的相对表达量较少,其在2个时期卵巢组织中均有表达,但差异未达到显著水平(P>0.05),推测该基因不参与卵泡期与黄体期的转换调控过程,其在不同时期的调控机制有待进一步探究。
丝裂原活化蛋白激酶1(MAPK1)作为MAPK通路中的重要成员,参与生殖过程中的信号转导,可激活卵母细胞的成熟进程,使其经历生发泡破裂等一系列过程[20-21]。该试验中MAPK1基因在卵泡期大脑组织中的相对表达量最高且极显著高于黄体期(P<0.01),其在黄体期下丘脑组织中的相对表达量极显著高于卵泡期(P<0.01),黄体期小脑组织中该基因的相对表达量显著高于卵泡期(P<0.05),在卵泡期输卵管组织中该基因的相对表达量显著高于黄体期(P<0.05),但除了卵泡期大脑组织外该基因在2个时期性腺轴各组织中的相对表达量均不高,推测其在小尾寒羊性腺轴对发情期的调控过程中没有起到重要的调控作用。
NOTCH4在NOTCH通路中作为受体发挥作用,NOTCH信号通路在许多器官与细胞的发育中非常重要。雷俊川[22]研究表明其在哺乳动物卵泡发育中发挥重要作用。该试验中NOTCH4基因在小尾寒羊不同时期性腺轴7种组织中均有表达。NOTCH4基因在小尾寒羊黄体期子宫组织中的相对表达量显著高于卵泡期(P<0.05),且其在卵泡期子宫中的相对表达量较低。根据前人研究结果,推测出其在子宫妊娠环境的建立过程中参与调控[23]。
NR5A2由4个结构域组成:DNA结合(DBD)和配体结合(LBD)结构域、连接DBD和LBD的长Hinger(HR)以及修饰结构域(MD)[24]。在成年哺乳动物中,NR5A2基因主要在前脂肪细胞以及肝、肠、胰腺、卵巢和睾丸中均有表达,尤其在卵巢中高表达,该基因是卵泡发育和排卵的重要和多效性调节因子[7]。该试验中NR5A2基因在小尾寒羊黄体期和卵泡期大脑、小脑和垂体组织中低表达,其在黄体期子宫组织中的相对表达量显著高于卵泡期(P<0.05),其在卵巢组织中的相对表达量最高,但黄体期与卵泡期之间无显著差异。结合前人研究结果,推测出该基因在小尾寒羊卵泡和黄体生长发育过程中起到重要作用,其具体作用机制有待进一步研究。
4 结论
该试验利用实时荧光定量PCR研究了KITLG、MAPK1、NOTCH4和NR5A2基因在小尾寒羊卵泡期和黄体期性腺轴7种组织中的表达水平,结果发现KITLG、MAPK1、NOTCH4和NR5A2基因在卵泡期、黄体期性腺轴相关组织中的表达量有较大差异,这4个基因可能对绵羊发情周期的转换具有一定的调控作用,可为进一步阐明绵羊发情周期转换的分子机理提供参考。
參考文献
[1] 樊宇岚.绵羊多羔性状候选基因的研究及发展[J].农业技术与装备,2019(11):119-120.
[2] 田占伟,赵宗胜,林杉,等.新疆哈萨克绵羊在乏情期和发情期生殖激素的变化规律[J].江苏农业科学,2016,44(2):256-259.
[3] 夏青,刘秋月,王翔宇,等.绵羊季节性繁殖分子机制及休情季节诱导绵羊发情配种技术[J].遗传,2018,40(5):369-377.
[4] AN X P,HOU J X,LEI Y N,et al.Two mutations in the 5′-flanking region of the KITLG gene are associated with litter size of dairy goats[J].Anim Genet,2015,46(3):308-311.
[5] DI R,HE J N,SONG S H,et al.Characterization and comparative profiling of ovarian microRNAs during ovine anestrus and the breeding season[J].BMC Genom,2014,15(1):1-15.
[6] CHENG R,CAI X R,KE K,et al.Notch4 inhibition suppresses invasion and vasculogenic mimicry formation of hepatocellular carcinoma cells[J].Curr Med Sci,2017,37(5):719-725.
[7] ZHANG Z X,BU X,YANG J Y,et al.NOTCH4 regulates colorectal cancer proliferation,invasiveness,and determines clinical outcome of patients[J].J Cell Physiol,2018,233(10):6975-6985.
[8] PURI R V,YERRATHOTA S,HOME T,et al.Notch4 activation aggravates NF-κB-mediated inflammation in HIV-1 associated Nephropathy[J].Dis Models Mech,2019,12(12):1-31.
[9] HERNANDEZ F,PELUFFO M C,STOUFFER R L,et al.Role of the DLL4-NOTCH system in PGF2alpha-induced luteolysis in the pregnant rat[J].Biol Reprod,2011,84(5):859-865.
[10] LI Y X,ZHANG J,QIAN Y,et al.Molecular characterization,expression,polymorphism of NR5A2 and its relationship with litter size in Hu sheep[J].Genet Mol Res,2015,14(4):12765-12775.
[11] LI X Y,LI C Y,XU Y R,et al.Analysis of pituitary transcriptomics indicates that lncRNAs are involved in the regulation of sheep estrus[J].Funct Integr Genom,2020,20(4):563-573.
[12] 郭晶,李新宇,李隐侠,等.湖羊TGF-β1基因特征、表达及其与排卵数的相关性分析[J].中国农业科学,2013,46(21):4586-4593.
[13] 王翔宇,狄冉,刘秋月,等.小鼠和绵羊BMP15和GDF9突变在卵泡发育中作用及其对排卵数的影响[J].农业生物技术学报,2020,28(10):1870-1880.
[14] 徐业芬,李齐发,李二林,等.湖羊BMP2、BMP4、BMP6和BMP7基因mRNA表达水平与排卵数关系的研究[J].中国农业科学,2009,42(10):3655-3661.
[15] PLANT T M.60 YEARS OF NEUROENDOCRINOLOGY:The hypothalamo-pituitary-gonadal axis[J].J Endocrinol,2015,226(2):T41-T54.
[16] 侯佳妮.蓝狐KIT、KITLG及EDNRB基因的克隆及与显性白毛色突变的相关性分析[D].长春:吉林大学,2014.
[17] 张敏,丁显平,朱一剑,等.KIT基因单核苷酸多态性与四川地区男性不育的相关性研究[J].四川大学学报(自然科学版),2011,48(4):961-966.
[18] 张军霞,乐祥鹏,王维民,等.绵羊KITLG基因的表达及其多态性与产羔性状关联分析[J].农业生物技术学报,2017,25(6):893-900.
[19] 安小鹏.山羊产羔性状候选基因的筛选及其多基因聚合效应的研究[D].杨凌:西北农林科技大学,2013.
[20] PONZA P,YOCAWIBUN P,SITTIKANKAEW K,et al.Molecular cloning and expression analysis of the Mitogen-activating protein kinase 1(MAPK1)gene and protein during ovarian development of the giant tiger shrimp Penaeus monodon[J].Mol Reprod Dev,2011,78(5):347-360.
[21] GONZALEZ-GARCIA J R,BRADLEY J,NOMIKOS M,et al.The dynamics of MAPK inactivation at fertilization in mouse eggs[J].J Cell Sci,2014,127(Pt 12):2749-2760.
[22] 雷俊川.Notch信号途径在哺乳动物卵泡发育中作用的初步研究[D].西安:第四军医大学,2008.
[23] 王会平,石瑛,张展.Notch信号通路在着床和胎盘形成中的表达及作用[J].广东医学,2016,37(7):1099-1102.
[24] YUMOTO F,NGUYEN P,SABLIN E P,et al.Structural basis of coactivation of liver receptor homolog-1 by β-catenin[J].PNAS,2012,109(1):143-148.

