125I粒子植入治疗碘难治性分化型甲状腺癌颈部淋巴结转移灶的临床研究▲
陆路 蒋泽文 吕金富 林纯皓 赵守松 黄小雪 黄劲铨 牟兴宇 付巍
(桂林医学院附属医院核医学科,广西桂林市 541001)
近几十年来,全球甲状腺癌的发病率逐年升高,其中分化型甲状腺癌(differentiated thyroid carcinoma,DTC)约占90%[1]。DTC起源于甲状腺滤泡上皮细胞,可分为乳头状癌、滤泡状癌和Hurtle细胞癌。绝大多数的DTC患者经过手术、131I治疗和促甲状腺激素(thyroid-stimulating hormone,TSH)抑制治疗后预后良好,5年生存率约为95%[2]。但有15%~30%的患者会发生局部区域或远处复发和转移,最常见的局部转移部位为颈部淋巴结,其中约有1/3的患者会在初始治疗阶段或治疗过程中出现失分化的现象[3],导致颈部淋巴结转移灶(cervical lymph node metastasis,CLNM)失去摄碘能力,进而发展成为碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)。RAIR -DTC对药物治疗及131I治疗均不敏感,当CLNM体积较大时可能会压迫神经或组织,如压迫喉返神经则可能导致声音嘶哑、呛咳,压迫颈静脉窦时会出现Horner综合征,压迫气道时可能出现呼吸困难甚至窒息,使其成为临床诊治中的难点与热点[4]。
RAIR-DTC患者对常规化疗不敏感[5],尽管目前研究的酪氨酸激酶抑制剂、选择性BRAF抑制剂、选择性血管内皮生长因子受体抑制剂延长了RAIR-DTC患者的无进展生存期,但是大多数患者在服用这些靶向药物的同时出现了严重的不良反应,导致治疗效果不佳[6]。2015年美国甲状腺协会指南建议,对于局部复发型RAIR-DTC患者,目前首选手术治疗。然而,由于首次手术增加了血行转移及局部种植的风险并造成瘢痕增生、水肿、组织粘连等,这些因素增加了再次手术的操作难度及并发症的发生率[7]。因此,对于无法手术切除、进展和/或有症状的转移灶或复发灶(侵犯气管、食管或压迫喉返神经、伴有局部疼痛)的RAIR-DTC患者,可考虑采取射频消融、乙醇注射、冷冻治疗、外照射治疗或125I粒子植入等局部治疗,以达到改善生存率及姑息治疗的目的[8]。
125I粒子植入治疗是近距离放射治疗的手段之一,125I粒子发生衰变,产生的γ射线累积到特定的剂量可在瘤体内持续杀伤肿瘤细胞,但其对周围组织的损伤较小,因而被应用于多种肿瘤的治疗中,并取得良好的临床效果[9-11]。然而,目前关于其用于治疗RAIR-DTC患者CLNM的报道仍较少。本文旨在对125I粒子植入治疗RAIR-DTC患者CLNM的疗效进行观察。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月至2021年4月在我院核医学科行125I粒子植入术的24例RAIR-DTC伴颈部淋巴结转移患者(共41枚CLNM)的临床资料。纳入标准:(1)经病理检查证实为分化型甲状腺癌,同时被认定为RAIR-DTC,且CLNM无法手术切除或患者拒绝行再次手术治疗;(2)患者身体一般状况好,体力状况评分为 0~3 分;(3)白细胞计数≥3×109/L,中性粒细胞绝对值≥1.5×109/L,血小板计数≥75×1012/L,血红蛋白水平≥90 g/L;(4)预计生存期>3 个月;(5)临床资料完整;(6)所有患者在植入125I 粒子前均被充分告知利弊,并签署同意书。排除标准:(1)甲状腺球蛋白(thyroglobulin, Tg)抗体阳性;(2)合并严重的器官功能障碍,如心力衰竭、肾衰竭;(3)凝血功能异常,即凝血酶原时间>20 s或凝血酶原时间国际标准比值>2.5;(4)临床资料不完整,无法完成统计分析者。患者年龄23~71岁,女性13例、男性11例;CLNM平均大小为20.6 mm×16.5 mm;术前血清Tg平均水平为22.96 μg/L。其中1例患者为甲状腺滤泡癌,其余均为甲状腺乳头状癌;共13例患者于术前进行PET-CT检查,9例患者于术后进行PET-CT检查。患者首次接受125I粒子治疗的详细信息见表1。
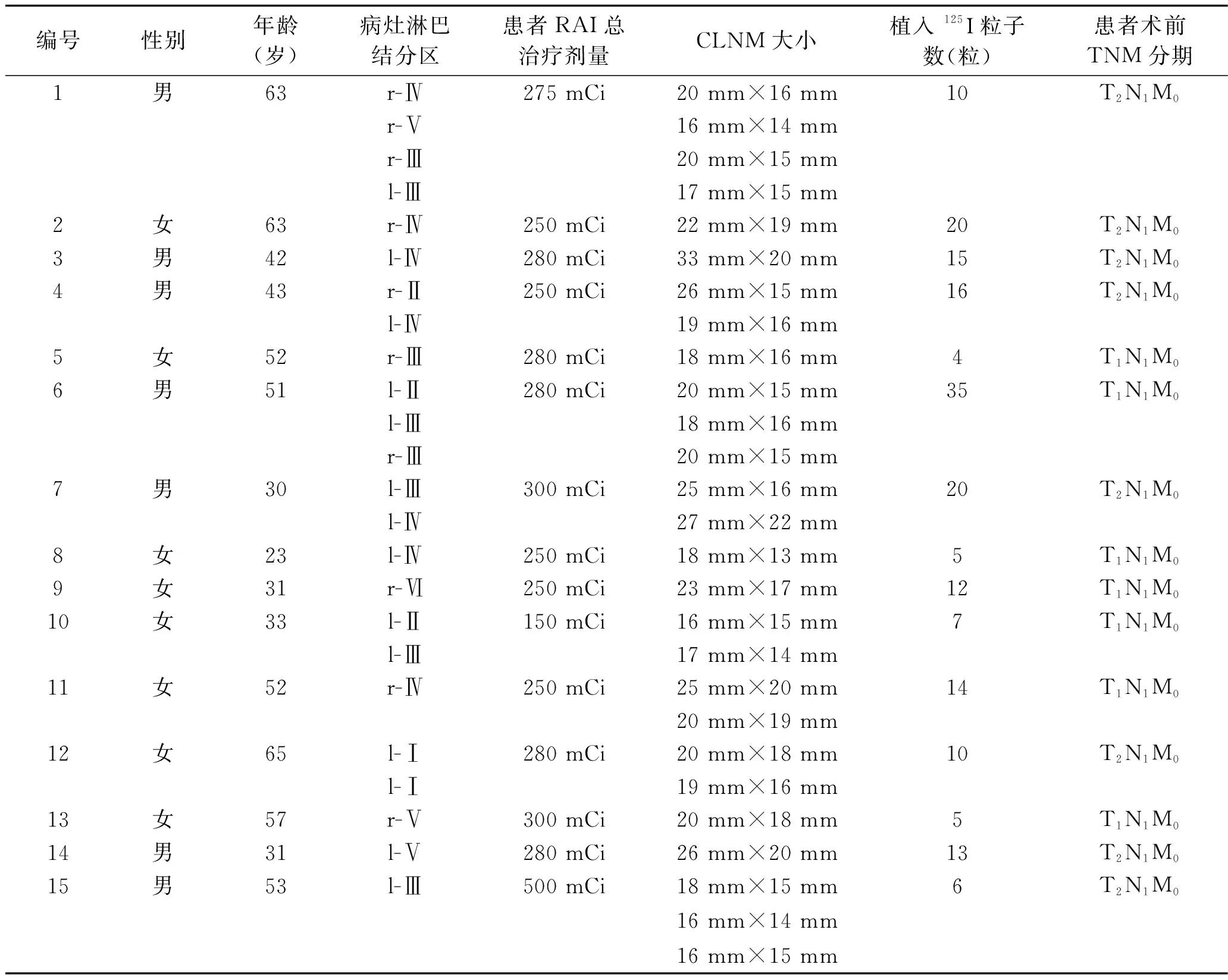
表1 24例患者首次接受 125I粒子治疗的详细信息

续表1
1.2 方法
1.2.1 仪器设备 治疗计划系统、18G粒子植入针和粒子枪均由北京飞天兆业科技有限责任公司提供。125I粒子由原子高科股份有限公司生产,规格为 0.8 mm×4.5 mm,镍钛合金包壳,活度为 0.4~0.9 mCi(平均0.81 mCi),半衰期为59.6 d,经高温高压蒸汽灭菌后使用。使用西门子Symbia T16 SPECT/CT仪,低能高分辨率准直器,能峰140 KeV,窗宽±20%进行诊断。Tg水平检测采用化学发光法,检测仪器(索灵-LIAISON化学发光仪)及试剂盒(索灵-LIAISON试剂盒)由索灵诊断医疗设备(上海)有限公司提供。
1.2.2 术前准备 术前设计治疗计划。术前予CT定位扫描靶病灶并通过计算机治疗计划系统勾画靶体积及危及器官;设定治疗处方剂量,生成剂量体积曲线图,根据具体情况调整粒子数量及布局,模拟并确定穿刺针的角度、进针方向层距。植入粒子前检测粒子活度,通过彩色多普勒超声检查浅表肿瘤周围血供、有无大血管穿过及其与重要脏器的关系,预估可能出现的损伤与风险并制订应对方法,做好相关替代治疗准备,与患者及家属充分沟通,取得其理解后签署知情同意书,选择植入125I粒子姑息治疗。
1.2.3125I粒子植入过程 所有患者均采用2%利多卡因局部麻醉,必要时加入1~2 mg去甲肾上腺素。患者取仰卧位或侧卧位,充分暴露靶区部位,常规消毒铺巾,局部浸润麻醉后,在SPECT/CT引导下选用18 G粒子针,避开血管及食管设计针道及粒子排布,针间距1.0~1.5 cm,粒子间距0.5~1.0 cm。根据粒子放置的需要,选择不同的穿刺点和穿刺路径。多个转移灶按上述方法依次植入。
1.2.4125I粒子植入后验证 植入操作完成后,常规进行CT薄层扫描。扫描后将CT图像导入治疗计划系统,应用治疗计划系统进行影像重建,术后评估植入满意度,如仍有剂量冷区则及时补种,以保证处方剂量的落实。术后3~7 d复查SPECT/CT,观察放射性浓聚范围与肿瘤边界是否基本一致,粒子有无迁移。
1.3 术后复查及疗效评价 (1)术后1个月、3个月、6个月、12个月及24个月复查TSH抑制状态下的血清Tg水平,比较治疗前后TSH抑制状态下血清Tg水平的变化。(2)术后3个月、6个月、12个月及24个月进行CT扫描以测量肿瘤大小。参照实体瘤疗效评价标准(RECIST 1.1)[12]对靶病灶进行疗效评估,肿瘤大小以靶病灶的最大直径之和来衡量:疾病进展指靶病灶最大径之和较治疗前至少增加20%,或出现新病灶(1个或多个);疾病稳定指靶病灶最大径之和较治疗前缩小但未达部分缓解,或增大未达疾病进展;部分缓解指以靶病灶基线总直径作为参考,靶病灶总直径至少减少30%;完全缓解指靶病灶消失,且短轴较治疗前缩小<10 mm,影像学提示无复发或转移,或仅见125I粒子金属影。总有效率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
1.4 不良反应发生情况的评估 术后密切观察术中及术后随访期间有无出血、血肿、粒子移位、脱落等并发症,并根据放射治疗肿瘤学组、欧洲组织研究和治疗癌症的标准评价急性放射毒性[13]。放射性皮肤损伤评级标准:0级指基本无变化;Ⅰ级指出现水疤、淡红斑、干性脱皮,毛发易脱落,汗出量减少;Ⅱ级指皮肤有触痛感,出现明显红斑、片状湿性脱皮,中度水肿;Ⅲ级指出现除皮肤皱褶处之外的融合性湿性脱皮,重度水肿;Ⅳ级指出现溃疡、出血、组织坏死。
1.5 统计学方法 采用SPSS 21.0软件进行统计学分析。计量资料均进行正态性分析及方差齐性检验,符合正态分布的计量资料以均数±标准差(x±s)表示,治疗前后比较采用配对t检验;非正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,治疗前后比较采用Wilcoxon秩和检验;计数资料以例数(n)和/或百分比(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1125I粒子植入情况 共植入282粒125I粒子,患者植入粒子数最少为4粒,最多为35粒,中位数为8.5粒,随访期间无粒子脱落。36个病灶植入粒子数量与TPS计划分布一致,符合率为87.80%(36/41),5个病灶因与颈部大血管解剖结构过于密切而未按计划植入。
2.2 治疗前后抑制状态下血清Tg水平的变化 24例患者治疗后1个月、3个月、6个月、12个月、24个月TSH抑制状态下血清Tg水平均低于治疗前,差异均有统计学意义(均P<0.01)。其中,治疗后3个月、6个月的血清Tg水平下降最明显,其次为治疗后1个月,治疗后12个月及24个月稍有上升趋势。见表2。
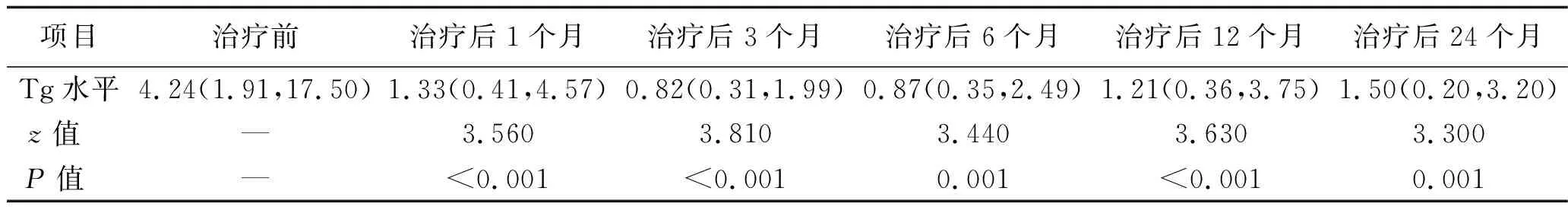
表2 患者治疗前后抑制状态下的血清Tg水平比较 (μg/L)
2.3 治疗效果 治疗后第3个月、6个月、12个月和24个月复查颈部CT,24例RAIR-DTC患者的CLNM均呈不同程度缩小。其中,术后3个月复查,完全缓解 0例,部分缓解18例,疾病稳定3例,疾病进展3例,总有效率为87.5%(21/24);术后6个月复查,完全缓解2例,部分缓解12例,疾病稳定2例,疾病进展 8例,总有效率为66.7%(16/24);术后12个月复查,完全缓解9例,部分缓解7例,疾病稳定2例,疾病进展 6例,总有效率为75.0%(18/24);术后24个月复查,完全缓解11例,部分缓解10例,疾病稳定3例,总有效率为100%(24/24);术后24个月与术后3个月总有效率比较差异具有统计学意义(χ2=12.315,P=0.015)。其中12例患者(患者编号3、6、9、11、13、15、16、17、18、20、21、22)在随访期间发现新的CLNM,并进行多次125I粒子植入治疗。典型病例见图1~图4。
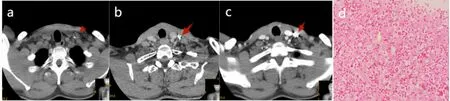
图1 典型病例1
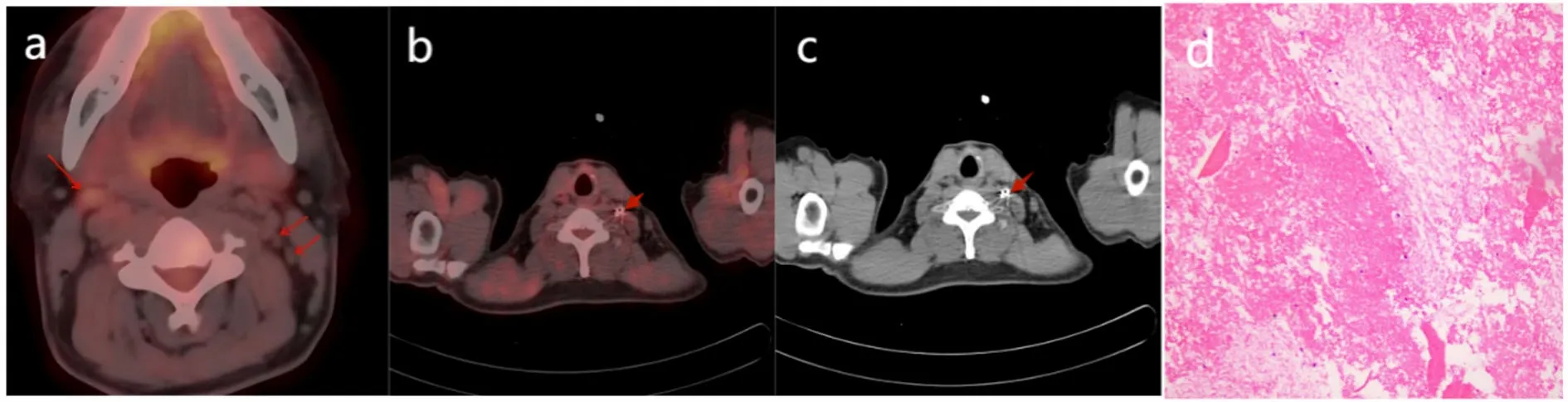
图2 典型病例2
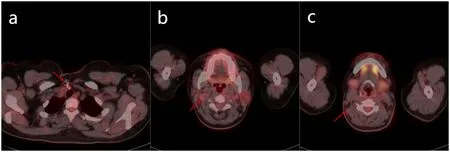
图3 典型病例3
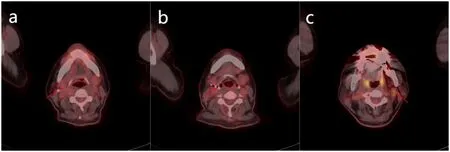
图4 典型病例4
2.4 不良反应发生情况 所有患者术中均未出现穿刺部位严重出血或血肿形成,无血管栓塞及死亡病例。术后1个月有3例患者出现I级放射性皮肤损伤,予对症治疗后好转。至随访结束,所有患者均未出现放射性肺炎或食管炎、放射性咽喉炎、空气栓塞、手术相关死亡、I级以上放射性皮肤损伤等并发症。
3 讨 论
甲状腺乳头状癌为激素依赖性肿瘤,大部分中高危患者采用131I治疗及TSH抑制治疗后可有效防止术后复发。但有研究表明,即使采用甲状腺全切术加颈部淋巴结预防性清扫及131I治疗,术后颈部淋巴结复发率仍高达16.5%[14]。2015年美国甲状腺协会指南指出,甲状腺癌术后颈部淋巴结复发首选手术治疗,但术后术区瘢痕形成、组织粘连,导致解剖结构分界不清,再次手术的难度较大且并发症发生风险较高。针对无法再次手术切除的CLNM,可考虑行125I粒子植入治疗,以达到姑息治疗的目的[2]。本研究中24例RAIR-DTC患者的CLNM均种植125I粒子成功,后续随访有3例患者(占12.5%)发生I级放射性皮肤损伤,但未见粒子脱落及严重不良反应,TSH抑制状态下血清Tg水平均有明显下降趋势,与既往研究结果相似[15-17]。与以上研究不同的是,本研究中有12例患者在首次治疗后出现了原发灶以外的新病灶,继续予125I粒子植入治疗后,至末次随访时(即首次治疗后24个月)均未见肿瘤局部复发及转移,总有效率达100%,达到了姑息治疗的目的,与Yu等[18]的研究结果相似。其中患者编号3共行4次125I粒子植入治疗,末次随访时提示疗效为部分缓解。可见125I粒子植入术可用于治疗颈部淋巴结持续性复发、转移的RAIR-DTC患者,并具有可操作性强、安全性好等优点。
血清Tg是一种糖蛋白,由甲状腺细胞或分化良好的甲状腺癌细胞合成。血清Tg是预测131I清甲治疗疗效和监测甲状腺癌复发或转移的一个重要指标[19]。本研究中,治疗后1个月、3个月、6个月、12个月、24个月TSH抑制状态下患者的血清Tg水平均低于治疗前(均P<0.01);其中,治疗后3个月、6个月的血清Tg水平下降最明显,其次为治疗后1个月,治疗后12个月及24个月稍有上升趋势,考虑与125I的半衰期及靶病灶累积剂量有关。
常规的影像学CT、彩超检查难以鉴别125I粒子植入治疗引起的组织增生纤维化与肿瘤早期复发。本研究发现,当靶病灶最大截面短径缩小至10 mm及以下时,CT成像上显示淋巴结欠清且125I粒子伪影较大,难以精确测量短径数值;而超声成像上CLNM短径的测量受操作者水平及主观因素的影响较大,短径测量可能存在偏倚。本研究中患者编号3首次治疗后6个月行18F-FDG PET/CT检查提示原术区未见明显高代谢征象,双侧颈部新见轻度高代谢淋巴结影,SUVmax为2.5,后经病理检查证实为双侧颈部新发淋巴结转移;患者编号9首次治疗后3个月复查18F-FDG PET/CT提示原术区未见高代谢征象,双侧颈部新见轻度高代谢淋巴结影,SUVmax为2.7,后经病理检查证实为双侧颈部新发淋巴结转移;患者编号11首次治疗后3个月复查18F-FDG PET/CT提示原术区未见高代谢征象,双侧颈部新见高代谢淋巴结影,SUVmax 为4.1,后经病理检查证实为双侧颈部新发淋巴结转移。因此,对于行125I粒子植入治疗后的患者,18F-FDG PET/CT不仅可以对肿瘤大小进行精确测量,更主要的是其能以功能代谢特征指导临床制订治疗方案、再分期及疗效监测等,可作为常规影像学诊断的补充。但因其成本较高,检查费用昂贵,目前较难推广应用于125I粒子植入治疗后的疗效评估。
本研究中有3例患者术后1个月出现I级放射性皮肤损伤,主要表现为暗红色斑,考虑为多个CLNM位置较为表浅且相距较近,肿瘤组织缩小后,其内125I粒子聚集形成局部热区,125I粒子可致DNA双链断裂进而影响皮肤细胞代谢[20],导致局部暗红色斑形成。因此,行125I粒子植入术时应注意粒子与皮肤表层的距离应大于1 cm。
本研究的局限性为:(1)纳入样本量有限;(2)所有患者均以颈部CT检查结果作为术后疗效评价标准,疗效评价结果相对主观,但本研究发现在颈部CT成像中,125I粒子的成像伪影较大,难以精确测量1 cm以下的转移灶大小,若能对颈部淋巴结加以彩超、MRI及PET/CT代谢显像评估转移灶的大小和代谢征象,则疗效评估更为客观。
综上所述,采用125I粒子植入治疗RAIR-DTC CLNM的疗效确切、并发症少,具有较高的临床价值。

