PET/CT在食管癌诊疗中的应用现状及潜在价值▲
丘文明 肖国有
(广西医科大学附属肿瘤医院、广西临床重点建设专科核医学科,广西南宁市 530021)
食管癌的发病率在全球所有癌症中排名第七,在癌症相关死因中排名第六[1]。食管癌发病率位居首位和第二位的地区分别为东亚和非洲南部,这两个地区的食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)占比超过90%[2],而北欧、北美和西欧等地区以食管腺癌(esophageal adenocarcinoma,EAC)为主[3]。在世界范围内,伴有远处转移的食管癌患者的5年生存率仅为4.8%,局部病灶的5年生存率则为25.1%[4]。目前主流观点认为手术是治疗食管癌患者的最佳手段。1998年,世界上第一台正电子发射体层成像(positron emission tomography, PET)/计算机断层扫描术(computer tomography, CT)在美国匹兹堡大学医学中心安装使用,之后PET/CT逐渐成为检测肿瘤、神经功能病变及心血管病变等疾病的重要工具[5]。氟代脱氧葡萄糖(18F-fluorocde-oxyglucose,18F-FDG)是目前最成熟的PET/CT显像剂。18F-FDG PET/CT以其集合代谢和解剖显像于一体的特点,在食管癌临床诊治中发挥着越来越重要的作用。本文从食管癌分期、病灶长度测量、疗效评估、生存期预测等方面对18F-FDG PET/CT在食管癌诊疗中的应用现状及潜在价值,以及新型PET/CT显像剂的研究等进行综述。
1 诊断效能、辅助方法及食管癌分期
不同研究中,18F-FDG PET/CT诊断食管癌淋巴结转移的准确率差异较大。Jiang等[6]纳入19篇文献进行Meta分析,发现18F-FDG PET/CT诊断食管癌淋巴结转移的灵敏度为66%,特异度为96%。笔者归纳总结近10年的部分研究[7-16](见表1),发现18F-FDG PET/CT诊断食管癌淋巴结转移的灵敏度为29.0%~89.2%,特异度为58.8%~98.0%,而CT诊断食管癌淋巴结转移的灵敏度为21.7%~82.3%、特异度为34.0%~96.4%,大部分研究中18F-FDG PET/CT的诊断效能总体上优于CT。作为临床N分期的“金标准”,超声内镜检查术(endoscopic ultrasonography, EUS)的灵敏度高于18F-FDG PET/CT,但其特异度较低,且EUS无法通过部分梗阻或管腔狭窄的食管,使其在临床中的应用存在较大的局限性,而PET/CT为非介入性检查,不存在此种局限性。
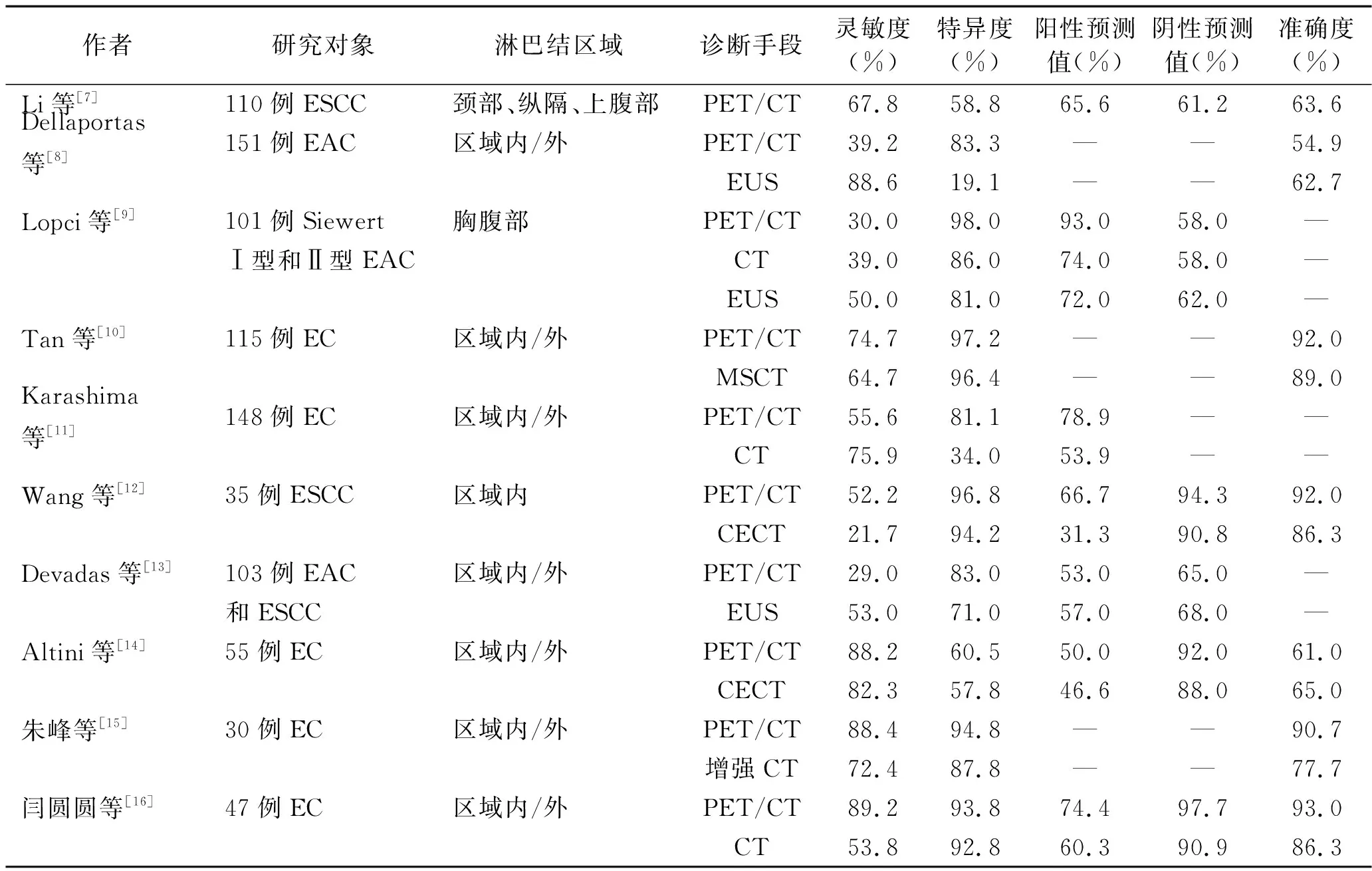
表1 不同研究中18F-FDG PET/CT、CT和EUS诊断食管癌淋巴结转移的价值比较
此外,上述研究中,18F-FDG PET/CT诊断淋巴结转移的准确率为54.9%~93.0%,波动较大,因此,有必要找出提高其诊断准确率的辅助方法。例如:(1)选用合适的最大标准摄取值(SUVmax)阈值判断淋巴结良恶性。Wang等[17]将SUVmax阈值由 2.5提高至5.0,可将18F-FDG PET/CT诊断淋巴结转移的灵敏度和特异度分别提高至87.6%和94.5%。(2)对于18F-FDG PET/CT表现为阳性的肺门淋巴结应谨慎诊断为恶性,因为肺门淋巴结并非食管引流区域淋巴结,食管癌肺门淋巴结转移较罕见,此类代谢增高的淋巴结应倾向于考虑为炎性[18-20]。(3)治疗前18F-FDG PET/CT评估N分期的灵敏度可能高于治疗后18F-FDG PET/CT。Lehmann等[21]报道了放化疗后18F-FDG PET/CT评估N分期的灵敏度为31.8%,而治疗前18F-FDG PET/CT评估N分期的灵敏度为61.7%。(4)正确使用PET/CT。Cuellar等[22]报道了79例经内镜或EUS活检确诊为cTisN0或cT1N0的病例,PET/CT诊断转移性淋巴结的灵敏度、阳性预测值均为0,准确率为82%。食管癌早期淋巴结转移可能多为显微水平的微转移,18F-FDG PET/CT诊断价值有限,分期时应结合EUS、CT等检查综合判断。
另外,对于术前接受放化疗的患者,术中应该切除的淋巴结数量目前仍没有定论。综上,笔者推测,临床上根据治疗前18F-FDG PET/CT评估转移性淋巴结情况来预估术中应该切除的淋巴结数量,或许比CT或放化疗后18F-FDG PET/CT更准确。
2 病灶长度的测量
准确测量肿瘤病灶长度对于确定食管癌手术切除范围和指导放疗靶区的勾画至关重要。然而,18F-FDG PET/CT测量食管癌病灶长度的准确性存在以下不确定性。(1)勾画肿瘤边界尚无统一标准。Ma等[23]对20例胃食管交界处癌患者进行研究,分别以10% SUVmax、20% SUVmax、30% SUVmax、40% SUVmax、50% SUVmax、SUV1.5、SUV2.5、SUV3.5、SUV4.5、SUV5.5作为阈值测量病灶长度,发现30% SUVmax测量结果与病理病灶长度最为接近。但也有研究报道SUV2.5、20% SUVmax、视觉分析法为测量病灶长度的最佳方法[24-26]。(2)18F-FDG PET/CT测量病灶长度的准确性是否比其他成像方式更高,不同研究得出的结论不一致。Rollins等[27]报道了在53例食管癌或胃食管交界处癌患者中,以SUV5.0测量的18F-FDG PET/CT病灶长度比EUS、内镜更接近病理长度。然而,Li等[28]报道,在26例胸段食管癌中,SUV2.5测量的18F-FDG PET/CT病灶长度与内镜和MRI所测的结果总体相近。
总之,不同研究确定肿瘤边界所采用的方法不一,且纳入病例的数量、病理类型、肿瘤部位均有差异,各研究间异质性明显。此外,作为“金标准”的病理长度可能受到术前放化疗、离体后长度回缩等影响,从而对各研究间的对比和研究准确性造成干扰,因此,后续需要更多的研究进一步探讨。
3 疗效评估
3.1 治疗早期和中期的疗效评估 治疗早期或中期评估疗效对于调整治疗方案具有重要意义,而18F-FDG PET/CT在这方面表现出一定的价值。例如,CALGB8083试验中,研究者将诱导化疗后18F-FDG PET/CT和基线PET/CT的△SUVmax≥35%作为阈值,将接受术前放化疗的患者分为PET有反应组和PET无反应组,并且更改PET无反应组的化疗方案,最终PET无反应组的病理学完全缓解(pathological complete response, pCR)率得到提高[29]。Kim等[30]也报道了放疗中期(同步放化疗开始后9~12 d)18F-FDG PET/CT和基线PET/CT代谢体积和SUVmean(平均标准摄取值)的变化值可以预测食管癌患者1年内是否发生局部复发或远处转移,从而调整治疗计划。但是,此类运用治疗早中期18F-FDG PET/CT代谢参数评价疗效的方法存在以下几点局限性:(1)炎症的影响;(2)此类方法预测后期疗效的灵敏度、特异度未达到90%[31];(3)有待对比18F-FDG PET/CT与CT在此方面的应用价值;(4)哪一项代谢参数评价疗效更可靠尚无统一共识,且各参数无统一阈值。
3.2 一线放化疗结束后疗效评估 综合近5年的部分研究发现,利用18F-FDG PET/CT的PERCIST标准和代谢参数的变化值评价一线放化疗结束后病灶是否达到病理学完全缓解的阳性预测值为27.0%~86.0%,阴性预测值为15.0%~93.8%,准确率为60.5%~75.0%,未能兼顾灵敏度和特异度均达到85%以上的要求[32-37],且准确率有待提高。目前已有不少研究探索提高PET/CT评估疗效的准确度的方法。例如,Heneghan等[32]认为,术前放化疗后1~1.5个月明显表现为cMR(complete metabolic response, PET/CT评估的疗效为“完全代谢缓解”)和cCR(clinical complete remission, 临床综合评价的疗效为“临床完全缓解”)的患者不应该进一步行手术治疗。Deantonio等[38]在一项荟萃分析中报道了利用PET/CT放射组学参数预测食管癌新辅助治疗后pCR的集成AUC(ROC曲线下面积)可达到0.821(95%CI:0.737~0.904)。另外,Xu等[37]报道了由MRI和18F-FDG PET/CT的相关参数构建的Logistic回归模型预测pCR的灵敏度和特异度可达90.0%和86.4%。如能找出可以更准确地诊断pCR的无创性方法,对于临床医师判断食管癌一线放化疗后患者,尤其是影像学表现为病灶无肿瘤残存的患者,是否应该进行食管切除术还是随访观察,具有重要的指导价值。
4 生存期预测
利用18F-FDG PET/CT预测食管癌患者生存期(无病进展期或总生存期)的指标主要分三大类。(1)代谢参数。包括原发灶代谢参数、转移淋巴结SUVmax、治疗前后代谢参数变化值等。(2)阅片结果。包括PET/CT淋巴结阴性/阳性(PET/CT cN0/cN+)、PERCIST疗效评估结果(cMR或非cMR)、PET/CT病灶长度等。(3)PET放射组学特征。多数研究证实PET/CT cN+患者比PET/CT cN0患者生存期短[35, 39-40]。可以用病情的严重程度来解释此种现象,即伴随淋巴结转移的患者,其疾病的侵袭程度大多也较严重,因此生存获益欠佳。单一的代谢参数预测生存期的AUC值通常为0.6~0.8[41-43],部分研究将代谢参数联合其他指标构建预测预后的模型,模型的AUC值可提高至0.8~0.9[44-45]。一般代谢参数高值组患者的生存期比低值组短,但采用的截点值变化较大,且同一代谢参数是否可以预测生存期,不同研究得出的结论也不一致[41,46]。另外,PET组学属于兴起阶段,推广度尚不足,PET/CT代谢参数变化值的阈值也尚未形成统一标准[40, 47-48],因此,18F-FDG PET/CT预测食管癌患者生存期的临床应用比较受限。
5 新型PET/CT显像剂在食管癌中的应用现状
除了18F-FDG显像剂之外,目前已有多种新型显像剂被用于食管癌的诊疗中[49]。(1)胸腺嘧啶核苷类似物(18F-flurothy midine,18F-FLT)。肿瘤细胞大多增殖活跃,胸腺嘧啶激酶活性增高,因此会摄取大量胸腺嘧啶核苷类似物18F-FLT。而在炎性病灶中,虽然巨噬细胞、T淋巴细胞等炎细胞的数量增多,但其本身增殖并不活跃,18F-FLT摄取较少。因此,18F-FLT可克服炎症的干扰。已有研究报道,在SCC中,18F-FLT PET/CT区分炎性病灶和残存肿瘤的效果较18F-FDG PET/CT更好[50]。(2)乏氧显像剂18F-fluoroerythronitroimidazole(18F-FETNIM)和18F-fluoromisonidazole (18F-FMISO)。此类显像剂可以显影肿瘤乏氧部位和程度,因此可以准确评估病灶和评价疗效。胡漫等[51-53]已相继证实了18F-FETNIM PET/CT在非小细胞肺癌、头颈部鳞癌、脑胶质瘤中可以显影肿瘤乏氧情况,但尚未见其在食管癌中应用的研究报道。但已有研究报道18F-FMISO PET/CT可对食管癌放疗前后病灶的乏氧情况进行评价,从而指导临床放疗靶区勾画和评估放疗效果[54]。(3)成纤维细胞活化蛋白特异性酶抑制剂(fibroblast activation protein specific enzyme inhibitor,FAPI)。68Ga-FAPI PET/CT已被证实在食管癌中肿瘤/背景比值可以超过11,并且不会受炎症的影响,可以清晰地显影转移性淋巴结,提高淋巴结分期的准确性,也可以更准确地显影肿瘤体积,提高勾画靶区的精确度[55-56]。(4)趋化因子受体4(chemokine receptor 4,CXCR4)显像剂。CXCR4主要表达于免疫细胞,其信号活动可促进肿瘤新生血管的生成,从而促进癌症进展。目前已有研究发现CXCR4新型PET显像剂68Ga-pentixafor PET/CT可能有助于食管癌及其转移灶的早期诊断和预防[57]。(5)免疫PET显像剂。如显影CD8+肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)的PET显像剂89Zr-Df-IAB22M2C、89Zr-聚乙二醇化VHH-X118等[58-59],此类显像剂的PET/CT可以评估肿瘤微环境中的TILs数量和分布是否均匀,从而筛选出因CD8+TILs浸润不足或异质性分布而对免疫治疗获益不佳的患者。但目前未见将此类显像剂应用于食管癌的研究报道。此外,还有显示PD-L1表达水平的新型PET显像剂,比如18F-adnectin已进入临床试验阶段[60],但尚未见应用于食管癌中,如能无创评估肿瘤中PD-L1的表达水平,对于筛选适合应用免疫检查点抑制剂的食管癌患者将会大有帮助。新型PET显像剂的临床推广将会给食管癌患者带来福音。
6 总结与展望
综上所述,18F-FDG PET/CT已在食管癌的分期、病灶长度测量、疗效评价及生存期预测等方面发挥着重要的作用。但受制于炎症的干扰,18F-FDG PET/CT在食管癌淋巴结分期、疗效评价等方面均存在一定局限性,而新型显像剂的应用,例如18F-FLT、68Ga-FAPI等可弥补18F-FDG的缺陷,具有一定的应用前景。未来,各种新型显像剂的运用将会进一步提升PET/CT在食管癌诊疗中的应用价值。

