咸丰白术种子生物学特性研究
周武先,李大荣,周 亮,王 华,由金文,张美德,刘海华
(1.湖北省农业科学院中药材研究所,湖北 恩施 445000;2.麻阳苗族自治县农业农村局,湖南 怀化 419400)
白术(Atractylodes macrocephalaKoidz.)为菊科苍术属多年生草本植物,味苦、甘,性温;根状茎为药用部位,具有燥湿利水、健脾益气、止汗安胎和抗炎抑菌等功效[1-3]。咸丰白术也被称为鸡腿白术,与其他产区的白术相比,具有有效成分含量高、绿色无污染、加工饮片形状好、质地均匀坚实等质量优势[4]。近年来,由于部分药农盲目引种,导致咸丰白术种源退化,白术产量和品质无法得到保障。因此对咸丰不同地区的白术种子进行种子生物学研究和比较,筛选出性状和活力更佳的种子,有利于从源头保证白术药材品质,维护咸丰白术道地品牌。
目前,关于白术的研究主要集中于栽培技术、组织快繁以及化学成分等方面[5-7],而白术种子生物学方面的研究报道较少。刘文东等[8]和田静等[9]研究了不同条件对白术种子萌发的影响。刘小丽等[10]使用不同浓度次氯酸钠溶液消毒对白术种子萌发影响进行了研究。但关于咸丰白术种子生物学特性以及不同消毒剂和激素处理对种子霉变和萌发影响的研究却鲜见报道。为此,本研究收集了4 份来自咸丰不同地区的白术种子,并对其生物学特性进行比较,为发掘咸丰白术优质种源提供科学依据。此外,通过使用不同消毒剂对白术种子进行消毒处理,探索白术种子的最佳消毒方式。同时采用不同生长激素处理白术种子,筛选能够有效促进种子萌发的激素处理,为白术种苗高效繁育奠定研究基础。
1 材料与方法
1.1 试验材料
试验使用的白术种子来自湖北省咸丰县的活龙坪(HLP)、李子溪1(LZX1)、中心场(ZXC)和李子溪2(LZX2)4 个不同地区。白术种子购自当地农户,为当年采摘的健康种子。种子萌发试验选用直径150 mm 的塑料培养皿。
1.2 试验方法
1.2.1 白术种子萌发试验 将白术种子用去离子水浸种6 h 后取出,去除种皮,吸干水分备用。使用75%(V/V)酒精浸泡30 s,然后用3%次氯酸钠浸泡10 min,最后取出用去离子水润洗3 次,吸干表面水分,置于铺有双层滤纸的无菌培养皿中,放入25 ℃人工培养箱中避光培养。每处理3 次重复,每个重复30 粒种子。适时补水,保持萌发床湿润,每天观察并记录种子发芽状况,统计发芽率和发芽势。
1.2.2 不同消毒方式处理试验 参考刘小丽等[10]的方法,以李子溪1 的白术种子为试验材料,用去离子水浸种6 h,将种子分别置于3%过氧化氢(T1)、5%高锰酸钾(T2)、3%次氯酸钠(T3)、75%酒精(T4)和去离子水(CK)中浸泡15 min,然后取出用去离子水润洗3 次,吸干表面水分,置于铺有双层滤纸的无菌培养皿中,放入25℃人工培养箱中避光培养。每个处理3 个重复,每个重复30 粒种子。适时补水,保持萌发床湿润,每天观察并记录种子发芽状况,统计发芽率和霉变率。
1.2.3 不同激素处理试验 以李子溪1 白术种子为试验材料,分别用0(CK)、100、200、400、500 mg/L 赤霉素(GA3),0(CK)、5、10、20、50、100 mg/L 生长素(IAA)和0(CK)、5、10、20、50、100 mg/L 细胞分裂素(6-BA)浸泡6 h,取出后去除种皮,使用3%次氯酸钠浸泡消毒15 min,去离子水润洗3 遍后置于铺有双层滤纸的无菌培养皿中,放入25℃人工培养箱中避光培养。每个处理3 个重复。适时补水,保持萌发床湿润,每天观察并记录种子发芽状况,统计发芽率和发芽势,直至萌发率连续3 d 保持不变。
1.3 项目测定
1.3.1 白术种子形态学及千粒重测定 采用游标卡尺测量种子长和宽;千粒重参考田静等[9]的方法进行测定。
1.3.2 白术种子吸水特性及水分含量测定 吸水特性的测定参考刘文东等[8]的方法,称取白术种子4 g置于清水中浸泡48 h;前2 h 每隔0.5 h 取出用吸水纸吸干表面水后称重,2~6 h 每隔2 h 取出称重,6~12 h 每隔6 h 取出称重,12~24 h 每隔12 h 取出称重,24~48 h 每隔24 h 取出称重。每个处理3 次重复。吸水率=(M1-M0)/M0×100%,式中M0为种子初始质量,M1为种子吸胀后的质量。
水分含量由白术种子烘干前后重量差值计算所得,随机选取60 粒白术种子,称其初始重后置于105 ℃烘箱中烘至恒重,然后取出再次称重。水分含量=(m1-m2)/(m1-m0),式中m0为干燥盒的重量,m1为干燥盒加种子的初始重,m2为烘干后干燥盒加种子的重量。
1.3.3 白术种子生活力及萌发指标测定 种子生活力测定参考沈宇峰等[11]的方法进行,用2% TTC 染色测定,种子生活力=(胚染色数/种子总数)×100%。
发芽率=种子发芽数/供试种子数×100%;
发芽势=前5 d 发芽种子数/供试种子数×100%;
霉变率=霉变种子数/供试种子数×100%。
1.4 数据分析
采用Microsoft Excel 2016、SPSS 22.0 软件对数据进行统计分析和单因素方差分析,并用新复极差法(Duncan)进行多重比较(α=0.05)。利用Origin8.1软件制图,图表中数据为平均值±标准偏差。
2 结果与分析
2.1 白术种子形态学、千粒重及种子活力
由图1 可知,中心场的白术种子长、宽均低于其他地区的白术种子,分别为9.00 mm 和3.25 mm。不同产地的白术种子在千粒重上差异明显,其中以李子溪2 的白术种子千粒重最高,为36.27 g;中心场的最低,为29.63 g。使用2%TTC 染色法测定种子的生活力,结果显示,不同地区白术种子的生活力无显著差异,均达90%以上。
2.2 白术种子吸水特性及水分含量
图2 显示,4 种咸丰白术种子的吸水特性基本一致,均在前6 h 吸水迅速,6~12 h 处于吸水平缓期,12 h 后种子吸水基本达到饱和状态,吸水率基本保持不变。不同地区白术种子的水分含量存在明显差异,其中活龙坪的白术种子水分含量最高。
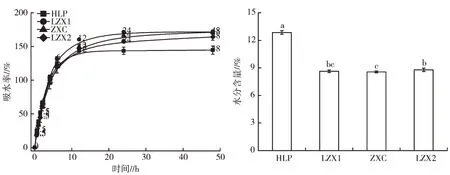
图2 咸丰不同地区白术种子的吸水特性和水分含量
2.3 白术种子发芽率
从图3 可知,活龙坪、李子溪1 和李子溪2 的白术种子发芽率为67.8%~71.1%,中心场的白术种子发芽率显著高于其他地区的白术种子,发芽势显著高于活龙坪和李子溪1,最终发芽率达到80%以上。

图3 咸丰不同地区白术种子的发芽率和发芽势
不同地区的白术种子形态、千粒重、生活力、吸水特性和水分含量与其发芽率的相关系数见表1。从表1 可以看出,不同地区白术种子的千粒重和生活力均与发芽率呈正相关,其中活龙坪白术种子的千粒重与发芽率呈显著正相关。

表1 咸丰不同地区白术种子形态学、千粒重、生活力、吸水率及水分含量与发芽率的相关系数
2.4 不同消毒方式对白术种子霉变率及发芽率的影响
由图4 可知,与对照相比,消毒处理显著降低了白术种子的霉变率,其中75%酒精和3%次氯酸钠的消毒效果较好,霉变率显著低于对照处理,降幅分别为79.0%和72.6%,其次为3%过氧化氢和0.5%高锰酸钾,霉变率显著低于对照处理,均为43.3%,降幅为37.1%。从不同消毒处理的白术种子发芽率来看,3%次氯酸钠不仅有较好的消毒效果,对白术种子的萌发也有一定的促进作用,而75%酒精虽然消毒效果较好,但对白术种子萌发有严重的抑制作用,会使白术种子完全丧失活性。
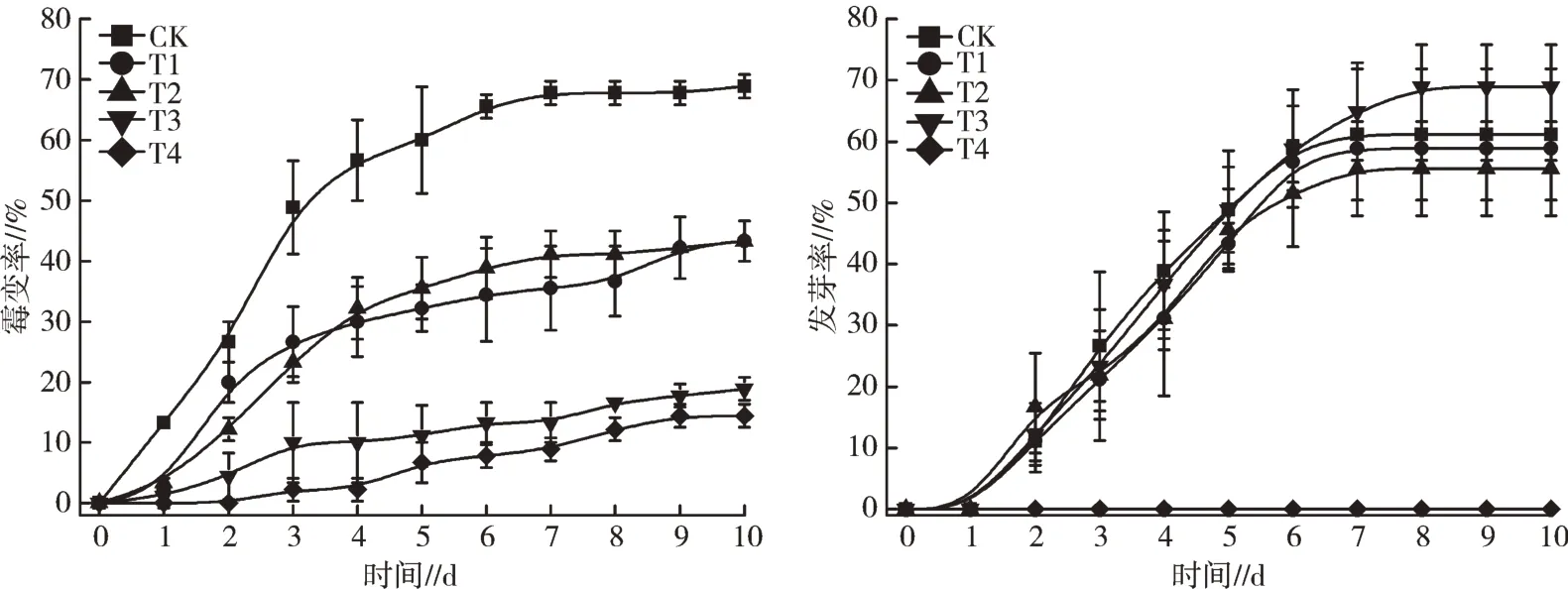
图4 不同消毒方式对白术种子霉变率及发芽率的影响
2.5 不同激素处理对白术种子发芽率及发芽势的影响
由图5 可知,100、200、400 mg/L 的GA3对白术种子的萌发有显著的促进作用,发芽率相比于对照增幅均为20.4%。50、100、200 mg/L 的GA3处理对白术种子发芽势有一定促进作用,增幅为12.0%~16.0%,但与对照相比差异不显著。

图5 不同浓度GA3对白术种子发芽率及发芽势的影响
图6 显示,相比于对照,5、10、20 mg/L 的IAA 对白术种子的萌发有显著的促进作用,发芽率增幅分别为31.0%、25.9%和24.3%。白术种子发芽势以5 mg/L 的IAA 处理最高,为84.4%,显著高于对照处理,增幅达31.0%。

图6 不同浓度IAA 对白术种子发芽率及发芽势的影响
从图7 可以看出,5 mg/L 和10 mg/L 的6-BA 对白术种子的萌发有显著的促进作用,相比于对照处理,发芽率增幅分别为27.1%和32.2%。5 mg/L 和10 mg/L 6-BA 处理下白术种子发芽势显著高于对照处理,增幅分别为29.3%和32.8%。
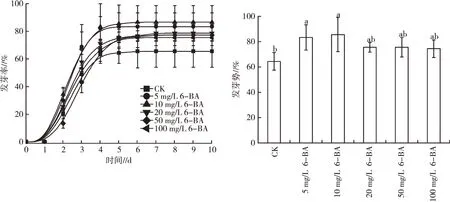
图7 不同浓度6-BA 对白术种子发芽率及发芽势的影响
3 小结与讨论
试验结果表明,不同地区的4 份种子中以中心场的白术种子生活力和发芽率最高,可初步作为咸丰的优势种源。白术种子最优的消毒处理方式为3%次氯酸钠浸泡消毒15 min。100~400 mg/L GA3、5~20 mg/L IAA 以及5~10 mg/L 6-BA 对白术种子萌发均具有较好的促进效果。
同一类种子,千粒重越大说明种粒越饱满,其萌发也更有优势[12]。在本试验中,4 种白术种子的千粒重都与其发芽率呈正相关,即对于同一品种的种子,其千粒重越大,发芽率也会越高。种子的生活力是指种子的潜在萌发能力或种胚所具有的生命力,通常指种子中具有生命力的种子数占种子总数的百分率,它不仅是种子质量鉴定中一项重要检测内容,也是判断种子质量优劣的重要指标[13,14]。沈宇峰等[11]和赵文吉等[15]通过研究不同产地的白术种子生活力与发芽率的相关性,发现白术种子的生活力和发芽率显著正相关。本试验通过TTC 法测定白术种子生活力,结果也得出白术种子的生活力与其发芽率呈正相关,生活力高的种子发芽率也越高。本研究中,中心场白术种子生活力最高,发芽率和萌发势也高于其他地区的白术种子,可以作为咸丰的优异种源。此外,不同地区的白术种子种长、种宽、吸水率以及水分含量与其发芽率的关系存在一定差异,并未呈现特定的相关性,这可能与白术种源及生长环境差异有关,但具体原因有待进一步研究。
植物在生长发育过程中有一些病害与其种子自身带有的病菌有关,所以种子种植前对其进行消毒处理可以有效地减轻植物生长期间病害的发生[16]。此外,消毒处理还可以显著降低种子在萌发过程中的霉变率,提升成苗率[17]。晏家祥等[18]和李忠光等[19]分别研究了消毒剂对毛红椿和小桐子种子霉变率的影响,证明了适宜的消毒剂可以有效降低种子的霉变率。在本试验中,4 种消毒剂均可有效降低白术种子霉变率,且以3%的次氯酸钠和75%的酒精效果更佳,但75%酒精消毒处理会使白术种子完全丧失活性,这与晏家祥等[18]研究75%酒精对毛红椿种子发芽率影响的结果类似,因此75%酒精不可以作为白术种子的消毒试剂。3%的次氯酸钠对白术种子的发芽率没有显著影响,反而具有一定的促进作用,因此3%次氯酸钠是白术种子的理想消毒剂。李忠光等[19]的研究表明,次氯酸钠虽然可以降低小桐子的霉变率,但对小桐子种子萌发具有一定的抑制作用,说明同样的消毒剂对不同植物种子的消毒效果和发芽率的影响不同,这可能与种子表面的霉菌类型和种子生物学特性不同有关。
植物生长调节剂是一类与植物激素具有相似生理和生物学效应的物质,它能够影响植物种子的萌发以及植株的生长发育。GA3是广泛存在的一种植物激素,它参与种子萌发,幼苗生长和果实成熟等重要的生理过程;在解除种子休眠、细胞分裂和分化等方面也起着促进作用[20,21]。IAA 是一种植物体内普遍存在的内源生长素,对细胞分裂伸长和分化具有重要的作用[22]。刘生财等[23]的研究表明,苋菜早期生长过程中幼苗鲜重增加和根系生长发育与IAA 存在密切联系。6-BA 是一类能够促进胞质分裂的物质,与IAA 具有协同作用,是调节植物细胞生长和发育的重要激素,能够促进细胞的分裂和种子的萌发[24]。本研究结果表明,100~400 mg/L 的GA3、5~20 mg/L 的IAA 以 及5~10 mg/L 的6-BA 对 白 术 种 子 的萌发均具有较好的促进作用,而激素的浓度过低或过高均无法提高白术种子的发芽率,说明GA3、IAA以及6-BA 对白术种子的萌发存在显著的剂量效应,这与以往报道的生长激素对苋菜、紫罗勒以及菜瓜种子萌发的影响结果类似[23,25,26]。总体来说,低浓度的激素对白术种子的萌发有一定的促进作用,而高浓度的激素处理效果不显著,甚至会产生抑制作用。

