某品牌鸽新城疫抗体ELISA 检测试剂盒性能评价
陈诒伟,付小龙,张 毅,艾尼瓦尔·苏甫尔,丁 洁,苏战强
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830000;2.喀什职业技术学院,新疆喀什 844000)
鸽新城疫是鸽副黏病毒1 型(PPMV-1)引起的以鸽神经症状为主要特征的传染病[1],主要特征是呼吸困难、下痢、神经紊乱和浆膜出血,其传播快,病死率为20%~100%,是现阶段危害养鸽业的主要疾病之一[2]。该病的治疗没有可用的特效药,疫苗免疫接种是防制本病最有效方法[3]。及时开展鸽群新城疫抗体检测,了解鸽场免疫水平,能很好地反映鸽群的抗病能力。目前鸽新城疫抗体检测,普遍采用血凝及血凝抑制试验[4],而酶联免疫吸附试验(ELISA)因其操作简便、检测量大、敏感性好的优点也被广泛使用[5]。然而,在生产应用中发现,一些市售ELISA 检测试剂盒的检测结果和鸽群的免疫情况不相符[6]。本试验以血凝及血凝抑制试验为标准,对某品牌的鸽抗体ELISA 检测试剂盒检测的可靠性、准确性进行评价,以反映其在实践中的应用价值。
1 材料与方法
1.1 样本来源及样本处理
样本来自新疆喀什地区规模化鸽养殖场及鸽养殖合作社。随机采集喀什市某规模化养殖场鸽血液样本96 份,巴楚县某规模化养殖场鸽血液样本49 份,疏勒县某养殖合作社鸽血液样本47 份,共计192 份。肉鸽翅下静脉采血2~3 mL/只,采集后斜面静置,待血清析出后,2 000 r/min 离心10 min,用微量移液器取上层血清至EP 管中,放置实验室冰箱内,-20 ℃保存待检。
1.2 仪器及相关试剂
96 孔微量板、微量移液器、ZW-A 型微量振荡器、aidaTD4Z 低速离心机、生理盐水、自制1%鸽红细胞悬液[7]。新城疫标准抗原、新城疫阳性/阴性血清,均购自青岛立见诊断技术发展中心。某品牌鸽新城疫抗体ELISA 检测试剂盒(双抗原夹心法),市场采购。
1.3 试验方法
1.3.1 血凝及血凝抑制试验 试验具体操作及结果判定,参照国家标准《试验动物血凝抑制试验》(GB/T 14926.54—2001)[4]及《新城疫诊断技术》(GB/T 16550—2020)[8]。
1.3.2 ELISA法 试验按照试剂盒说明进行。
1.4 评价指标
1.4.1 敏感性及特异性 敏感性=真阳性数/(真阳性数+假阴性数)×100%;特异性=真阴性数/(真阴性数+假阳性数)×100%[9]。
1.4.2 阳性似然比与阴性似然比 阳性似然比=真阳性率/假阳性率=敏感性/(1-特异性);阴性似然比=假阴性率/真阳性率=(1-敏感性)/特异性[10]。
1.4.3 符合率及真实性 符合率=(真阴性数+真阳性数)/(真阳性数+真阴性数+假阳性数+假阴性数)×100%[9]。约登指数=(灵敏度+特异性)-1=[真阳性数/(真阳性数+假阴性数)+真阴性数/(假阳性数+真阴性数)]-1[11]。约登指数也称正确指数,是评价筛查试验真实性的指标,指数越大,越接近1,说明筛查试验效果越好,真实性越大。
1.4.4 ROC 曲线 ROC 曲线(受试者特征曲线,又称感受性曲线),是以假阳性率(1-特异度)为横坐标,以真阳性率(敏感性)为纵坐标,连接相邻ROC 曲线工作点形成的光滑曲线。可以有效解决数据不平衡问题,并且可以通过比较ROC 曲线的下面积(AUC)来判断试验的准确性,AUC值越大,表明准确性越好[12]。
2 结果及分析
2.1 血清样品检测
2.1.1 血凝及血凝抑制试验 192份血清样品中,检出阳性(≥4log2)154 份,阳性率为80.2%,阴性(≤3log2)38 份,阴性率19.8%(表1)。
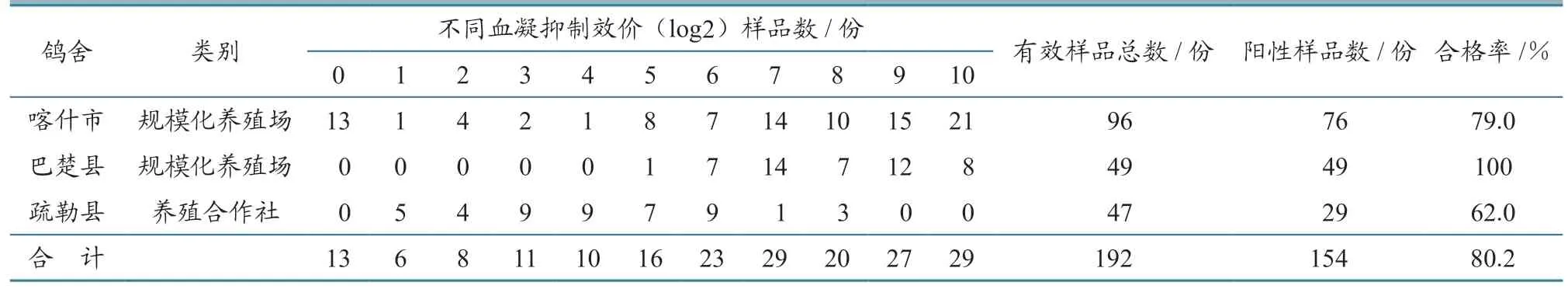
表1 血凝及血凝抑制试验结果
2.1.2 ELISA法 192 份血清样品中,检出阳性(OD ≥临界值)20 份,阳性率为10.4%,阴性(OD <临界值)172 份,阴性率为89.6%(表2)。
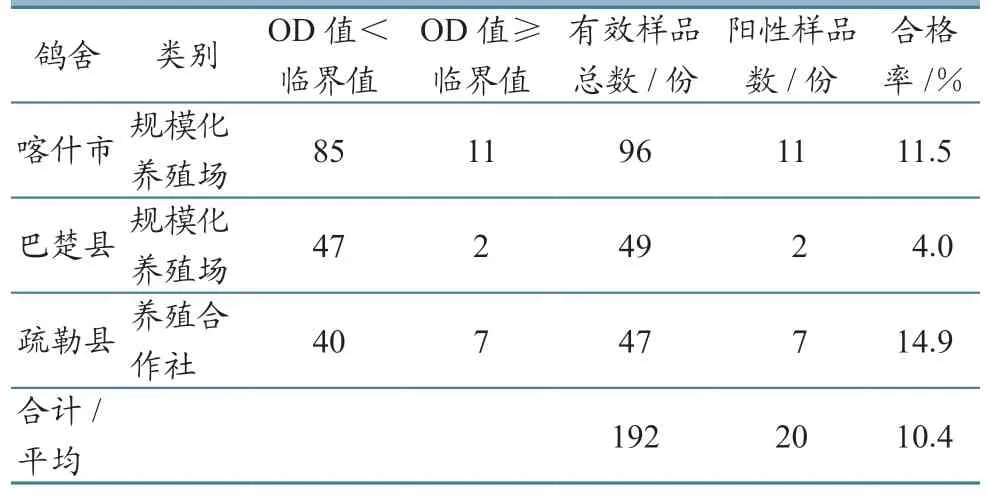
表2 ELISA法检测结果
2.2 性能评价
以血凝及血凝抑制试验结果作为“金标准”,对ELISA 检测结果进行判定,结果发现192 份样品中,真阳性19 份、真阴性37 份,假阳性1 份、假阴性135 份(图1)。
2.2.1 敏感性及特异性 ELISA 试剂盒敏感性=19/(19+135)×100%=12.3%;特异性=37/(37+1)×100%=97.4%。对比“金标准”来看,该品牌试剂盒敏感性很低,难以有效反映鸽群新城疫抗体。但特异性高,检测到的阳性样品几乎都有较高抗体水平。
2.2.2 阳性似然比与阴性似然比 计算得知,ELISA 试剂盒的阳性似然比=0.123/(1-0.974)=4.73;阴性似然比=(1-0.123)/0.974=0.90。阳性似然比与阴性似然比取值范围均为(0,+∞),阳性似然比值越大,检测方法证实抗体阳性能力越强;阳性似然比值越小,检测方法排除阴性能力越强[10]。该指标全面反映筛检试验的诊断价值,相对稳定。临床实践过程中,阳性似然比>10 或阴性似然比<0.1,都可以提供令人信服的数据;阳性似然比>5 或阴性似然比<0.2,也是有利的诊断证据[13]。结果可以看出,该试剂盒敏感性较低,检测结果假阴性率较高,导致阳性似然比较低,阴性似然比较高[13]。因此评价该检测试剂盒抗体阳性检出能力、抗体阴性排除能力均较低,可能会造成养殖企业对免疫情况的误判,增加免疫剂量和免疫次数,使养殖企业投入更多的非必要免疫成本。
2.2.3 符合率及真实性 ELISA 试剂盒的符合率=(37+19)/(37+19+1+135)×100%=29.1%;约登指数=[19/(19+135)+37/(1+37)]-1=0.097。数据表明:该试剂盒符合率较低,与国家标准存在较大差异,检测结果真实性较低。
2.2.4 ROC 曲线 由ROC 曲线结果来看,P=0.01,有统计学意义,曲线下面积(AUG)为0.635,说明该试剂盒针对鸽新城疫抗体检准确性较低(图2、表3)。

表3 ELISA 试剂盒结果ROC 曲线相关数值
2.2.5 评价结论 综上所述,该品牌ELISA 试剂盒的敏感性、真实性、符合率、准确性均较低,证实抗体阳性检出能力及阴性排除能力较弱,不能为生产实践提供有效指导。
3 讨论
抗体检测是监测免疫效果好坏的重要手段,不同检测手段所得结果不同,只有可靠的检测方法才能指导临床生产。目前检测鸽新城疫抗体的方法中,应用最为广泛的是新城疫检测国家标准中建议的血凝及血凝抑制试验,以及操作简便、敏感性高,且特异性强的ELISA 检测方法[14-15]。本研究分别用血凝及血凝抑制试验和ELISA 检测方法,同时检测了192 份鸽血清样本,结果两者差异很大。鉴于血凝及血凝抑制试验是新城疫抗体检测的“金标准”,结合鸽场新城疫疫苗免疫实情,判定所购买的ELISA 试剂盒检测可靠性存在问题。
ELISA 检测试剂盒准确性会受到很多因素的影响。研究认为,阳性标准设定会影响试剂盒检测结果,试剂盒生产厂家通常根据企业实际需求、攻毒试验结果等自行制定阳性标准,使得检测结果与血凝抑制试验国家标准不吻合,并且不同产品的阳性判定标准也存在差异性[6,16]。也有研究[17]表明,ELISA 试剂盒易受热稳定性影响,在运输和储存过程中无法保证合适的温度,会降低ELISA 试剂盒的敏感性和特异性,降低试剂盒货架寿命,导致其准确性降低。还有研究[18]认为,ELISA 检测结果不理想与产品质量有关,部分产品为追求价格优势,而不重视产品质量,导致其准确性及有效性无法得到保证。除此之外,内外源性干扰物、交叉反应等因素也可能对ELISA 试剂盒准确度造成影响[19-20]。
本次评价的某品牌试剂盒可靠性较差,可能与ELISA 试剂盒标准设定有关。在与厂家技术人员联系过程中,厂家表示其阳性标准根据攻毒试验得出,与国家标准存在差异。也可能与试剂盒稳定性有关。喀什地区无本地产鸽新城疫抗体ELISA检测试剂盒,需从内地发货,路途较为遥远,快递时间长达7~10 d,若试剂盒热稳定性较差,且不能冷链运输,会影响试剂质量,从而影响试验结果。当然也不排除试剂盒存在质量问题的可能。总之,评价认为该产品准确性较低,不能应用于生产实际。
采购、使用不合格的ELISA 试剂盒,可能会导致严重后果。多伦多大学研究人员Prassas等[21]曾报道,因购买不合格ELISA 产品,使研究团队整整忙碌两年时间,花费超过50 万美元研究经费,却没有得到试验结果;阿拉巴马州研究人员Gutierrez 等[22]也曾因购买不合格ELISA 产品,导致试验失败,蒙受巨大经济损失。可见制定有效的ELISA 检测试剂评价方案在ELISA 试剂的研制和应用中均具有重要的意义。随着鸽产业在全国各地发展,对免疫抗体检测的需求也在增加,也有一些快检产品不断被生产出来,但其检测的可靠性不得而知。此次针对鸽专用新城疫抗体ELISA 检测试剂盒的质量评价方案参照布鲁氏菌病、乙肝等试剂盒的评价方案设计,以血凝抑制试验结果作为金标准,比对了ELISA 检测结果,通过计算其敏感性、特异性、阳性似然比、阴性似然比、符合性、约登指数、ROC 曲线,系统地体现了该ELISA 检测产品的性能及特点。这种评价方法,也可为其他类似检测试剂盒质量评价标准的建立和生产实践中检测产品的选择提供有效参考。

