刺五加苷E对野百合碱诱导肺动脉高压模型大鼠的治疗作用
田京辉,郭姗姗,陈静静,徐炳欣,赵亮
(1.河南科技大学附属许昌市中心医院药学部,许昌 461000;2.许昌市分子医学重点实验室,许昌 461000;3.第二军医大学药学院生化药学教研室,上海 200433)
肺动脉高压(pulmonary arterial hypertension,PAH)指肺动脉压力升高超过一定界值的一种血流动力学和病理生理状态,预后恶劣,严重威胁人类健康[1-2]。近年来出现的靶向治疗药物尽管改善患者的预后,但其短期疗效好,长期疗效欠佳,仅仅起到对“症”治疗的效果,远不能满足临床需求[3-4]。因此,寻找新颖有效的PAH治疗药物具有重要意义。刺五加苷E是从传统补“气”中药刺五加中分离和鉴定出的一种酚苷类化合物,是五加科植物刺五加的主要活性成分之一,具有固本强体、抗衰老、抗疲劳、提高机体适应能力、改善血液循环等多种药理学作用[5-8]。刺五加苷E能否对PAH起到防治作用,以及其潜在的作用机制尚有待研究。笔者在本研究旨在观察和探讨刺五加苷E对野百合碱(monocrotaline,MCT)诱导PAH大鼠的治疗作用及其机制,以期为PAH的防治提供新颖的候选化合物。
1 材料与方法
1.1实验动物 雄性无特定病原体(SPF)级Sprague-Dawley(SD)大鼠48只,体质量180~220 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号:SCXK(京)2019-0010。SD大鼠饲养于25 ℃恒温,相对湿度50%,常规饲料与自由饮水,以及光照/黑暗12 h交替循环的屏障环境中。
1.2试剂 刺五加苷E(中国食品药品检定研究院,批号:111713-201804);MCT[Sigma-aldrich(上海)贸易有限公司,批号:C2401];细胞核染料4’,6-diamidino-2-phenylindole(DAPI,德国Partec Flow Cytometry Technology公司,批号:05-5005);RIPA裂解液(Cell Signaling Technology公司,批号:9806);超敏型电化学发光显色(ECL)试剂盒(赛默飞世尔科技公司,批号:32134);SDS、Tris-base、甘氨酸、丙烯酰胺、聚山梨酯-20等试剂购自美国Amresco公司。
1.3仪器 蛋白电泳仪、转膜仪及Quantity One 1-D分析软件购自Bio-Rad公司;荧光显微系统Nikon ECLIPSE Ti购自尼康公司;HistoCore Arcadia 包埋机(EG1150H)、石蜡切片机(RM2235)购自上海莱卡仪器有限公司;PowerLab多导生理记录仪购自埃德仪器国际贸易(上海)有限公司。
1.4动物分组及处理 48只SD大鼠预适应饲养1周后,按数字随机分为2组,每组24只。其中模型组给予颈背部皮下注射MCT(60 mg·kg-1)造模,对照组同步给予等体积0.9%氯化钠溶液。诱导后1周,模型组和对照组分别按数字随机取12只进行刺五加苷E干预(10 mg·kg-1,腹腔注射,qd),分别为模型+刺五加苷E组和对照+刺五加苷E组,剩余12只同步给予等体积0.9%氯化钠溶液,连续给药2周后进行右心导管等评估实验。
1.5右心导管实验 给药2周后采用右心导管法测定各组大鼠血流动力学指标。大鼠称定质量后腹腔注射戊巴比妥钠进行麻醉。将大鼠固定于手术台,气管插管后,连接肺动脉压力测量仪器,暴露出右侧颈外静脉。插入PE50导管,将导管缓慢推送入心腔,向左下转动导管,观察、记录波形,分析各组动物平均肺动脉压(mean pulmonary arterial pressure,mPAP)、右心室收缩压(right ventricle systolic pressure,RVSP)等血流动力学指标。
1.6右心肥厚指数评估 处死大鼠取出完整心脏,预冷0.9%氯化钠溶液冲洗后汲干水分,分离并称取右心室(right ventricle,RV)、左心室(left ventricle,LV)及室间隔(septum,S)质量,采用下述公式计算并比较各组大鼠右心肥厚指数(right ventricle hypertrophy index,RVHI)[9],即Fulton’s指数,RVHI=RV/(LV+S)。
1.7组织病理学实验 取各组大鼠肺组织,置于4%多聚甲醛中固定24 h后,进行脱水和石蜡包埋。使用手动转轮石蜡切片机进行连续切片(厚度为4 μm),将组织切片置于烤片机上烘烤,随后进行脱蜡、苏木精染色、1%盐酸乙醇分化、返蓝、伊红染色、脱水、透明、中性树胶封片等[10],显微镜下观察肺组织血管形态。
1.8抗血浆血管性血友病因子(von Willebrand factor,vWF)和抗α-平滑肌抗体(α-SMA)免疫荧光双染法检测肺小动脉肌化水平 将组织切片用EDTA高压抗原修复后,依次进行磷酸盐缓冲液(PBS)洗涤和封闭打孔。随后,与一抗(抗vWF兔多克隆抗体,1:1500稀释;抗α-SMA小鼠多克隆抗体,1:1000稀释)4 ℃孵育过夜,37 ℃复温。PBS洗涤后,将组织切片与二抗[Fluorescein-Conjugated AffiniPure Goat Anti-Rabbit IgG(H+L)和Goat anti-Mouse IgG/Alexa Fluor®594,均1:500稀释]在避光条件下孵育2 h,洗涤,DAPI染核封片,保存于4 ℃干燥、避光环境下,于显微镜下观察摄像。
1.9Western blotting实验 用RIPA(含0.1 mmol·L-1的PMSF)裂解液提取大鼠肺组织总蛋白,取样10 μL(总蛋白约4 mg)进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析,首先用80 V电压电泳,当溴酚蓝泳动至分离胶,调整电压为120 V继续电泳至溴酚蓝达分离胶底部。转膜,在冰浴中用200 mA电流持续作用2 h,将蛋白从PAGE胶上转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜;将膜浸泡于5%牛血清白蛋白(bovine serum albumin,BSA)中,室温下封闭2 h。将磷酸化信号通路抗体(phosphatidylinositol 3-kinase,PI3K;RAC-alpha serine/threonine-protein kinase,Akt)用5% BSA稀释至工作浓度,与封闭后PVDF 膜于4 ℃孵育过夜。洗膜,将辣根过氧化物酶(horse radish peroxidase,HRP)结合的二抗用5% BSA稀释至工作浓度,与PVDF膜于室温下作用1 h;再次洗膜,在PVDF膜上滴加适量的ECL发光试剂,室温下作用1 min,用GelDocTM+系统进行曝光。用Quantity One 1-D分析软件对条带进行灰度扫描,并对其进行定量分析。
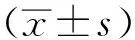
2 结果
2.1刺五加苷E对MCT诱导SD大鼠肺血流动力学影响 MCT诱导后3周,模型组大鼠RVSP(44.95±3.59) mmHg,mPAP(42.20±3.18) mmHg,均较对照组[(19.09±3.89)和(18.07±2.08) mmHg]显著升高(均P<0.01),提示经过MCT的诱导,SD大鼠已出现明确的PAH表型。模型+刺五加苷E组大鼠RVSP和mPAP均显著下降,分别为(33.18±4.85)和(31.77±5.41) mmHg,均差异有统计学意义(均P<0.01),说明刺五加苷E能够显著降低SD大鼠肺血管压力。对照+刺五加苷E组RVSP和mPAP分别(18.00±3.59)和(17.94±2.34) mmHg,与对照组比较未见明显变化,说明刺五加苷E对于正常大鼠的血流动力学并不产生明显的影响。
2.2刺五加苷E对MCT诱导SD大鼠RVHI的影响 模型组大鼠RVHI(0.41±0.07)较对照组(0.23±0.03)显著增加,差异有统计学意义(P<0.01),提示PAH大鼠出现明显的右心肥厚现象;模型+刺五加苷E组RVHI显著下降至(0.29±0.03)(P<0.01),说明刺五加苷E能够显著改善PAH大鼠右心肥厚。对照+刺五加苷E组RVHI为(0.22±0.03),与对照组比较未见明显变化,说明刺五加苷E对于正常大鼠的右心并不产生明显的影响。
2.3刺五加苷E对MCT诱导大鼠肺动脉中膜厚度影响 光镜下观察HE染色结果见图1。对照组大鼠肺组织形态结构正常,肺小动脉(直径<100 μm)血管中层约占血管总横截面积(22.32±4.40)%,而模型组血管中层明显增厚,其占比高达(47.67±2.88)%(P<0.01),模型+刺五加苷E组肺小动脉血管中层约占血管总横截面的(34.88±3.24)%,较模型组显著降低(P<0.01),提示刺五加苷E能够显著改善肺小动脉中膜肌层病理性增生,对照+刺五加苷E组占比为(23.17±3.56)%,无明显变化。
A.对照组;B.对照+刺五加苷E组;C.模型组;D模型+刺五加苷E组;①与对照组比较,P<0.01;②与模型组比较,P<0.01。图1 4组大鼠肺动脉中膜病理图(HE)A.Control group;B.Control + eleutheroside E group;C.Model group;D.Model + eleutheroside E group;①Compared with control group,P<0.01;②compared with model group,P<0.01.Fig.1 Pathological images of membrane in pulmonary artery of four groups of rats (HE)
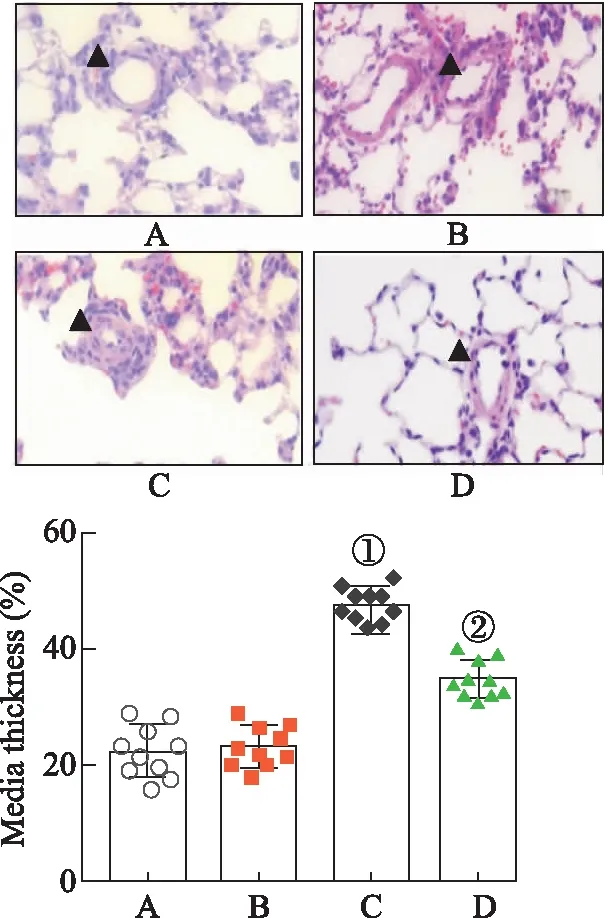
2.4刺五加苷E对MCT诱导大鼠肺小动脉肌化影响 荧光显微镜下观察肺小血管肌化程度见图2。对照组完全肌化肺小血管比例为(10±2.83)%,模型组完全肌化肺小血管比例高达(53.80±6.76)%(P<0.01),模型+刺五加苷E组完全肌化肺小血管比例降至(38.8±3.42)%,较模型组肺小血管完全肌化比例显著下降(P<0.01),对照+刺五加苷E组完全肌化肺小血管比例为(11.5±3.79)%。对于非肌化肺小血管比例而言,模型+刺五加苷E组(32.2±3.90) %较模型组(15.8±4.92)%显著升高(P<0.01),提示刺五加苷E能够改善MCT诱导的肺血管病理性重构。这一结果与上述H&E染色结果相吻合,进一步证实刺五加苷E对MCT诱导PAH大鼠的治疗作用。
A.对照组;B.对照+刺五加苷E组;C.模型组;D模型+刺五加苷E组;红色指示平滑肌细胞标志物α-SMA;绿色指示内皮细胞标志物vWF;蓝色指示细胞核标志DAPI; NM:未肌化; PM:部分肌化; FM:完全肌化;①与对照组比较,P<0.01;②与模型组比较,P<0.01。图2 刺五加苷E对MCT诱导SD大鼠肺小动脉肌化的影响A.Control group;B.Control + eleutheroside E group;C.Model group;D.Model + eleutheroside E group;Red indicates the smooth muscle cell marker α-SMA;Green indicates the endothelial cell marker vWF;Blue indicates the cell nucleus marker DAPI;NM: non-muscularized;PM: partial muscularized;FM: full muscularized;① Compared with the control group,P<0.01;② Compared with the model group,P<0.01.Fig.2 Effects of eleutheroside E on MCT-induced pulmonary arteriole muscularization in SD rats
2.5刺五加苷E抑制PI3K/Akt信号通路激活 MCT诱导3周后,与对照组比较,模型组肺组织PI3K和Akt磷酸化明显增加(均P<0.01),刺五加苷E治疗后磷酸化PI3K蛋白表达下调至模型组74%(P<0.05)(图3)。同时,观察到刺五加苷E能够显著减少MCT诱导后肺组织Akt的磷酸化(图3),干预后仅为模型组54%(P<0.01),提示刺五加苷E可能通过抑制PI3K和Akt通路逆转PAH表型。
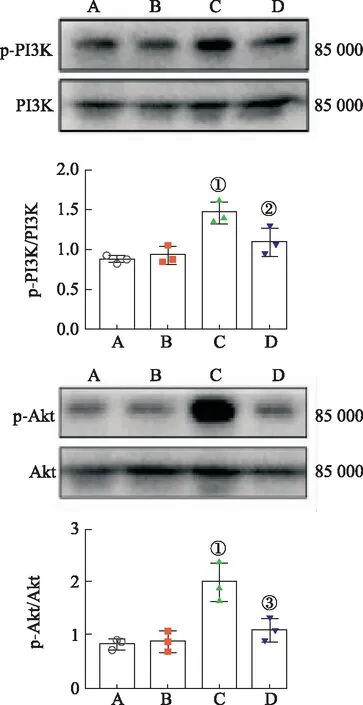
A.对照组;B.对照+刺五加苷E组;C.模型组;D模型+刺五加苷E组;①与对照组比较,P<0.01;②与模型组比较,P<0.05;③与模型组比较,P<0.01。图3 刺五加苷E对MCT诱导SD大鼠肺组织PI3K/Akt信号通路影响A.Control group;B.Control + eleutheroside E group;C.Model group;D.Model + eleutheroside E group;①Compared with control group,P<0.01;②compared with model group,P<0.05;③compared with model group,P<0.01.Fig.3 Effects of eleutheroside E on PI3K/Akt signaling pathway in lung tissues of SD rats induced by MCT
3 讨论
近年来,已有多种靶向药物陆续进入临床,但PAH患者的长期预后依然不容乐观[11]。随着中医中药事业的蓬勃发展,多种中药及提取成分已被证实有益于PAH的治疗[12]。刺五加苷E作为刺五加中最具药理活性的主要成分之一,近年来受到越来越多的关注。然而,既往的研究主要集中在其对免疫性疾病、脑血管痉挛、糖尿病等疾病的治疗,而对刺五加苷E防治PAH的研究,缺乏系统的功能评价。在本研究中,笔者通过建立MCT诱导的PAH大鼠模型,并进行刺五加苷E干预;通过血流动力学、右心肥厚指数、肺血管重构与肌化水平的检测,评估了刺五加苷E对MCT诱导PAH大鼠疾病进程的影响,首次发现刺五加苷E对PAH的治疗作用。
通常情况下,为了确证候选药物或靶点的功能,仅仅采用一种动物模型是不充分的。目前PAH基础研究领域,常用的动物模型包括:MCT-PAH大鼠模型、低氧-PAH大鼠模型和低氧+sugen5416-PAH大鼠模型等。低氧+sugen5416-PAH大鼠模型周期较长、操作相对繁琐,但能够很好模拟临床PAH患者肺组织丛样病变特征。在笔者当前的研究中,由于缺乏合适的低氧舱等设备,难以给予大鼠合适的低氧诱导环境,因此仅仅使用MCT诱导的方式进行模型的建立,这是本研究的一个局限性和不足。在未来的研究中,刺五加苷E对PAH的治疗作用还应进一步通过低氧、低氧+sugen5416等经典模型进行验证。
为了探索刺五加苷E发挥PAH治疗作用的分子机制,检测了肺组织中信号转导通路的变化。本研究结果发现,刺五加苷E显著抑制PAH大鼠肺组织PI3K和Akt蛋白的磷酸化水平。PI3K/Akt被认为是JAK下游的信号分子,PI3K磷酸化以后可迅速激活其下游的信号分子AKT,并使其活化。活化后的PI3K/Akt可进一步激活其下游mTOR(mammalian target of rapamycin),并使其转导入核,从而调节细胞的增殖、凋亡等生理病理学作用[13-14]。本研究结果进一步证实PI3K/Akt通路在介导PAH发生发展中具有重要作用[15],同时,也提示抑制PI3K/Akt通路可能是刺五加苷E发挥PAH治疗作用的潜在机制。诚然,当前这些结果还仅仅是一个线索和提示,为了确证PI3K/Akt通路正是刺五加苷E介导的调控途径,还应采用PI3K/Akt抑制剂如Capivasertib (AZD5363)、或其特异性干扰RNA等材料对该通路进行干预,以解析刺五加苷E明确的作用机制。
综上所述,本研究首次揭示传统中药提取物刺五加苷E可能通过调节PI3K/Akt途径对PAH起到治疗作用,这将为开发PAH的治疗策略提供一个新颖的选项。

