急性Stanford A型主动脉夹层患者术前炎症、凝血相关标志物及肌酐清除率与术后死亡的关系研究
高珩 邓超 李媛媛 钟亮 王雪
(1.陕西省人民医院急诊内科,陕西 西安 710068;2.西安交通大学第一附属医院心血管外科,陕西 西安 710061)
急性Stanford A型主动脉夹层(acute Stanford type A aortic dissection,aTAAD)是危及生命的的疾病,若不及时诊断和治疗,则死亡率很高,未行手术治疗的aTAAD患者的死亡率为每小时1%~2%。然而,部分患者即便行手术治疗,术后死亡率仍较高,其中住院死亡率为15%~47%[1-2]。目前高龄、高血压病史、心脏压塞、休克、冠状动脉撕裂、急性肾衰竭、急性肝衰竭、脑卒中、肠系膜缺血等危险因素被认为是aTAAD患者死亡的独立预测因子[3],但这些危险因素仍不能满足临床实践的需要。许多研究[4-5]证明炎症反应和凝血功能障碍被认为是aTAAD的发病机制。在aTAAD急性期,炎症指标大量释放,血小板(platelet,PLT)活化聚集,纤溶系统被激活,导致白细胞(white blood cell,WBC)、C反应蛋白(C-reactive protein,CRP)、纤维蛋白原(fibrinogen,FIB)、PLT和D-二聚体(D-dimer,DD)被大量产生或消耗。以往的研究主要集中在利用单独生物标志物评估aTAAD患者的预后,总是受各种因素干扰和影响。目前,一项新的研究[6]表明aTAAD是一种多因素协同作用引起的炎症和凝血功能障碍疾病。故在本研究中,纳入分析了319例aTAAD术后患者,并定期随访,探讨aTAAD患者术前炎症、凝血相关的生物标志物及肾功能指标与术后死亡率之间的关系,为aTAAD围手术期早期识别危险因素和评估预后提供客观证据,并为提前干预提供临床依据。
1 研究对象及方法
1.1 一般资料
对2019年6月—2021年6月在西安交通大学第一附属医院心血管外科住院行外科手术治疗的aTAAD患者进行筛选并随访半年。患者经计算机断层扫描,即CT血管造影,诊断为Stanford A型夹层。aTAAD患者出现症状均在2周内,年龄为18~75岁。共纳入患者365例,其中仅行手术治疗患者325例,随访半年,失访6例,最终纳入符合研究标准的患者319例。其中男性221例,女性98例,平均年龄54(46~61)岁,按照术后半年内是否死亡分为死亡组和存活组,死亡组76例,存活组243例,平均随访时间为(44±18)周。排除标准如下:(1)心源性休克或心脏压塞史;(2)医源性主动脉夹层;(3)创伤性主动脉夹层;(4)严重瓣膜疾病;(5)先天性心脏病;(6)严重的器官功能障碍,如肝肾衰竭;(7)代谢性疾病,如痛风或甲状腺功能亢进;(8)恶性肿瘤;(9)严重胃肠道疾病;(10)近期使用影响凝血、炎症及肌酐清除率(creatinine clearance rate,CCr)指标的药物;(11)过敏性疾病;(12)感染性疾病;(13)皮肤病;(14)血液系统疾病,如白血病、骨髓增生异常综合征;(15)传染病;(16)免疫系统疾病。本研究已通过西安交通大学第一附属医院临床研究伦理委员会批准(XJTU1AF2020LSK-078),所有受试者均签署书面知情同意。
1.2 检测和检查方法
所有患者均收集基础资料,留取术前检验、检查,其中WBC、中性粒细胞(neutrophile granulocyte,NEU)、PLT和CRP于全自动血液细胞分析仪(Mindray BC-6800Plus,深圳迈瑞)进行检测;天门冬氨酸氨基转移酶(aspartate amino transferase,AST)、丙氨酸氨基转移酶(alanine amino transferase,ALT)、总胆红素、尿素、肌酐、尿酸、总胆固醇、胆碱酯酶、血清白蛋白、血清球蛋白和心肌酶谱均于全自动生化分析仪(HITACHI 008AS,日本)进行检测,纤维蛋白原降解产物(fibrinogen degradation products,FDP)、FIB和DD于血凝分析仪-3(SYSMEX CS5100,日本)进行检测,脑钠肽前体(pro-brain natriuretic peptide,pro-BNP)于全自动分析仪(Radiometer AQT90,丹麦)进行检测,高敏肌钙蛋白于自动分析仪(Radiometer ABL90 FLEX,丹麦)进行检测,采用Philips IE33型超声诊断仪,应用简化Simpson法测定左室射血分数(left ventricular ejection fraction,LVEF)。
1.3 统计学方法
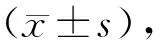
2 结果
2.1 死亡组与存活组基础、临床特征的比较
通过比较两组基础资料及临床指标,如表1,死亡组患者术前WBC、NEU、CRP、FDP、DD、肌酸激酶同工酶(creatine kinase MB,CK-MB)水平、术后呼吸机带机时间和ICU滞留时间明显高于存活组(P<0.05);死亡组患者FIB、CCr、PLT和住院时间明显低于存活组(P<0.05)。其余指标无统计学差异。

表1 死亡组和存活组基础资料、临床指标比较
2.2 影响aTAAD患者术后预后的多因素回归分析
采用多因素非条件logistic回归分析建立预测术后死亡风险的混合模型,以是否发生死亡(术后半年内死亡赋值为1,术后半年内存活赋值为0)为因变量,发现NEU、PLT、CCr、DD和FDP是影响aTAAD患者术后预后的危险因素(P<0.05),见表2。
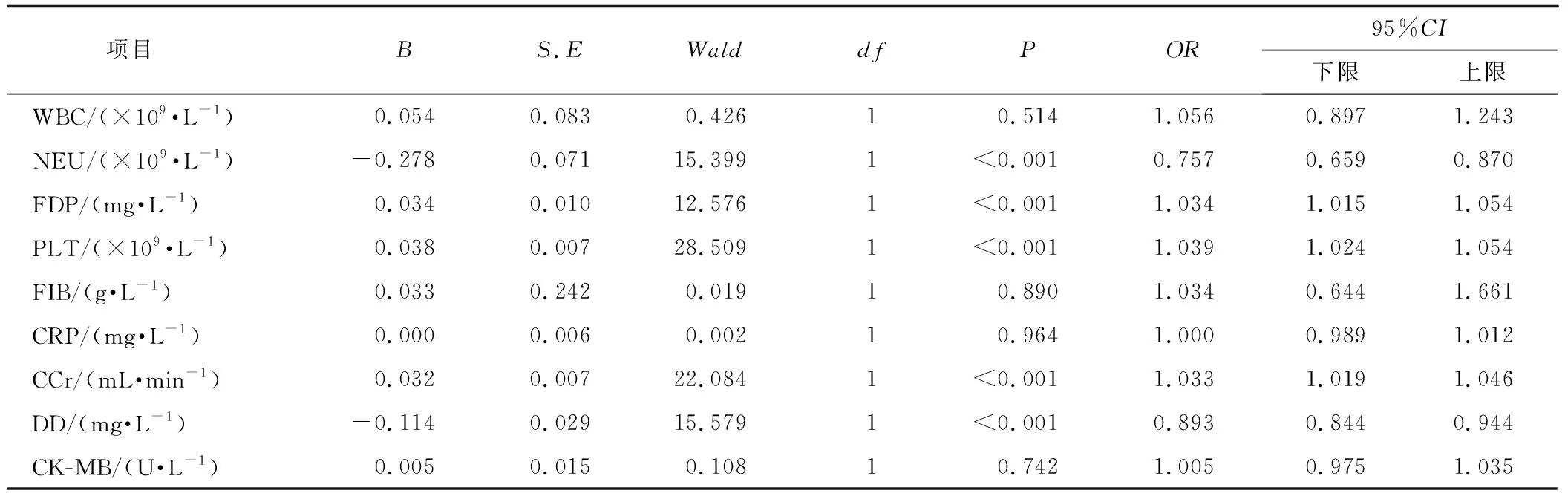
表2 影响aTAAD患者术后预后的logistic回归分析
2.3 不同指标预测aTAAD患者预后的ROC比较
通过ROC分析发现,如表3、表4和图1、图2,CCr的 ROC曲线下面积(area under the curve,AUC)为0.856(95%CI0.811~0.901),敏感度为85.5%,特异度为75.3%,PLT的AUC为0.841(95%CI0.794~0.888),敏感度为90.8%,特异度为68.7%,其余指标见表3,通过比较发现PLT敏感度最高,而CCr特异度最高,故将PLT和CCr分别与其他指标联合进行ROC分析,通过联合指标logistic回归分析得到联合指标预测概率,再将联合指标和预测概率纳入ROC分析中进行统计,结果如表4,发现CCr+PLT+NEU+DD+FDP联合预测的AUC为0.967(95%CI0.949~0.986),预测aTAAD患者预后的价值最高,其敏感度为93.4%,特异度为90.5%。

图1 不同指标独立预测aTAAD的ROC曲线

图2 不同指标联合预测aTAAD的ROC曲线
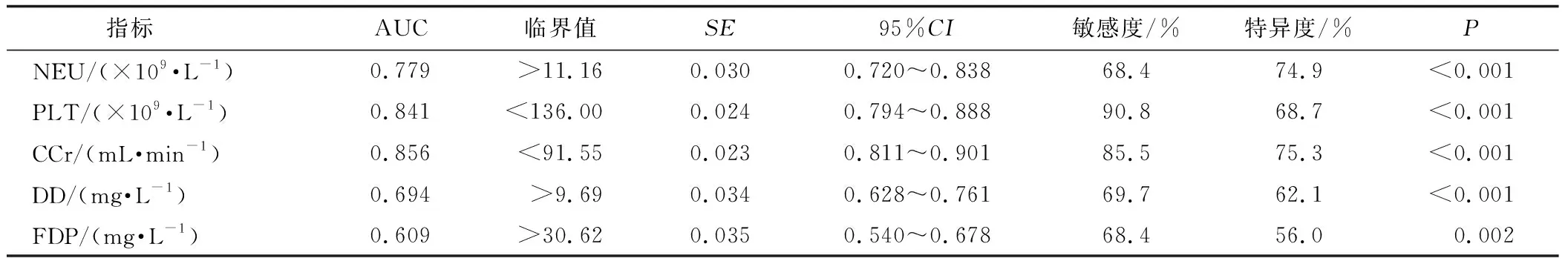
表3 不同指标对aTAAD患者预后的ROC分析

表4 不同指标联合对aTAAD患者预后的ROC分析
2.4 CCr+PLT+NEU+DD+FDP联合预测aTAAD患者预后的生存分析
通过logistic分析得出B值,将每个B值与各自指标相乘再相加,进行ROC分析得出最佳临界值为4.36,根据界值分为CCr+PLT+NEU+DD+FDP>4.36和CCr+PLT+NEU+DD+FDP≤4.36两组,绘制生存曲线发现CCr+PLT+NEU+DD+FDP≤4.36组生存率小于CCr+PLT+NEU+DD+FDP>4.36组,且Log Rank检验P<0.01,如图3。

图3 CCr+PLT+NEU+DD+FDP>4.36和CCr+PLT+NEU+DD+FDP≤4.36两组生存曲线图
3 讨论
aTAAD是心血管手术急诊治疗中最常见的疾病之一,虽经过积极手术治疗,但部分患者预后仍差,术后出现各种并发症,死亡率高,最高为89%。目前研究[7-8]发现高龄、心脏压塞、低灌注、心肌缺血、急性肾损伤、肢体缺血、脑卒中、肠系膜缺血等危险因素已被认为是aTAAD患者住院死亡的独立预测因素,但这些危险因素仍不能满足临床实践的需要,在积极纠正和预防这些危险因素后,患者的死亡率仍较高,术后并发症多。因此,早期识别aTAAD患者的危险因素可能有助于降低这些患者的死亡风险。
国内外目前研究[9-10]已发现,DD是在循环中发现的最小的纤维蛋白溶解特异性降解产物。当凝血系统被激活,体内会有大量的血栓形成,从而导致纤溶系统的过度活跃,DD的产生增加。之前研究[11-12]认为,如果DD水平在症状出现后24 h内升高,可能有助于疑似主动脉夹层患者的风险分层。aTAAD患者发生主动脉壁损伤后,大量组织因子和炎症因子释放到血液中,激活凝血系统,最终会导致纤溶系统高度被激活,随后是DD不同程度升高。近年来,许多研究[13-14]也认为DD与夹层患者临床预后差有关。DD水平升高可能是aTAAD患者死亡风险增加的原因,但机制尚不清楚。有研究发现DD可能与血栓形成的大小及血栓与血液之间的接触面积有关,此外,DD水平的升高可能是由于全身炎症与凝血之间的相互作用所致,炎症可激活凝血系统,而凝血系统的激活也可调节炎症反应。
据研究[15-16]显示,NEU在aTAAD中表达增加,并提示可能为缺血的标志物;研究[17-18]也发现aTAAD患者的WBC、NEU与aTAAD患者较高的死亡率相关。目前许多研究显示,aTAAD发病机制主要包括内皮功能障碍、氧化应激、全身炎症、肾素-血管紧张素系统激活等病理过程[19-21],其中炎症反应占据很重要的地位,炎症可破坏主动脉壁内侧层,最终导致主动脉壁扩张、夹层或破裂,主动脉壁病变机械损伤可刺激中性粒细胞趋化因子和粒细胞集落刺激因子的表达,从而促进NEU迁移和大量NEU在夹层血管壁的积累,大量炎症因子的释放进一步加剧了aTAAD发病后外膜的炎症反应,导致aTAAD进一步破裂[22-23]。
据报道,轻度以下肾功能不全的aTAAD患者接受外科手术安全、可行,术前肾功能不全是aTAAD术后血液透析的危险因素,CCr是术后血液透析的有效预测因子。术前肾功能不全的严重程度与术后结果有明显相关性[24-25],然而一部分患者术前和术后早期未表现出明显的肾功能损伤,出现延迟性肾损伤,故术前CCr不能独立预测aTAAD术后的预后。
故本研究主要是通过炎症、凝血相关标志物和CCr联合来预测aTAAD术后的长期预后的死亡率,研究发现死亡组患者术前WBC、NEU、CRP、FDP和DD水平明显高于存活组,死亡组患者FIB、CCr、PLT和住院时间明显低于存活组,通过多因素非条件logistic回归分析发现NEU、PLT、CCr、DD和FDP是影响aTAAD患者术后预后的危险因素。为了解NEU、PLT、CCr、DD和FDP对预后的预测价值,通过ROC分析发现PLT敏感度最高,而CCr特异度最高,将PLT和CCr分别与其他指标联合进行ROC分析发现CCr+PLT+NEU+DD+FDP联合预测aTAAD预后的价值最高,其敏感度为93.4%,特异度为90.5%。CCr+PLT+NEU+DD+FDP最佳临界值为4.36,根据界值分为CCr+PLT+NEU+DD+FDP>4.36和CCr+PLT+NEU+DD+FDP≤4.36两组,绘制生存曲线发现CCr+PLT+NEU+DD+FDP≤4.36组生存率小于CCr+PLT+NEU+DD+FDP>4.36组,且Log Rank检验P<0.01。故认为NEU、PLT、FDP、DD和CCr联合预测aTAAD术后长期预后比单一生物标志物高,可能原因是aTAAD内膜撕裂引起内皮下组织的暴露,大量炎症因子释放(包括NEU),进一步导致组织因子释放和凝血级联启动,体内会有大量的血栓形成,从而导致纤溶系统的过度活跃,DD和FDP的产生增加,PLT不断消耗,aTAAD不断进展,出现肾脏灌注减少,CCr有可能虽在正常范围,但较基础值逐渐下降,随着主动脉壁损伤越严重,炎症因子越多,凝血越差,肾脏损伤越重,预后就越差。考虑到血液中的NEU、PLT、FDP、DD和CCr在预测aTAAD患者预后方面的良好表现,建议在aTAAD患者入院后立即检测血液中的NEU、PLT、FDP、DD,计算CCr,可参考本文中联合预测方法及临界值,预测患者的预后。本研究的适用性还需开展大型前瞻性队列研究,进一步研究NEU、PLT、FDP、DD和CCr在指导aTAAD急诊治疗中的作用。
4 结论
aTAAD患者的术前NEU、PLT、FDP、DD和CCr均可作为此类患者长期预后的独立危险因素,其联合使用可提高临床预后评估的准确性。生化检测具有快速、简单、无创、廉价等优点,具有广阔的临床应用前景。因此,建议寻找在aTAAD患者的早期诊断和预后评估中具有价值的血液生物标志物,以便更好地指导未来的临床研究和治疗策略。