天然环肽auyuittuqamide A 的全合成研究
耿晨晨,汪甜甜,李 翔,王小彦,姜云云(1.安徽医科大学无锡临床学院,江苏 无锡 14044;.海军军医大学药学系天然药物化学教研室,上海 004;.重庆市妇幼保健院,重庆 400010;4.中国人民解放军联勤保障部队第九〇四医院,江苏 无锡 14044)
环肽主要源于植物、真菌,以及海洋天然产物和绝大多数生物有机体中[1]。环肽是具有特殊的生物活性和较强的药理活性的一类化合物[2-3]。而且大多数环肽结构比直链肽更加稳定,且脂溶性高、穿膜性强、体内半衰期长等优点[4-5],从而使环肽在抗肿瘤、抗病毒、天然领域中起着重要的作用[6-9]。
Auyuittuqamide A 是从极地海洋天然产物微孢子菌属(RKAG186)中分离得到的一种环肽化合物,它是由10 个氨基酸残基组成。Russell 等[10]从Sesquicillium microsporum中分离得到四个环十肽auyuittuqamide A-D。该类肽有一定的天然活性和对人体低毒性[11-12]。auyuittuqamide A 经过核磁共振光谱法和串联质谱法证明了这类化合物的结构。用Marfey 法[13]确定了氨基酸的绝对结构。然而,天然产物中分离提取的auyuittuqamide A 的含量很低,很难推进构效关系和下一步的研究与应用。因此,采用固相合成法合成环十肽具有成本低、时间短、操作简单等优点[14-16]。
本文用2–氯三苯甲基氯(CTC)树脂为固相载体,通过HOBT/DIC 为缩合体系,依次缩合氨基酸,完成全保护直链肽的合成。再以PyBOP/HOBT/DIPEA 为缩合体系,在DCM 溶液中液相环合[17-19],随后利用TFA 进行保护基的脱除,进而得到环十肽auyuittuqamide A(图1)。
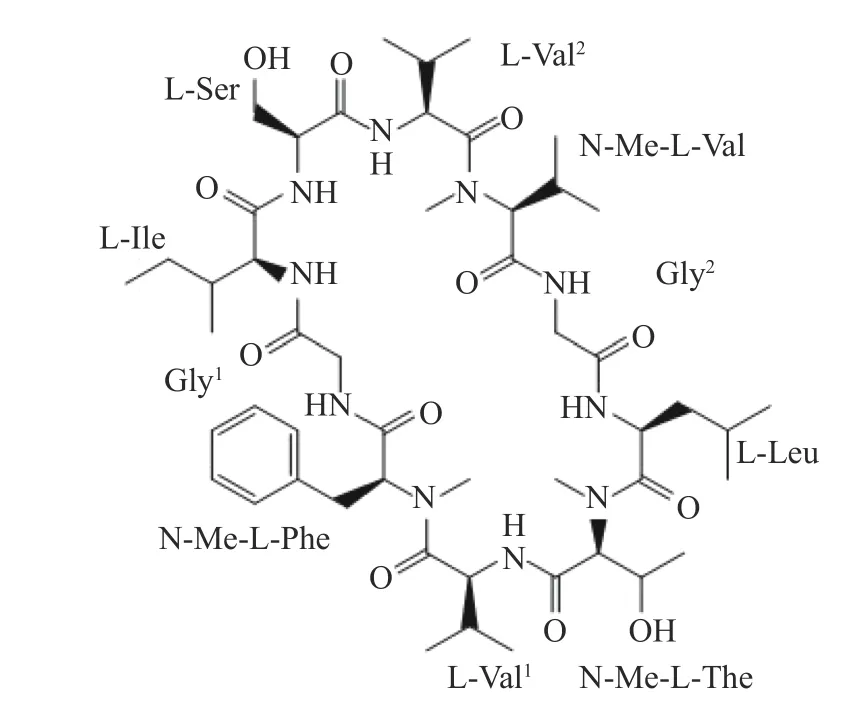
图1 Auyuittuqamide A 的结构式
1 实验部分
1.1 试剂和仪器
Fmoc-L–亮氨酸(Fmoc-Leu-OH)、Fmoc–甘氨酸(Fmoc-Gly-OH)、Fmoc-L–缬氨酸(Fmoc-Val-OH)、Fmoc-O–叔丁基–L–丝氨酸(Fmoc-Ser(tBu)-OH)、Fmoc-L–异亮氨酸(Fmoc-Ile-OH)、N-(9–芴甲氧羰酰基)-N–甲基–L–苯丙氨酸(Fmoc-N-Me-LPhe-OH)、Fmoc-N–甲基–L–缬氨酸(Fmoc-N-Me-LVal-OH)、N-Fmoc-N–甲基–O–叔丁基–L–苏氨酸(Fmoc-N-Me-Thr(tBu)-OH)[希施生物科技(上海)有限公司];2–氯三苯甲基氯(CTC)树脂(上海吉尔生化有限公司);N,N–二异丙基乙胺(DIPEA)、六氟磷酸苯并三唑–1–基–氧基三吡咯烷基磷(PyBOP)、1–羟基苯并三氮唑(HOBT)、1,3–二异丙基碳二亚胺(DIC)、三氟乙醇(TFE)、三氟乙酸(TFA)购自北京百灵威科技有限公司;N,N–二甲基甲酰胺(DMF)、二氯甲烷(DCM)(国药集团化学试剂有限公司);乙腈为色谱纯。
CHA-S 气浴恒温振荡器(江苏金坛国胜实验仪器厂);SK7200BT 超声波清洗器(上海科导超声仪器有限公司);LD5-2A 低速离心机(北京京立离心机有限公司);低温恒温反应浴(槽)、SHZ-D(Ⅲ)循环水式真空泵(上海东玺制冷仪器设备有限公司);WSZ-50A 轨道式振荡器(上海-恒科技有限公司);Waters2695/E2695 高效液相色谱仪(美国沃特世公司);LC-1 型反向制备液相色谱仪(北京创新恒通科技有限公司);6 538 UHD Accurate Mass QTOF LC/MS 质谱仪(美国安捷伦公司)。
1.2 实验方法
按图2 路线,固相合成天然环肽auyuittuqamide A。

图2 Auyuittuqamide A 的合成路线
1.2.1 直链肽固相合成
用称量纸称取2–氯三苯甲基氯(CTC)树脂1 g(载样量为0.45 mmol/g)于多肽固相合成反应管中,加入DCM(10 ml)和DMF(10 ml)溶胀树脂,20 min后抽干。用DMF 和DCM 冲洗5 遍,加Fmoc-Gly-OH(600 mg,2 mmol)和DIPEA(666 μl)的DMF 溶液入反应管中,反应管固定于CHA-S 气浴恒温振荡器中常温震荡4 h。再用DCM 和DMF 各洗涤5 遍,抽干之后再加入20%哌啶的DMF 溶液(10 ml),重复2 遍,每一遍10 min,从而脱去氨基酸上的Fmoc 保护基,再依次使用DMF 和DCM 各洗涤5 遍。之后将已经配置好的Fmoc–氨基酸–OH(2 mmol,5 倍当量),HOBT(2 mmol,5 倍当量),DIC(2 mmol,5 倍当量)的DMF 溶液加入到反应管中,反应管固定于CHA-S 气浴恒温振荡器中常温震荡2 h,反应完成之后,再使用DMF 和DCM 冲洗5 遍。重复上述步骤,依次偶联氨基酸Fmoc-NMe-L-Val-OH、Fmoc-Val-OH、Fmoc-Ser(tBu)-OH、Fmoc-Ile-OH、Fmoc-Gly-OH、Fmoc-N-Me-L-Phe-OH、Fmoc-Val-OH、Fmoc-N-Me-Thr(tBu)-OH、Fmoc-Leu-OH。
1.2.2 直链肽的切割与纯化
所有氨基酸完成偶联之后,获得直链肽–树脂复合物,使用无水乙醚将其挥干,加入TFE/DCM(1∶4,V/V)混合溶液10 ml,放置在轨道式振荡器,常温震荡4 h。过滤并收集滤液,滤液用旋转蒸发仪蒸干,获得直链肽粗品,粗品用制备型RPHPLC 进行纯化,再使用冻干机将其干燥,获得纯品直链肽。
1.2.3 直链肽的环合
在0 ℃的条件下将直链肽溶于50 ml 的DCM溶液缓慢滴加入HOBT(3 eq)、PyBOP(5 eq)、DIPEA(10 eq)溶于DCM 50 ml 中,滴加完成之后,于常温搅拌反应过夜。反应结束后,使用旋转蒸发仪蒸干反应溶剂,获得目标粗品,再将粗品用制备型RP-HPLC 纯化,再使用冻干机将其干燥,获得纯品环肽。
1.2.4 环肽侧链保护基的脱除与纯化
先配置脱除侧链保护基溶液12 ml(TFA/DCM=1/3),将溶液加入到环肽冻干后的纯品中,固定于轨道式振荡器,常温震荡反应4 h。
1.2.5 纯化条件
色谱条件:Ryoung C18色谱柱(20mm×250 mm,10 μm);流动相A:水+0.1%TFA,流动相B:乙腈+0.1%TFA,梯度洗脱:(0~5 min,40% B;5~60 min,40%~70% B);流速:20ml/min;紫外检测波长214 nm。
2 结果与讨论
2.1 Auyuittuqamide A 直链肽的HPLC 和高分辨质谱表征
本步是将直链肽从树脂上切割,得到油状物粗品360 mg,再将粗品进行纯化,得到纯品100 mg,收率为:[实际值100mg/(理论值1 144×0.45 mmol)]×100%=19.42%,HPLC 图谱如 图3 所示,HR-QTOF-MS 质谱图中对应的[M+H]+峰1 145.744 4,[M+Na]+峰1 167.726 6 显示的分子量与直链肽auyuittuqamide A 相吻合。
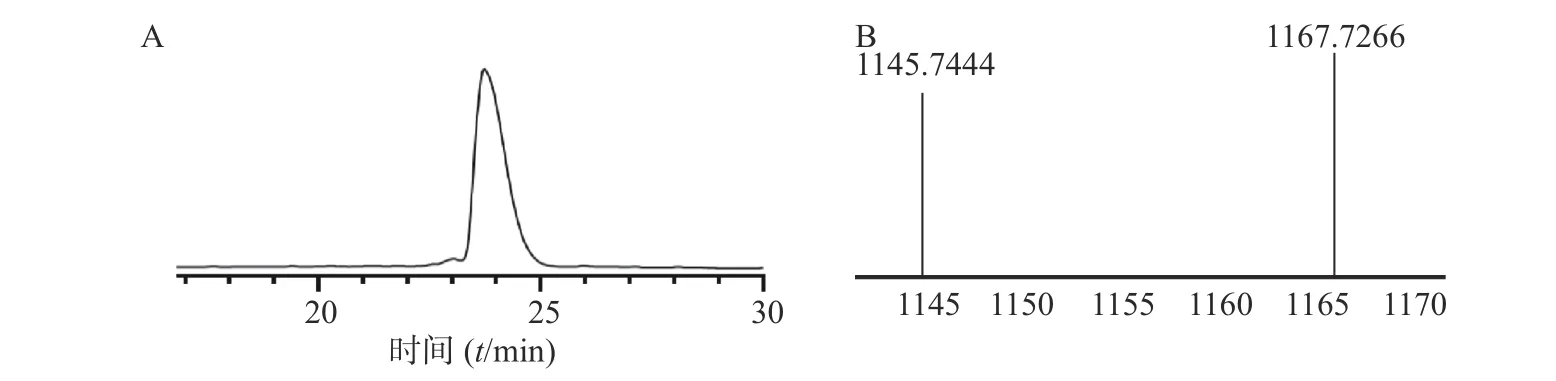
图3 Auyuittuqamide A 全保护直链肽HPLC (A)和HR-Q-TOF-MS (B)谱图
本步是将直链肽纯品进行环合,得到油状物粗品,再将粗品进行纯化,得到纯品30 mg,此步收率为:[实际值30mg/(理论值1 126×0.45 mmol)]×100%=5.92%,HPLC 图谱如图4 所示,HR-Q-TOFMS 质谱图中对应的[M+H]+峰1 127.734 6,[M+Na]+峰1 149.715 9 显示的分子量与auyuittuqamide A 直链肽环合后分子量相吻合。
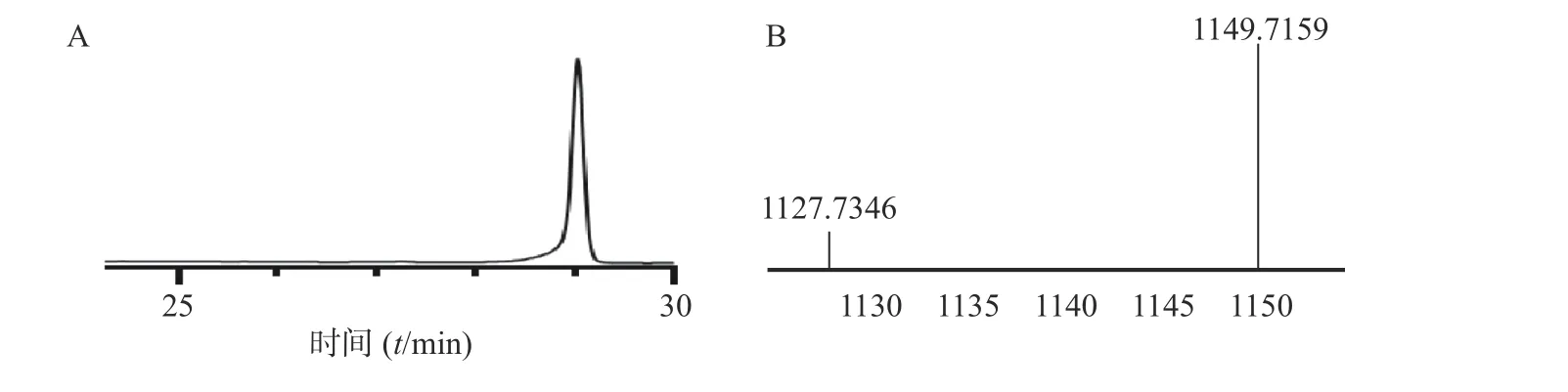
图4 直链肽环合后HPLC (A)和HR-Q-TOF-MS (B)谱图
本步是将环合后纯品脱除侧链保护基,得到油状物粗品,再用乙腈和水溶解,最后冻干得到纯品25 mg,收率为:[实际值25mg/(理论值1 014×0.45mmol)]×100%=5.48%,HPLC 图谱如 图5 所示,HR-Q-TOF-MS 质谱图中对应的[M+H]+峰1 015.611 5,[M+Na]+峰1 037.593 7 显示的分子量与环肽auyuittuqamide A 分子量相吻合。
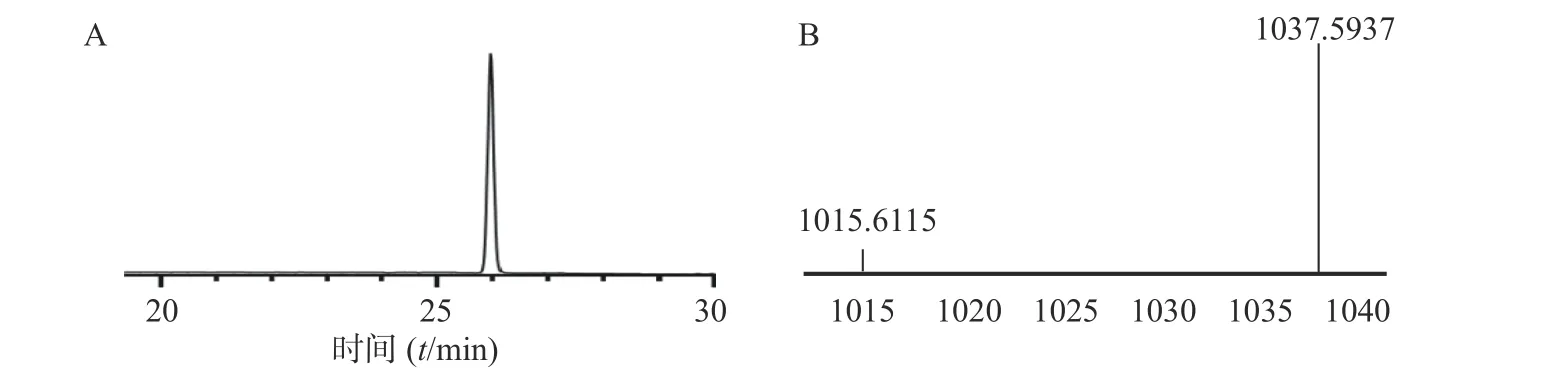
图5 Auyuittuqamide A 纯品的HPLC(A)和 HR-Q-TOF-MS(B)谱图
2.2 Auyuittuqamide A 的核磁共振氢谱表征
本研究通过500MHz 核磁共振氢谱对环肽进一步表征,确认与文献中auyuittuqamide A 的核磁共振氢谱相符。1H-NMR (500MHz,d-DMSO)δ:8.91 (d,J=9.85 Hz,1H),8.70 (d,J=9.5Hz,1H),8.55 (d,J=6.95 Hz,1H),7.75 (t,J=5.5 Hz,1H),7.47−7.43 (m,3H),7.27−7.17 (m,5H),5.01 (d,J=9.75 Hz,1H),4.88 (m,1H),4.59−4.52 (m,2H),4.45(t,J=9.15 Hz,1H),4.39 (t,J=8.8 Hz,1H),3.32(dd,J=4.3 Hz,1H),3.88−3.82 (m,2H),3.78 (t,J=6.5 Hz,2H),3.74 (d,J=4.45 Hz,1H),3.33−3.27 (m,4H),3.22 (s,3H),3.17−3.13 (m,4H),2.98−2.93 (m,1H),2.48−2.45 (m,7H),1.97 (m,1H),1.87−1.82 (m,2H),1.64−1.60 (m,2H),1.20−1.13 (m,3H),1.01 (d,J=6.5 Hz,3H),0.86 (d,J=5.75 Hz,3H),0.82−0.78(m,17H),0.76−0.72 (m,5H),0.70 (d,J=6.45 Hz,3H)。
3 讨论
本法采用先固相合成直链肽,再液相进行环合获得目标产物auyuittuqamide A。并且采用先环合,再脱除侧链保护基,从而有效地避免了侧链裸露的羟基对环合时的影响[20]。使用高效液相色谱进行纯化,得到纯品纯度大于95%,收率为5.48%的目标产物auyuittuqamide A。本研究首次完成了对auyuittuqamide A 的全合成,本法优点:更为省时,方法简单,易于操作,且经济实用。缺点:产率还有待提高,方法需进一步优化。总的来说,本方法为该类环肽化合物的全合成提供了参考。

