间充质干细胞治疗自闭症的研究进展①
杨淑钧 申 晨 李 萌 曹 霞 (昆明医科大学第二附属医院中心实验室,昆明 650101)
自闭症谱系障碍(autism spectrum disorders,ASD)是一种异质性精神发育障碍性疾病,其基本特征是社交技能和认知灵活性严重受损[1]。男孩患自闭症的概率比女孩高3~4倍。根据美国相关调查发现,近10年来,自闭症患病率由1/125上升至1/59,而我国自闭症患者数量也在逐年攀增,仅6~12岁儿童中ASD患者数量就高达70~100万例,ASD被认为是增长最快的发育障碍性疾病[2]。但由于ASD是多因素导致的,其具体发病机制尚不明确,患者在症状、智力水平、严重程度和功能障碍方面差异很大,因此至今无法治愈。现有的常规干预措施疗效有限,促使研究者们在细胞和分子水平上寻找针对ASD病变的生物学疗法[3]。干细胞移植对于患有无法治愈的脑部疾病的患者具有良好的治疗潜力,且有研究表明细胞移植可能影响与ASD相关的病理生理机制,因此提出了基于干细胞的再生疗法来治疗ASD。而间充质干细胞(mesenchymal stem cells,MSCs)是临床研究中最常用的细胞,具有强大的增殖能力和多向分化能力、免疫调节功能、旁分泌再生功能、神经保护作用等,可通过诱导免疫调节治疗脑部疾病、增强神经发生、提高神经营养因子水平,且其来源丰富,采集方便,免疫原性低,这些都体现了其治疗ASD的潜力[4-5]。本文总结了近年来通过移植MSCs治疗自闭症的研究结果,为采用MSCs治疗自闭症提供重要线索。
1 自闭症的治疗现状
由于自闭症本身发病机制的复杂性,导致患者在发病症状、严重程度上差异很大,因此只能根据其核心症状和相关症状进行观察性方法和心理检测诊断。美国出版的《精神疾病诊断和统计手册》通常被用作自闭症诊断的金标准[3]。
对于ASD的治疗,现有的治疗方法可分为药理、营养和行为学方法,但不存在定义的标准方法。药理学方法一般针对ASD相关的神经精神症状,如易怒和多动等相关症状,常用药有精神刺激药、非典型抗精神病药、抗抑郁药、抗惊厥情绪稳定剂等,但目前尚无药物被批准用于治疗自闭症的核心症状。其他治疗方法包括非精神药物治疗(乙酰胆碱酯酶抑制剂、肉碱、维生素C)、反复经颅磁刺激治疗法、激素治疗法(褪黑素、催产素和加压素)、免疫调节和抗炎治疗。行为治疗是自闭症的有效干预策略,包括早期强化认知行为疗法、言语治疗、社交技能培训、特殊教育和职业培训、音乐疗法,然而,尚无明确的行为干预治疗方法可完全改善自闭症患者的所有症状[6-8]。如何更好地治疗ASD仍需进一步研究。
目前,新型治疗方法有基因治疗和干细胞治疗[3,9]。鉴于ASD患者的免疫失调,干细胞疗法已被提出并应用于自闭症治疗。其中,MSCs所具有的免疫学特性使其成为治疗ASD的候选细胞。
2 MSCs治疗自闭症的机制
干细胞是一类具有自我复制能力的多潜能细胞。有研究指出,干细胞的旁分泌、免疫调节作用是治疗ASD的潜在机制[10]。ASD患者是患有精神疾病的群体,其大脑中的神经发生通常缓慢而有限,且ASD患者表现出先天性和适应性免疫失衡,其免疫系统通常产生异常且强烈的促炎细胞因子,这些改变会导致长期免疫失调[11];相关研究表明,ASD患者大脑的某些神经细胞(星形胶质细胞、小胶质细胞及浦肯野细胞等)形态与数量存在异常[12]。而干细胞的免疫调节和分化能力可恢复这些免疫改变和神经发生。因此,在许多研究中,干细胞被用来治疗ASD,并展现出很好的治疗效果。
MSCs是干细胞家族的重要成员,是中胚层起源的祖细胞群,最早在含量丰富的骨髓中发现,之后发现其也存在于胎盘、脐带、脂肪等组织中,具有强大的增殖能力和多向分化能力,还有免疫调节功能、来源方便、易于分离培养、表面抗原不明显、异体移植排异较轻等特点。目前,MSCs已广泛运用于血液系统疾病、心血管疾病、自身免疫疾病等研究中,在神经系统修复方面具有长远的发展前景,在医学研究中显示出良好效果[13-14],许多研究人员将其用来治疗ASD,无论是在动物实验还是临床研究中,ASD的症状都因此得到明显缓解。
根据相关研究,MSCs的以下特点使其成为治疗ASD的候选:①刺激宿主受损组织的可塑性反应,如炎症性肠道疾病;②合成和释放抗炎细胞因子和促进生存的生长因子(旁分泌);③移植后,MSCs靶向迁移至损伤部位,对局部环境做出反应,如整合到现有的神经和突触网络[10,15-16];④不存在不可控的生长和肿瘤发生,不引起道德异议[17]。
典型的ASD患者表现出T细胞和B细胞介导的免疫功能改变,以及CD3+、CD4+、CD8+T细胞和自然杀伤(NK)细胞失衡,在此基础上,MSCs介导的调节作用,如抑制CD8+/CD4+T淋巴细胞和NK细胞增殖,抑制浆细胞产生免疫球蛋白,抑制树突状细胞成熟等是恢复免疫平衡的最佳途径,这是通过药物干预无法获得的[17]。其次,自闭症患者中提取的外周血单核细胞过度产生IL-1β,导致长期免疫改变,而MSCs介导的免疫抑制活性(抑制TNF-α和IFN-γ的产生和增加IL-10水平)可以恢复这种免疫失衡[15]。另有证据显示,自闭症受试者的小脑浦肯野细胞数量减少,而移植的MSCs能够促进突触可塑性和功能恢复,并挽救小脑浦肯野细胞[18-19]。MSCs针对ASD相关异常改变做出的潜在改善作用如表1所示。
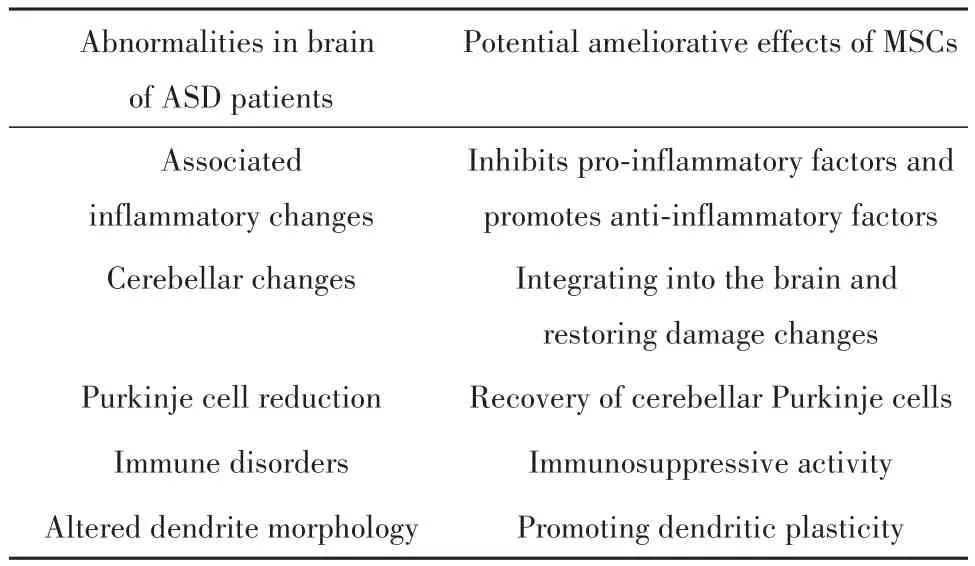
表1 MSCs治疗ASD的机制Tab.1 Mechanism of MSCs for treatment of ASD
3 MSCs治疗自闭症动物模型(BTBR小鼠)的试验
近交小鼠品系BTBR表现出ASD所有核心症状,且有遗传稳定性和商业可得性,是评估自闭症样行为的公认动物模型[20]。SEGAL-GAVISH 等[21]采用皮下注射的方式将MSCs移植于BTBR小鼠的侧脑室,以假手术组为对照,检测移植后的行为学变化和病理学变化,发现MSC移植组的刻板印象行为水平较对照组明显降低(挖掘时间减少46%,梳理时间减少60%);MSC组认知僵化强度降低,适应环境变化的灵活性提高(水迷宫试验中的空间学习和记忆能力、转轮试验中的认知僵化指标改善);社交互动试验中,MSC组花费更多时间进行社交互动(三室试验);MSC组的脑源性神经营养因子(BDNF)较对照组增加36%,齿状回中神经干细胞增殖增加。2017年PERETS等[22]将MSCs分化为能分泌更高水平神经营养因子的细胞(NurOwn®),并将其移植到BTBR小鼠侧脑室,发现治疗后NurOwn®组BTBR小鼠的社交行为得到明显改善,雌雄间发声次数增加,重复梳理的时间减少,认知灵活性得到明显改善。首次显示了可测量的所有行为表型的改善,且具有长达6个月的长期效果。而近期的另一项研究表明MSCs的治疗作用主要是通过分泌包含重要分子信息的囊泡(MSC-exo)介导,该实验仅对BTBR小鼠使用MSC-exo(鼻内给药)就可明显改善所有ASD样症状[23]。
4 MSCs治疗自闭症的临床试验
鉴于在这种疾病中观察到的免疫和精神失调,2013年 LV等[24]研究了人脐带血单核细胞(cord blood mononuclear cells,CBMNCs)与脐带来源间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)联合移植治疗自闭症儿童的安全性和有效性,37例(3~12岁)自闭症患者参加了这项研究(分为CBMNC组、联合组及对照组),受试者每周1次静脉和4次鞘内注射干细胞,未发现与治疗相关的重大不良反应,且最后由儿童自闭症评定量表(CARS)、临床总体印象量表(CGI)和异常行为检查表(ABC)显示的结果表示:联合移植CBMNCs和UCMSCs的效果优于单独移植CBMNCs。同年,SHARMA等[25]研究了将含有MSCs的自体骨髓单个核细胞(BMNC)经鞘内移植到32例(3~33岁)自闭症患者体内的疗效,经26个月的随访,发现96%的患者在各种行为量表上的得分均有所改善,体现出患者情绪反应、交流、认知及行为模式等方面的改善,但同时观察到少数可用药物控制的不良反应(癫痫和多动)。该研究表明细胞治疗具有协同效应,还可能平衡大脑的新陈代谢。2019年,RIORDAN等[26]的一份研究调查了对ASD患儿使用同种异体UCMSC的安全性和有效性,20例(6~16岁)自闭症患者每12周接受1次干细胞静脉移植(与治疗前进行自身对照),随访1年,在治疗最后1次后3个月和12个月进行评估,发现治疗过程中,与治疗有关的不良事件(头痛、发烧和疲劳)为轻度或中度,持续时间短,而且8例受试者的CARS和自闭症治疗评估清单(ATEC)得分下降,其中5例受试者血清炎症细胞因子水平降低。2020年的一项研究评估了使用自体骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSCs)鞘内注射治疗ASD的安全性及有效性,通过将32例(5~15岁)患者随机分为治疗组和对照组,治疗组患者在4周时间内鞘内注射2次BMMSCs,之后并未发现与注射相关的副作用,但并未达到预期的治疗效果(仅CGI结果有微小的改善),该研究认为,尽管自体BMMSCs的使用是安全的,但考虑到昂贵、复杂的制备和注射过程及其微弱的疗效,其性价比并不理想[27]。同时,现有的MSCs治疗自闭症的临床试验还较少,因此,不同MSCs治疗ASD的安全性及有效性仍需进一步研究。
5 不足与缺陷
5.1 受试者数量相对较少 现有的临床试验使用的样本量较少,以上案例多是基于少量受试者,50例受试者以上的相关研究极少,这或许是由于参与者自身或家庭因素以及对研究内容不了解导致对最后结果的担忧,使参加研究的人数较少,临床研究样本不足会对结果的可靠性造成一定影响[24]。
5.2 随访时间 尽管上述临床试验总体上报告了ASD患者进行MSCs移植治疗的安全性,但现有的关于该研究的随访时间大多只有治疗后的12个月,目前暂无长期影响的数据,但自闭症的治疗效果需要更长的时间观察[3]。
5.3 疗效评定 ASD的疗效评定方法应通过国际认可、标准化,需要统一的量表进行评估,目前虽有美国出版的《精神疾病诊断和统计手册》被用作自闭症诊断的金标准,但干扰因素多,无法正确且稳定地评估。使用MSCs治疗自闭症就可以对炎症标志物进行检测,先进的成像研究也可以更好地了解MSCs对ASD患者的生物学影响。尽管如此,因自闭症的病情受生活环境和家庭因素差异的影响也较大,MSCs的后续治疗效果也许会因此混淆。
5.4 细胞来源 现有的临床研究中用于治疗ASD的MSCs类型很多,如UCMSCs、同种异体UCMSCs、BMMSCs等,研究都证实了这种治疗方法的安全性,但其疗效并未得到统一的结果,因此需要进一步研究可能有效的MSCs。现已知ASD有遗传异质性,因此ASD受试者体内会存在某些遗传修饰,所有细胞类型都保留这些改变。因此可以尝试同种异体移植,但需要考虑捐助者的细胞获得性和有可能的传染病测试[26-27]。
5.5 给药途径及频率 上文临床研究中有静脉移植和鞘内注射,动物研究还使用过鼻内给药。静脉给药属于全身给药,无吸收过程且起效快;鞘内注射属于局部给药,较静脉注射更有针对性,可克服血-脑脊液屏障,使细胞随脑脊液循环自然到达蛛网膜下腔,从而弥散在整个脑室系统,而不会造成任何神经损伤;动物实验的鼻内给药途径可增加药物的脑内递送,且鼻黏膜对抗原具有一定敏感性,但由于低渗透性和较高的代谢降解,因此对生物大分子的递送有限制性,且有研究表示长期鼻内给药可能导致鼻黏膜完整性丧失。目前关于MSCs治疗ASD的给药途径并无统一意见,且给药频率和剂量也没有标准。这些都会影响患者配合度和治疗效果,以致研究结果存在差异。
6 展望
尽管现有的研究都肯定了MSCs治疗ASD的安全性和有效性,显示出其潜在研究价值,但要想证明MSCs治疗ASD的疗效,还须对MSCs的作用机制进行更加深入、全面、详尽的研究和大规模临床试验,以确定给药后的组织分布、长期安全有效性及最佳干预年龄,从而更好地了解MSCs对自闭症的治疗效果及其机制[28]。