胆囊切除术后Hem-o-lok夹胆管移位3例报告
中国人民解放军联勤保障部队第九四〇医院 付振东,范瑞芳,党 政,李月胜,许树林,蔺志鹏,缪佰纹,庞耀平,秦建伟
近年,随着饮食结构的改变,成年人中10%~15%患有胆道系统结石性疾病,其中1%~3%每年发生急性胆囊炎或急性胆管炎[1-2]。随着腹腔镜技术的发展,腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)及腹腔镜胆总管探查术(laparoscopic common bile duct exploration,LCBDE)越来越多地用于治疗胆囊结石及胆总管结石。LC术中结扎夹的使用可使胆囊管与血管有效闭合,节省手术时间。Hem-o-lok结扎夹是由不可吸收的多聚合物材料制成,具有组织反应性小、结扎范围广、闭合力度均匀、无组织切割等优点,是目前夹闭胆囊管及胆囊血管的常用方法之一[3]。近年,有关LC术后Hem-o-lok结扎夹移位的报道逐渐增多,回顾文献报道,Hem-o-lok夹向胆道迁移或诱发结石形成的病例有33例,其中多数为LC+LCBDE术后出现,少数为LC术后出现[2-15]。本文回顾性分析我院3例Hem-o-lok夹迁移入胆总管患者的临床资料,结合既往病例报道,探讨其发生机制、治疗及预防策略。病例1,男,43岁,既往因“胆囊结石伴慢性胆囊炎”于外院行LC,手术顺利,术后恢复良好。术后4个月患者出现皮肤巩膜黄染并进行性加重,无腹痛、发热等,外院CT及我院腹部B超提示:胆管腔内数枚结石并胆管扩张;胆囊切除术后。遂行LCBDE+胆道镜取石术,胆总管切开探查见2枚Hem-o-lok夹完全迁移至胆道内,周围散在碎屑样结石,未见胆管明显狭窄(图1)。胆管外未见其他Hem-o-lok夹,取出Hem-o-lok夹并一期缝合胆总管,随访6个月,患者恢复良好。病例2,女,61岁,因胆囊结石伴急性胆囊炎在当地医院行LC,术中分别使用2枚Hem-o-lok夹闭胆囊管、胆囊动脉。术后5个月出现皮肤巩膜黄染。MRCP提示:胆总管局部截断,致肝内外胆管扩张,肝内胆管炎(图2)。术前考虑胆囊切除术中医源性胆道损伤及瘢痕愈合致胆道狭窄,拟行剖腹探查术+胆总管探查+胆肠吻合术。术中探查见胆囊管残端与肝总管汇合处可见一约2 cm大的不规则纤维包块,压迫胆总管,遂切开病变胆管段,见胆管腔内4枚Hem-o-lok夹及胆总管内黑色胆色素性结石(图3)。清理Hem-o-lok夹及结石后行胆肠吻合术并修整胆管,随访6个月患者恢复良好。病例3,女,51岁,因先天性胆总管囊肿(Ⅰ型)于我院行LC+胆总管囊肿切除术+胆管空肠吻合术,术中用两枚Hem-o-lok夹闭胆囊管与胆囊动脉。术后3个月患者出现间歇性高热、全身黄染症状;上腹部CT提示:胆肠吻合口高密度异物影,胆管-空肠吻合肠壁略厚并肝内胆管轻度扩张(图4)。术前考虑吻合口缝线致结石形成,阻塞吻合口引起胆管炎症状,遂再次行腹腔镜手术探查,沿原胆肠吻合口肠袢侧向上切开吻合口,见两枚Hem-o-lok夹移行于胆总管内,其中1枚部分嵌顿于胆管壁(图5、图6),周围泥沙样结石,吻合口局部瘢痕形成致吻合口狭窄,取出Hem-o-lok夹,修整并再次吻合胆管空肠,随访3个月患者恢复良好。
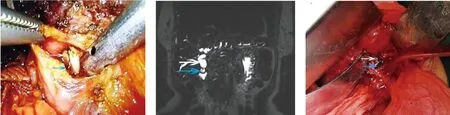
图1 胆总管管壁结构清晰,周围未见明显炎症及粘连,腔内见2枚Hem-o-lok夹(白色箭头)及泥沙样结石(蓝色箭头)

图4 CT水平面胆肠吻合口见两枚Hem-o-lok夹(蓝色箭头)
讨 论 Hem-o-lok夹由不可吸收的聚合材料构成,于1999年引入临床,其所具有的卡扣结构极大降低了脱落风险,缩短了手术时间,提高了管道闭合的安全性,并且不干扰影像学检查,传统观念认为是安全的手术材料[6]。近年,随着Hem-o-lok在临床的广泛使用及其相关并发症的报道,临床工作者对其临床使用的安全性有了新的认识。研究显示,非金属夹用于夹闭胆囊管及胆囊动脉,术后夹子移位至胆总管的发生率为1.8%[6],而针对1 600例使用Hem-o-lok夹的LC患者进行调查,发现术后8例发生Hem-o-lok移位,发生率为0.5%,且术后数天内Hem-o-lok发生移位可能导致LC术后出血与胆漏[7]。虽然Hem-o-lok移位率并不高,但其导致的并发症严重影响预后且增加患者的经济负担,因此,了解Hem-o-lok术后移位的发生机制及预防策略利于降低Hem-o-lok移位的发生率,进而提高临床工作质量,改善预后。
目前,有关Hem-o-lok术后移位的发生机制尚不明确,针对其移位原因的分析各报道也存在差异。炎症是影响其移位的一个重要因素,有关研究发现,急性化脓性胆囊炎患者术后Hem-o-lok更容易发生移位[8],可能因炎症的发生会引起局部组织发生粘连,并使周围组织的脆性增加,导致Hem-o-lok移位。LC+LCBDE胆道一期缝合术后存在较高的胆漏风险[16],胆漏的发生会导致局部炎症的发生,从而导致Hem-o-lok从胆囊管/动脉残端脱落并通过胆总管切口迁移至胆道[9],这可能是LC+LCBDE较LC术后更容易出现Hem-o-lok移位的原因。除炎症介导外,Hem-o-lok的移位还与术者的操作技术、胆囊炎症程度、组织缺血坏死、机体排异反应、胆道探查、机械切割、胆管或胃肠壁损伤伴充血及水肿、Hem-o-lok夹闭胆囊管/动脉位置不正确、使用Hem-o-lok的数量等因素有关[5,10]。有关报道显示,LC术中金属夹的使用可导致胆漏,或周围结构压迫金属夹致其移位[17-18],上述因素也可能导致Hem-o-lok移位至胆总管。Hem-o-lok移位以胆总管常见,也有迁移至十二指肠球部并导致溃疡的报道[19-22],发生机制可能与Hem-o-lok夹闭不全、放置位置不当或炎症反应等有关,炎症反应可引起十二指肠粘连、质地变脆,Hem-o-lok缓慢切开质脆的十二指肠进入肠壁[23]。Hem-o-lok属于不可吸收的多聚合物夹,近年,可吸收的组织夹逐渐被推广,虽然价格昂贵,但有望成为降低游走风险的首选[24]。关于Hem-o-lok夹与可吸收夹临床应用的选择性,有研究者从手术时间、术后住院时间、术后并发症、耗材费用方面进行对比分析,表明Hem-o-lok性价比更高[25]。对于两者临床应用的选择尚存在争议,且缺乏全面系统的对比研究为临床选择提供理论支持。值得注意的是,此类报道中,术前对于Hem-o-lok移位至胆总管的诊断并不明确,患者多因胆总管再发结石导致胆管炎及胰腺炎而就诊,临床表现与原发或继发性胆管结石引起的症状相似[26],这提示临床工作者对于LC或LC+ LCBDE术后患者出现上述症状时,应考虑是否由Hem-o-lok移位引起。
为降低Hem-o-lok移位的发生率,炎症控制是重要手段。对于急性胆囊炎的处理,主刀尽量具备丰富的临床经验,且应准确辨识及分离胆囊周围结构,尽量减少周围组织的创伤,避免误伤胆总管,准确夹闭胆囊管及胆囊动脉,以减少术后组织炎症及纤维化,减少Hem-o-lok夹移位。此外,应注意Hem-o-lok所夹位置及使用方法,术中Hem-o-lok的夹闭位置应距胆囊管与肝总管汇合处约0.5 cm,以减少术后瘢痕挛缩所致的结扎夹移位[5,11]。患者若为排异体质,临床医生则需要考虑使用可吸收夹或其他方式替代Hem-o-lok,从而避免Hem-o-lok的移位。对于是否用可吸收夹取代Hem-o-lok,以减少术后移位,笔者不予赞同,虽然Hem-o-lok及可吸收夹用于夹闭胆囊管及胆囊动脉均是安全、可靠的,但相比而言,Hem-o-lok性价比更高,值得在LC中推广应用[25]。
病例2中,患者既往因胆囊结石伴急性胆囊炎行LC,术后胆囊管残端局部炎症并纤维化包裹胆囊管及胆囊动脉处的Hem-o-lok,导致Hem-o-lok移位至胆总管。胆囊急性炎症更容易诱发局部炎症及排异反应发生,导致局部纤维化及Hem-o-lok移位,因此急性胆囊炎术后应积极予以抗感染、营养支持等治疗,避免术后术区炎症反复发作及纤维化形成,进而降低Hem-o-lok移位的风险。
近年,谐波超声刀等逐渐应用于胆囊切除术,Kandil等进行的一项前瞻性随机研究中指出,与传统LC相比,利用谐波刀行LC手术时间短,止血效果更好,是安全的替代方案[27],可有效避免Hem-o-lok移位的发生。但由于谐波刀装置昂贵,用于LC需考虑成本问题。
总之,LC或LC+LCBDE术后诸多因素促使Hem-o-lok移位,并促使胆总管结石形成,诱发胆管炎、胰腺炎等,但具体发生机制尚未明确,进一步病理学研究明确其发生机制是必要的。术者在熟练掌握LC手术要点、提升LC学习曲线的基础上,Hem-o-lok仍然可作为夹闭胆囊管、胆囊动脉安全有效的方法。当然,为减少术后Hem-o-lok的移位,可选择排斥反应小的可吸收生物夹及可吸收缝线替代,或选择谐波刀等,进而提升手术安全性、缩短手术时间、减轻术后疼痛。

