程序化单孔腹腔镜脾脏切除术治疗儿童遗传性球形红细胞增多症
李中策,卞 剑,孟立祥,戚士芹
(1.安徽医科大学第五临床医学院,安徽 合肥,230051;2.安徽医科大学附属省儿童医院普通外科)
遗传性球形红细胞增多症(hereditary spherocytosis,HS)是因先天性红细胞膜蛋白基因突变导致的红细胞膜异常,患儿主要表现为贫血、黄疸、脾大等症状,是儿童常见的慢性先天性溶血性疾病[1-2]。随着诊断技术的进步,HS在婴幼儿期即可得到明确诊断并通过输血使重症者得以存活,这些儿童HS症状重,其治疗尤其微创治疗较为困难[3]。目前脾切除术仍是治疗HS最有效的方法[4]。随着腹腔镜技术的成熟与发展,腹腔镜脾切除术(laparoscopic splenectomy,LS)逐渐成为脾脏切除的标准术式[5-6]。单孔腹腔镜脾脏切除术(single-incision laparoscopic splenectomy,SILS)可达到体表无疤痕的美容效果,是理想术式,但操作难度大。我们在多孔LS熟练后制定程序化手术步骤、精准操作,于2015年2月至2022年5月为67例儿童HS成功施行SILS,现将体会与经验报道如下。
1 资料与方法
1.1 临床资料 本组67例患儿中男38例(57%),女29例(43%),20个月~18岁,平均(6.00±3.50)岁。患儿均经溶血指标检测、基因分析等方法明确诊断为HS。入院后完善术前各项常规检查,超声检查明确胆囊结石情况,存在结石时,予以脂餐实验评估胆囊收缩功能,CT血管造影明确脾脏大小、脾血管走行及分支情况等(图1A)。均无手术禁忌证。17例合并胆囊结石。
1.2 脂餐实验胆囊功能评估方法[7]患儿测定前1 d晚餐后禁食,清晨空腹行胆囊B超检查,测量胆囊最大横截面的长度、宽度及高度,计算胆囊体积=0.52×长×宽×高,先测量空腹胆囊容积,脂餐(食用2枚煎鸡蛋)后半小时再次测量胆囊长、宽、高,计算胆囊残余容积。胆囊排空指数=(1-胆囊残余容积/空腹胆囊容积)×100%,胆囊排空指数大于50%表示胆囊功能正常,收缩良好。
1.3 器械 Quad-port(图1B);普通腹腔镜,包括5 mm腹腔镜、5 mm普通腹腔镜器械;腹腔镜专用取物袋(10 mm杆径,袋口直径13 cm);胆道镜。

图1 术前准备情况(A:脾血管的CT血管造影;B:单孔腹腔镜专用Quad-port)
1.4 术前准备 严重贫血者,术前晚输红细胞悬液1 U。术前均置胃管、导尿管。气管插管静吸复合麻醉。小婴儿取平卧位、大龄儿取平卧分腿位,腹腔镜显示器置于头侧,术者立于床尾或两腿之间,扶镜助手立于患儿右侧。
1.5 手术方法 沿脐下缘做约2.0 cm弧形切口(图2A),开放式入腹,置入Quad-port。建立气腹后进镜,置入操作器械,探查脾脏大小,注意探查脾门、大网膜、横结肠系膜等区有无副脾,发现副脾时先予以切除,以免遗漏;注意胆囊形态有无萎缩。超声刀沿胃大弯打开大网膜无血管区进入小网膜囊,显露胰体尾(图2B)。自右上腹壁缝入4-0带针丝线,浆肌层缝挂胃体后壁后再由右上腹壁缝出,体外收紧后打结向右向上牵开胃,以增加胰体尾、脾门区术野显露(图2C)。辨认胰体尾上缘博动的脾动脉,打开胰腺包膜,游离出脾动脉,予以双重丝线结扎(图2D)。上抬脾下极,紧贴脾脏用超声刀离断脾结肠韧带、下部分脾肾韧带、脾胃韧带、脾膈韧带、上部分脾肾韧带(图2E)。紧贴脾门,用超声刀精准分离、离断脾蒂内的结缔组织,裸化近脾门的脾动、静脉主干及分支(图2F),超声刀凝断近端已结扎的脾动脉,4号丝线双重结扎脾静脉主干或其分支后,两线之间用超声刀凝断,最后完全游离脾脏。腔镜专用取物袋置入腹腔套入脾脏,去除port,牵拉取物袋袋口,拉出脐缘切口,袋内破碎脾脏后逐步完全取出(图2G)。再次放置port,确切检查无活动性出血,冲洗脾窝,吸净脾窝及盆腔冲洗液,剪断胃壁悬吊线,并检查有无浆肌层撕裂。撤除器械,逐层缝合脐缘切口,生物胶粘合皮肤(图2H)。合并胆囊结石同期的胆囊切开术:镜头转向右侧,胆囊下方预垫纱布、自制指套取物袋,超声刀于胆囊底少血管区纵行全层切开约2 cm,无损伤抓钳自胆囊管向胆囊底切口挤压出多数结石,胆道镜自Quad-port上方的通道插入腹腔后进入胆囊,检查有无残余结石并取尽结石,4-0可吸收线先全层再浆肌层缝合胆囊切口。

图2 术中操作图(A:脐下缘弧形切口;B:打开网膜囊;C:悬吊胃体;D:分离后结扎脾动脉;E:胃底、肝左外叶悬吊;F:脾血管的裸化;G:取物袋取脾;H:术毕切口外观)
1.6 术后管理 预防性应用抗生素、止血、生长抑素抑制胰酶、补充水电解质等,胆囊切开取石患儿术后第2天起口服熊去氧胆酸3个月;术后6 h取半卧位,术后第1天拔除导尿管、下床活动;术后第2天拔除胃管,试饮水、进流质无不适后快速恢复正常饮食。
1.7 随访 通过微信群与患儿家长密切随访至今。复查血常规了解红细胞、血红蛋白、血小板情况,血小板升高至700×109/L予以口腹双嘧达莫,升至1 000×109/L予以加服阿斯匹林;复查肝功能,了解胆红素情况;复查超声了解胆囊情况、门静脉系有无血栓等。

2 结 果
2.1 手术情况 手术均获成功,无术中加孔、中转开腹,术中无大出血。52例患儿仅行SILS,手术时间平均(181.36±50.81)min;术前检查发现胆囊结石者,脂餐实验均证实胆囊收缩功能正常,15例患儿同时行胆囊切开取石术,手术时间平均(238.60±40.09)min。2例超声示少量泥沙样结石未行胆囊切开取石术,术后口服熊去氧胆酸。术中测量脾脏长径平均(14.89±2.84)cm;术中共发现副脾18个,副脾长径平均(1.18±0.40)cm。
2.2 术后恢复情况及随访结果 患儿术后均恢复顺利,无感染征象等,平均住院(11.18±3.78)d。患儿均随访至今,随访时间6个月~7年。患儿均生长发育良好,贫血显著改善无需再输血,肝功能胆红素显著降低(表1),血小板42例(63%)升至700×109/L;术后无爆发感染;15例胆囊切开取石患儿复查超声胆囊大小正常、无再发胆囊结石,2例少量泥沙样结石未切开取石患儿术后口服熊去氧胆酸,3个月后结石完全排出;无门静脉系统血栓形成;术后肤色恢复正常、脐部无明显疤痕,家长满意。

表1 67例HS患儿术前、术后相关指标的比较
3 讨 论
Eber等[8]根据血液学等检查指标,将HS分为轻度、中度与重度,轻症或无明显症状时可无需切除脾脏;中度、重度时,需行手术治疗。闫彦睿等[9]分析了输血疗法与手术治疗,结果发现,输血疗法虽能使红细胞计数、血红蛋白浓度明显升高;但需反复输血才能维持疗效;而行脾切除术的患儿术后恢复良好,未再输血,贫血、黄疸等症状得到有效改善,不仅提高了患儿的生存质量,更减少了血液资源的浪费。因此全脾切除仍是目前HS的最佳治疗方法。传统观念认为,为防止脾脏切除后凶险性感染,HS患儿需待6岁后才能行脾切除术。本组资料中患儿均为重度HS,尤其低龄儿,最低Hb 30g/L,需每周输血1次才能维持基本的生存。HS患儿手术年龄的提前仍缺乏系统的研究,但临床实践可行。本组HS脾切除术后患儿均生长发育良好,随访至今未有脾脏切除后凶险性感染病例。我们认为,重度低龄HS患儿可提前行全脾切除术。
随着腹腔镜技术的成熟与发展,LS已成为HS的标准术式[5-6]。目前临床上以多孔法(4~5孔)为主,SILS也逐渐得到应用。SILS仅需于脐皱褶处做一个约2 cm的切口,术后切口愈合后由于脐皱褶的覆盖,疤痕几乎难以察觉,这种“无疤痕”从心理到就业等对儿童非常重要[10]。SILS主要因器械的布置及外科医生与扶镜手之间的不断干扰,存在明显的“筷子效应”,操作难度高,学习曲线长,容易失败。Traynor等[11]对SILS与多孔LS进行对比分析,研究发现,经验丰富的术者行SILS与多孔LS在手术时间、中转率、并发症等方面均相近;对于儿童而言,SILS是传统微创LS的安全替代方案。手术步骤的程序化,使手术在组织损伤、安全性、时间控制等方面优势明显,因此对于成熟的手术均应予以程序化,并严格执行。SILS通过相关研究早已被证明是安全、可行的[12-13]。多数医生行LS时操作不够精准,如用切割闭合器大块组织夹闭并切断脾蒂容易出血,一旦出血在SILS下难以补救;容易出现胰尾损伤,术毕需常规放置腹腔引流管。我们在熟练的多孔LS的经验下,采用手术步骤程序化并精准操作的SILS,手术均获成功,术毕不放置引流管,方便患儿术后早期活动,术后康复快。
我们体会:(1)脐缘下约2 cm弧形切口不破坏脐环,无需术后脐部重建,更美观。(2)使用4通道专用port。拆解方便,可方便、快速取出副脾等操作;可置入10 mm的取物袋;如合并结石,可于第4个通道内置入胆道镜探查。(3)器械操作技巧。镜头恒定保持在术者左右手器械中间,如遇视野不清、器械混乱,可先退镜辨清视野、器械,再进镜调整。(4)悬吊技巧。SILS因无助手帮助暴露,必须采用有效的悬吊技术。主要有两个悬吊:胃后壁、脾下极的悬吊。胃后壁的悬吊是必须的,悬吊后才能充分显露脾体尾、脾门区,从而执行下一步的精准操作。我们的悬吊线由右上腹壁缝入、缝出,胃后壁的浆肌层缝挂处偏胃后壁的左侧,这样悬吊后胃可向上、向右充分翻转,必要时加缝胃悬吊线,尤其处理脾上极时。脾下极悬吊,多数情况下非必需,但对于巨脾、脾中下极向下向内垂时,暴露脾门区非常困难,需悬吊脾下极。左上腹壁缝入、缝出带针丝线,丝线绕过脾下极,体外适度收紧即可向上、向左侧抬起脾脏,胰尾、脾门区即可充分暴露。(5)脾动脉的预先结扎。脾动脉结扎后脾失去动脉血供,出血可控性强,手术更安全且容易成功;自体静脉血回输,减少了血液丢失,并可缩小脾脏,方便下一步的操作。(6)按序离断脾各韧带。先易后难,先离断血管少、易暴露的脾结肠、下脾肾韧带,再离断血管多、难暴露的脾胃韧带、脾膈韧带、上脾肾韧带。完全离断脾的动脉血供,最后处理脾静脉。(7)脾上极暴露及处理技巧。SILS无助手器械帮助暴露,脾上极的暴露困难,尤其大龄儿。另加胃底悬吊是有效的暴露方法。(8)脾门区精准操作、血管裸化技术的应用。超声刀精准分离、切断脾门区结缔组织及近端已结扎的脾动脉,做到脾静脉主干、分支的充分裸化后用丝线结扎。因Hem-o-lok、可吸收夹等占用空间,影响精准操作,我们采用丝线结扎静脉。(9)采用有效的脾脏缩小方法、脾脏装袋技巧。先结扎脾动脉、离断脾周韧带内动脉,最后处理脾静脉,最大化脾内血回输,脾脏缩小明显;脾脏完全游离后剪开结扎的脾静脉放出脾内积血,脾体积进一步缩小。应用腔镜专用取物袋,左手器械上抬脾下极,右手将取物袋置入脾下极下方再打开取物袋,左手将脾下极置入袋内,最后推脾上极使全脾进入袋内。可灵活改变体位方便入袋。一次装入失败导致视野不清、章法混乱时应废弃取物袋,换新的取物袋按章法套脾。预估脾脏过大,无法装入标本袋时,应果断腹腔内锐性离断脾脏,分为两块取出。(10)胰尾检查、脾窝冲洗的重要性。取脾后再安装port、建立气腹后详细检查胰尾各脾血管处理的确切性,确保无渗血。检查有无碎落脾组织,有则全部取出。冲洗脾窝,直至干净,防止无血供的脂肪等组织遗落,从而增加感染风险。最后吸尽脾窝及盆腔冲洗液。(11)术后适当的特殊处理。脾窝不放置引流管,术后6 h半卧位、术后第1天即下床活动,如术中疑有胰体尾的过多分离,术后可应用3 d生长抑素。
HS合并胆石症的发病率为21%~63%[14],本组为25%,证实儿童期HS的胆囊结石发病率较高。HS合并胆囊结石的处理仍存有争议。既往多采用胆囊切除术,担心患儿会承担二次手术的风险及癌变风险[15]。基于HS患儿的胆囊结石系溶血后胆色素沉积形成,切除脾脏后溶血大幅减少,较难形成这种结石[16-17]。本组患儿术前脂餐实验证实胆囊收缩功能正常、术中胆囊外观及大小均无明显异常,行胆囊切开取石术(图3)。术后口服熊去氧胆酸3个月,以改变胆汁成分,预防胆囊结石复发[18]。随访至今,均未见胆囊结石复发,复查超声均未见胆囊炎症、萎缩等征象。对于HS患儿保留有功能的胆囊符合生理功能,本研究的结果证实是理想选择,而且同期单孔操作下可安全完成手术。保胆取石术创伤小、疼痛轻、康复快、住院时间短、切口美观、复发率低、并发症少,是治疗HS合并胆囊结石较好的术式,符合目前的微创理念[19-20]。操作技巧方面,自胆囊颈用无损伤钳先将结石推挤出切口,可减少胆道镜反复多次取石导致的胆囊壁损伤,再次胆道镜检查确保取尽结石,切开的胆囊壁双层缝合,这些经验可供借鉴。
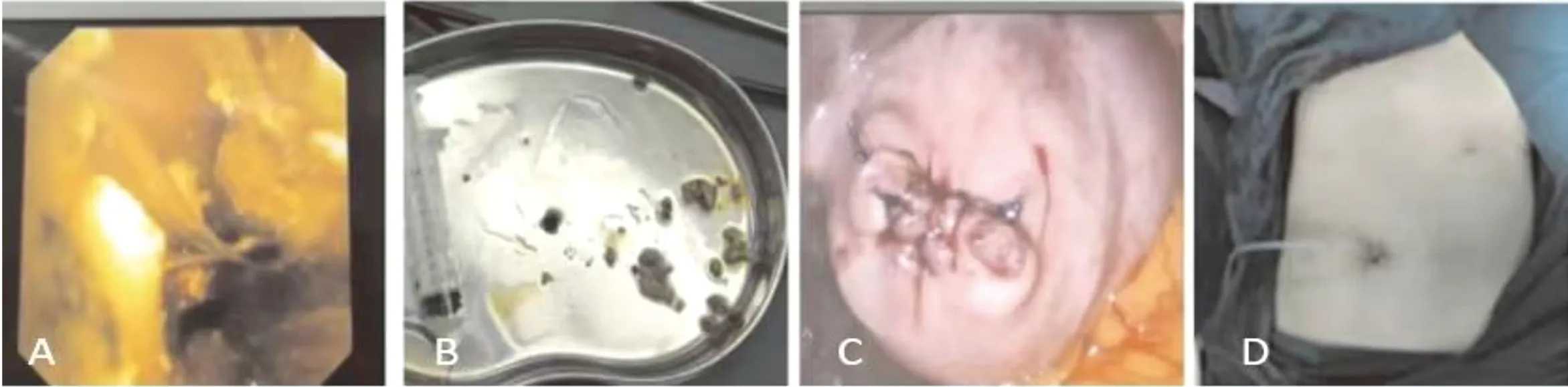
图3 保胆取石术中所见(A:胆道镜探查胆囊;B:取出的胆囊内结石;C:取干净结石后缝合的胆囊外观;D:经脐部切口放置引流管)
综上所述,对于HS患儿,SILS是理想的手术方式。程序化手术步骤、精准的操作可有效保证儿童SILS的成功完成。合并胆囊结石的HS,在胆囊功能良好的前提下行胆囊切开取石术是可行的。

