卡瑞利珠单抗治疗晚期肝癌58例
胡丹丹,李文娟,金伟,张倩玉,周守兵,刘虎
安徽省肿瘤医院肿瘤内科五病区,合肥 230031
肝癌具有较高的发病率和病死率[1-2]。在中国,原发性肝癌是第四大常见恶性肿瘤[3-5]。卡瑞利珠单抗是PD-1免疫检查点抑制剂,是一种人源化、选择性且具有高亲和力的IgG4型单克隆抗体,可与PD-1靶向结合,阻断其与PD-L1及PD-L2之间的相互作用而使机体恢复免疫功能,从而发挥抗肿瘤的作用[6-8]。随着大量临床试验的开展,卡瑞利珠单抗在肝癌的治疗上也显露出较好的临床疗效[9]。本研究对使用卡瑞利珠单抗治疗的58例晚期肝癌患者进行了回顾性分析,旨在探究该药物治疗晚期肝癌的临床疗效、免疫相关不良反应的发生以及两者之间的相关性。
1 资料与方法
1.1 一般资料 收集2018年1月至2021年12月在安徽省肿瘤医院接受卡瑞利珠单抗治疗的58例晚期肝癌患者的临床资料,包括基线资料、临床疗效评价结果和安全性相关资料。
1.2 纳入与排除标准 纳入标准:(1)临床确诊为晚期肝癌;(2)无法进行手术治疗;(3)年龄18~75周岁;(4)美国东部肿瘤协作组评分0~3分。排除标准:(1)无可测量病灶;(2)临床资料不完整;(3)伴有其他恶性疾病、严重心脑血管疾病或传染性疾病;(4)伴有门静脉血管扩张,具有较大出血风险的患者。
1.3 治疗方法 静脉注射卡瑞利珠单抗(江苏恒瑞医药股份有限公司生产)200 mg,每3周重复,单独使用或与化疗、靶向治疗联合使用,直至病情进展或无法耐受治疗。
1.4 疗效评价及毒性作用判定 可测量病灶均具有治疗前基线测量,采用iRECIST标准。目标病灶均消失视为完全缓解(CR)。基线病灶长径总和缩小>30%视为部分缓解(PR)。基线病灶长径总和增加>20%,最小绝对值升高5 mm或出现新病灶视为PD。基线病灶长径总和有缩小但未达PR或有增加但未达PD视为疾病稳定(SD)。疾病控制率(DCR)=CR+PR+SD。该研究计算治疗2周期的疾病控制率。开始治疗至第1次发生PD或任何原因死亡的时间间隔为无进展生存期(PFS)。
不良反应依据美国卫生及公共服务部常见不良事件评价标准(CTCAE)5.0分为0~4级,其中1~2级为轻度,3~4级为重度,从患者的病史和实验室检查结果或电话随访中确定毒性。
1.5 统计学方法 采用SPSS 24.0统计学软件分析数据,计数资料以例数及百分比表示,组间比较采用χ2检验;用Gehan-Breslow-Wilcoxon检验法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料 本研究共纳入晚期肝癌患者58例,中位年龄56岁。男性43例,女性15例。肝细胞癌41例,肝内胆管细胞癌17例。卡瑞利珠单抗单药治疗2例,联合治疗56例,其中联合抗血管靶向组40例,联合化疗组10例,联合化疗和抗血管靶向组6例。一线、二线、三线及以上治疗分别为34例、20例和4例。见表1。
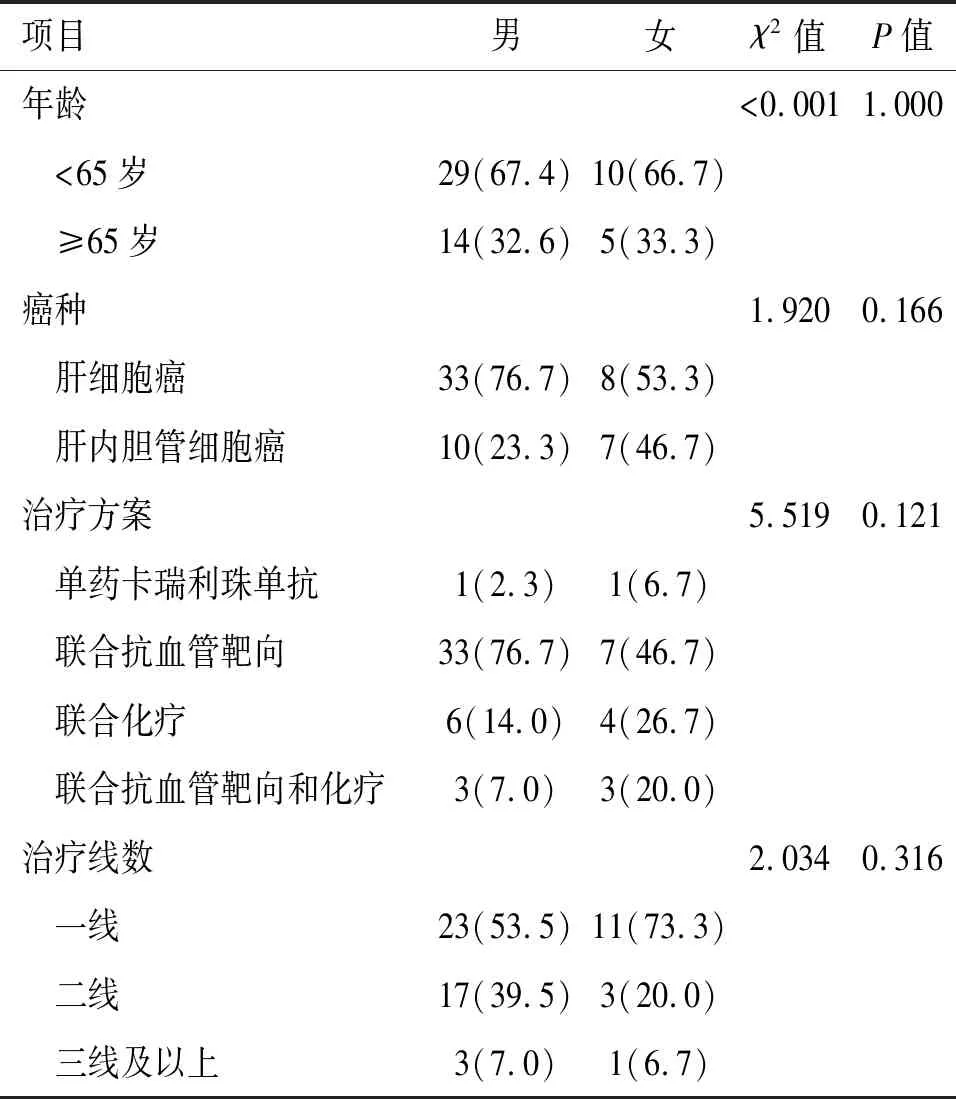
表1 58例晚期肝癌患者一般资料[例(%)]
2.2 临床疗效 治疗2周期后,评价58例患者疗效。20例患者达到PR,32例患者达到SD,6例患者发生PD。2周期DCR为89.66%。亚组分析,肝细胞癌41例,DCR为87.80%。肝内胆管细胞癌17例,DCR为94.12%。见表2。
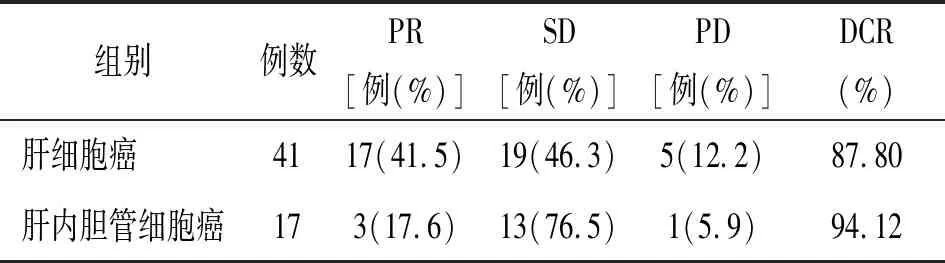
表2 58例肝癌患者临床疗效
2.3 免疫相关不良反应 卡瑞利珠单抗治疗晚期肝癌免疫相关不良反应总体发生率为67.2%,其中轻度(1~2级)36例,重度(3~4级)3例。发生频率由高到低依次为皮肤毛细血管增生症(27例)、免疫性甲状腺功能减退(19例)、免疫性肝炎(4例)、免疫性肠炎(3例)、免疫性肾炎(1例)、免疫性心肌炎(1例)、免疫性肺炎(1例)和免疫性皮炎(1例)。
2.4 无进展生存期 58例患者接受卡瑞利珠单抗治疗后的中位无进展生存期(mPFS)为8.4个月。其中39例发生免疫相关不良反应(irAEs)患者的中位mPFS为9.5个月,19例未发生irAEs患者的mPFS为6.5个月。24例只发生1种irAEs患者的mPFS为8.4个月。15例发生2种及以上irAEs患者的mPFS为10.5个月。
3 讨论
卡瑞利珠单抗是具有独立知识产权的国产PD-1抑制剂,运用新型基因重组技术在中国仓鼠卵巢细胞系中表达的人源化PD-1单克隆抗体。随着临床研究[10-11]的大量开展,其在多项临床研究中均显示出较好的疗效和可控的不良反应。在本研究中,肝细胞癌的治疗方案大部分为卡瑞利珠单抗联合抗血管靶向药物,肝内胆管细胞癌治疗方法多以联合化疗为基础加或者不加抗血管靶向药物,总体疾病控制率可达89.7%,mPFS时间为8.4个月,疗效满意。
卡瑞利珠单抗治疗的大部分不良反应是可逆的,早期识别很关键。最常见的不良反应分别为:反应性毛细血管增生症(78.3%),天门冬氨酸氨基转移酶(AST)升高(20.3%),丙氨酸氨基转移酶(ALT)升高(18.5%),甲状腺功能减退(17.8%),乏力(15.6%),贫血(15.0%),蛋白尿(11.9%),发热(10.9%)和白细胞减少症(10.4%)[12-15]。最常见≥3级不良反应依次是:贫血(4.1%),低钠血症(3.0%),AST升高(2.8%),血胆红素升高(2.6%)和结合胆红素升高(2.2%)。考虑到该研究治疗方案绝大部分为联合化疗或靶向治疗,且治疗方案具有多样性;本研究记录的不良反应主要为irAEs,结果为:58例患者治疗期间irAEs总体发生率为67.2%,其中轻度(1~2级)36例,重度(3~4级)3例。但是当前irAEs的发生机制尚未完全阐明。有研究表明,irAEs的触发,可能由于正常组织和肿瘤组织的共同表面抗原被识别,T细胞大量释放并攻击,产生治疗反应和毒性[16-18]。因此,irAEs越严重,治疗效果愈好是合乎逻辑的,但也有研究结果是阴性的[19-20],其原因可能是发生严重irAEs的人群承担风险大,甚至会因各种并发症的发生暂停治疗甚至死亡,从而缩短生存期。
本研究发现,发生irAEs的mPFS为9.5个月,未发生irAEs的mPFS为6.5个月,mPFS是有明显获益的。进一步分析得出发生2种及以上irAEs组mPFS时间较仅发生1种irAEs组延长(10.5个月比8.4个月)。可能是因为该研究中发生的irAEs程度均较轻,并未影响患者的生活质量及延误治疗。皮肤毛细血管增生症是卡瑞利珠单抗特有的irAEs,是一种发生于皮肤irAEs,其病理学特征为真皮层毛细血管明显增多和毛细血管内皮细胞增生,形态学表现特异且动态变化,目前无明显有效的预防措施[21-24]。Huang等[10]研究发现RCEEP发生率为46.6%,低于其他临床研究数据,可能是由于该研究中大部分人群与抗血管靶向药物联合使用。这也提示VEGFA/VEGFR-2信号通路可能参与RCCEP的发病机制。由此进一步推测卡瑞利珠单抗诱导的免疫激活打破了血管生成的平衡,从而导致毛细血管内皮细胞过度增殖。免疫性甲状腺功能减低在该研究中比较常见,发生率为32.8%,均为1~2级,患者多无临床表现,由血液检查甲状腺功能时发现,可予口服甲状腺素片对症处理并定期检测。免疫性肝炎、免疫性肺炎、免疫性肾炎、免疫性肠炎、免疫性心肌炎和免疫性皮炎也在该研究中观察到,但发生率较低,予对症治疗后恢复。该研究中无患者因irAEs而死亡。
综上所述,卡瑞利珠单抗应用于晚期肝癌总体疗效较好,irAEs可控制;发生irAEs的人群无进展生存时间有改善。

